重组疫苗生产车间工程设计要点及案例分析
冯重卜,安涛
(中国电子系统工程第四建设有限公司医药工程设计院,石家庄 050051)
重组疫苗是指采用基因重组技术将编码病原微生物保护性抗原的基因重组到细菌、酵母或细胞,经培养、增殖后,提取、纯化所表达的保护性抗原制成的疫苗[1]。重组疫苗生产技术作为现代生物科学领域中的重要进展,具有安全性好、生产周期短、易于放大生产,是当今与未来疫苗研制与开发的主要方向之一[2]。重组疫苗生产工艺具有生产周期长、生物安全风险高以及生产过程控制严格等特点。针对重组疫苗生产工艺特性,结合GMP和相关设计规范,开展重组疫苗GMP车间设计要点分析具有重要意义。
1 设计要点
1.1 工艺流程设计
重组疫苗的典型生产工艺流程见图1。生产工艺流程大致分为三个阶段:
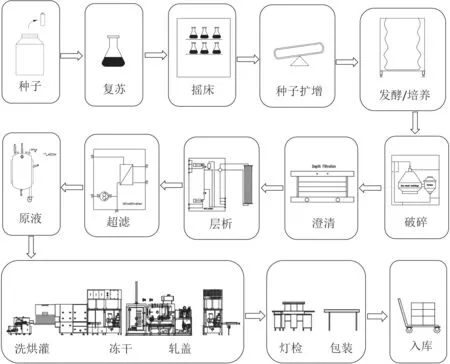
图1 重组疫苗生产工艺流程Fig.1 PFD of recombinant vaccine production
(1)上游(从种子复苏到澄清):种子复苏扩增,在种子罐扩增后,在发酵罐/生物反应器进行批培养。原核表达体系经细胞破碎,澄清,进入下游工艺,真核表达体系经过澄清,收获液进入下游。
(2)下游(从层析到原液):收获液经过不同类型的层析柱,去除其中的蛋白碎片、DNA等,经超滤浓缩,获得精纯产物,加入佐剂制得原液。
(3)制剂(从原液到成品入库):原液经制剂分装-灯检-包装得到成品,送至2 ~ 8 ℃库中保存。重组疫苗的制剂型式有:预灌封水针、西林瓶水针、冻干等。
1.2 车间布置设计
1.2.1 车间布置主要遵循的标准规范
《药品生产质量管理规范(2010年修订)》;
GB 50016—2014《建筑设计防火规范》(2018年版);
GB 50073—2013《洁净厂房设计规范》;
GB 50457—2019《医药工业洁净厂房设计标准》。
1.2.2 布置原则
(1)满足工艺流程要求:根据工艺流程,重组疫苗分为种子扩增,发酵/培养,纯化,配液及清洗,制剂等功能区。为方便操作,减少折返,车间布置宜按照生产流程展开[3]。
(2)满足GMP要求:车间设计遵循《药品生产质量管理规范(2010年修订)》附录3“生物制品”[4]。种子扩增在C级背景下完成,发酵/培养,纯化,在D级背景下完成,配液及清洗环境设为D级。除菌过滤在层流保护完成。
(3)满足生物安全的要求:重组疫苗由特定基因工程菌或动物细胞制得,生产过程中会伴随工程菌或宿主病毒,存在生物污染的潜在危险[5]。在进行布置时,应考虑将有生物活性区与无生物活性区严格分开。生产废气经过滤吸附后排空,废水、废固灭活处理,降低生物安全风险。
(4)满足疏散要求:遵循建规对防火分区、安全疏散的相关规定。
1.2.3 人/物流组织
人/物流宜采用单向流设计。有生物活性的区域设置独立的人物流通道,人员经更衣进入各功能区域,操作结束后从返回走廊退出,各出入口设置门禁,保证流向为单向。有生物活性的废弃物先经灭活,再经返回走廊退出生产区,最大程度避免交叉污染。
1.3 净化系统设计
空调系统依据生产的功能分区,将种子,发酵/培养,纯化,配液及清洗等分别采用独立机组。由于细胞收获、纯化等步骤存在非密闭操作,有生物活性暴露的风险,空调系统应独立。不同洁净级别维持压差梯度。有生物活性的房间排风经过处理后排放,并保持相对负压。
1.4 洁净公用工程设计
1.4.1 制药用水系统
纯化水主要用于CIP系统、工器具清洗等工序。纯化水以饮用水为原料制得,水质符合药典标准。纯化水通常采用常温储存和分配,并进行周期性的消毒[6],以降低微生物负荷。纯化水用点采用“U形三通+隔膜阀”组合,阀门处死角长度满足3D原则。
注射用水主要用于配液及清洗的终淋等工序。注射用水以纯化水为原料蒸馏制得,水质应符合细菌内毒素试验要求。注射用水可采用70 ℃以上保温循环,进行周期性灭菌,以防止微生物污染。注射用水用点可采用零死角块阀和多通道阀门。
纯蒸汽主要用于灭菌和关键岗位的空调加湿。纯蒸汽以纯化水为原料制得,并检测干燥度,过热度,不凝气体含量等指标,纯蒸汽冷凝水应达到注射用水标准。纯蒸汽用点设计应保证冷凝水及时排放,降低微生物和内毒素的污染风险。
1.4.2 压缩空气和洁净氧气
压缩空气主要用于物料转移和仪表气。压缩空气采用无油螺杆空压机制得,工艺压空用点需要在终端设置除菌过滤器。
洁净氧气主要用于细胞培养。可采用钢瓶汇流排或分子筛制氧机组获得。氧气用点需要在终端设置除菌过滤器。
1.4.3 废水灭活
破碎、纯化等操作产生的生物活性废水应统一收集,经121 ℃蒸汽灭活后,方可排入污水处理系统。
2 案例分析
图2展示了某生物制品公司的重组疫苗原液生产车间设备布置。本项目采用重组工程菌经过菌种、发酵、粗纯、精纯、吸附(不带菌)等步骤得到原液,该工艺步骤长,易发生交叉污染、混淆。生产过程中伴随重组工程菌及碎片,易产生污染。该车间是改造项目,原液生产车间及空调系统新建,制剂车间、器具清洗及洁净公用工程系统可以依托原有工程。由于是改造项目,平面布局受到一定限制。根据本项目以上的特点,在设计过程中做了如下考虑:
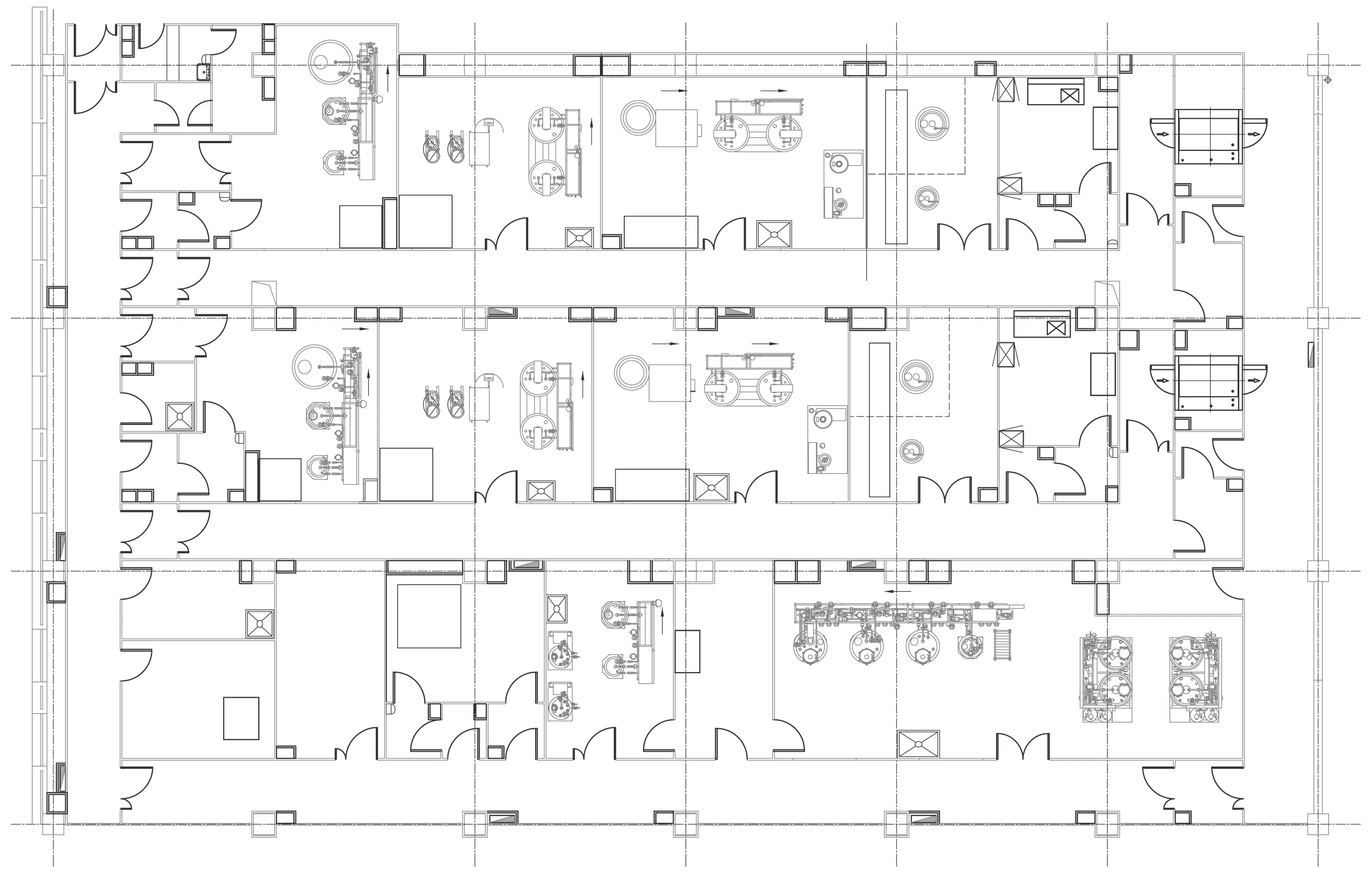
图2 基因重组疫苗案例Fig.2 The case of recombinant vaccine workshop
(1)根据产能分析,本车间需要设置两条生产线,综合考虑平面的局限和生产管理的需要,设计两条相互独立的平行生产线,空调系统独立,配液系统共用。两条生产线采用相同的配置,方便施工和生产运行管理。配液区、CIP等辅助区域与生产区域分开,避免了辅助区域的染菌风险。
(2)本车间设置三台组合式空调,其中两条生产线的菌种、发酵、粗纯、精纯等带菌功能间、退更、灭菌及带菌走廊单独设置空调,粗纯间、精纯间有工程菌碎片污染风险,不回风。吸附间及配液间等不带菌区域没有生物安全风险,共用一台空调机组。
(3)本车间两条生产线采用人、物单向流设计。设置洁净走廊和退出走廊,人员在更衣后进入D级洁净走廊,菌种、发酵、初纯、精纯的岗位操作人员经过正压缓冲进入带菌走廊直接进入生产岗位,人员退出时需退更后进入退出走廊。待清洗器具需要灭活后送到清洗中心洗涤;废弃物先经灭活后送到厂区指定地点集中处理;废水收集后,蒸汽灭活后方可进入污水系统,最大程度降低生物安全风险。
通过以上措施,在局促的平面中设置了两条平行重组疫苗生产线,并配套配液、CIP等系统。目前该车间已完成改造,顺利通过GMP认证,为该疫苗的生产提供了保障。
3 结束语
重组疫苗生产车间设计需要符合生产工艺,遵循GMP等法规,合理组织人物流,满足生物安全要求。本文提供了一种重组疫苗生产车间的布置方案,随着生物制药行业不断发展,重组疫苗车间设计经验仍需在实践中不断完善和改进。

