前哨淋巴结阳性乳腺癌患者发生非前哨淋巴结转移的危险因素分析
侯筱飒,杨振江
(辽宁省朝阳市中心医院普外科,辽宁 朝阳 122000)
近年来,乳腺癌的患病率及致死率在女性癌症中已跃居首位[1],对女性的生命健康造成极大威胁。乳腺癌患者的腋窝淋巴结是否有肿瘤转移是临床选择治疗方法和预后评估的重要依据,而前哨淋巴结(sentinel lymph node SLN)活检早已成为评估腋窝淋巴结有无转移的标准探查方式。若患者的SLN活组织病理检查(活检)结果为阴性,表明其腋窝淋巴结尚未遭到肿瘤细胞侵袭,则不必行腋窝淋巴结清扫(axillary lymph node dissection,ALND);若患者的SLN 活检结果为阳性,则需进一步行ALND,以确保肿瘤细胞被清除[2]。但有研究表明,仅约40%的SLN 阳性患者可出现非前哨淋巴结(non-sentinel lymph node,nSLN)受累[3],也就是说对其余大部分SLN 阳性患者行ALND 是多余的,因清扫既不能进一步提供腋窝淋巴结分期信息,患者在预后方面也不能获益,且严重影响了患者的生活质量。
随着ACOSOG Z0011、IBCSG23-01等前瞻性研究相继完成,结果显示,SLN 部分受累的乳腺癌患者中接受ALND 患者的无病生存期(disease-free interval,DFS)、总体生存期(overal survival,OS)与未接受ALND 者相比,并无差异[4]。可见,正确评估乳腺癌患者的腋窝淋巴结状态极为重要。
目前,炎症与肿瘤间的关系日益受到关注,但国内对炎症因子与nSLN 转移间关系却鲜有报道,故本研究纳入中性粒细胞/淋巴细胞比值(neutrophils-lymphocytes ratio,NLR)、血小板/淋巴细胞(platelet-lymphocyte ratio,PLR)2 个炎性指标及其他相关指标,分析SLN 阳性乳腺癌患者发生nSLN转移的危险因素,为临床选择是否行ALND 提供参考。
资料与方法
一、资料
收集我院2017年7 月至2020年7 月间收治的SLN 活检阳性的乳腺癌病例,入选标准如下。①经病理证实为浸润性乳腺癌;②术中冰冻病理、切除活检或穿刺活检均显示至少1 枚SLN 有转移,并行ALND;③术后病理证实SLN 阳性,以排除术中冰冻假阴性;④临床和影像学检查提示腋窝淋巴结转移阴性;⑤术前未接受过放疗、化疗等系统治疗。
排除标准如下。①初次就诊就有肿瘤远处转移或局部复发的乳腺癌患者,或既往有腋窝手术史的患者;②有其他血液系统疾病、炎性疾病等;③合并其他肿瘤者;④炎性乳腺癌者。最终本研究纳入了符合条件且临床病理资料均完整的SLN 阳性患者共154 例,均为女性,根据其nSLN 病理检查结果,将其分为nSLN 阴性(nSLN-)组和nSLN 阳性(nSLN+)组,并分析2 组间的临床资料。本研究已得到我院伦理委员会批准(2020年),所有患者均签署知情同意书。
二、方法
1.收集资料:收集患者的一般临床及病理资料,包括年龄、绝经情况、原发肿瘤大小、组织学分级、脉管侵犯、神经侵犯、中性粒细胞计数、淋巴细胞计数、血小板计数,雌激素受体、孕激素受体及人类表皮生长因子受体2(epithelial growth factor receptor 2,HER-2)、细胞增殖抗原(Ki-67)的表达情况。
2.判断标准:雌激素受体和孕激素受体阳性的判断标准为,阳性细胞占所有观察细胞的比例≥1%。免疫组织化学(免疫组化)(试剂见表1)染色显示HER-2(+)/(-)定义为阴性,HER-2(3+)定义为阳性,HER-2(2+),必要时进一步行荧光原位杂交(flourescence in situ hybridization,FISH)检测,若FISH 检测结果为阳性,则HER-2(2+)为阳性。Ki-67≥14%为阳性,<14%为阴性。根据美国癌症联合会(第8 版)[5]乳腺癌分期标准将肿块按直径分为T1(≤2 cm)、T2(2~5 cm)、T3(>5 cm)期。

表1 免疫组化所涉及试剂来源
3.NLR、PLR 计算:从患者病历资料血常规中收集中性粒细胞、血小板、淋巴细胞计数,计算NLR、PLR。所有患者均于术前3 d 内采集外周血,采血当日均无发热及感染征象。
4.SLN 活检:采用美蓝(1%亚甲蓝)染色示踪法,于术前10 min 在乳晕边缘皮下注射亚甲蓝3 mL,局部按摩5 min 后于腋窝下皱襞取弧形1.5 cm切口,沿蓝染淋巴管仔细解剖,寻找SLN,符合下列任意一条即为前哨淋巴结。①呈现为蓝色的淋巴结;②蓝色淋巴管引流的淋巴结;③虽未染色但触及肿大、粘连、质硬的可疑淋巴结。找到后将其送术中快速病理检查,若SLN 阳性则继续行ALND,所有SLN 标本及肿瘤标本均于行术后送病理科,制成石蜡切片,行HE 染色后观察结果。
5.统计学处理:采用SPSS 25.0 软件进行数据分析。将定量资料转化为定性资料,计数资料采用例(%)表示,单因素分析采用χ2检验,P<0.05 为差异具有统计学意义。对于NLR、PLR,绘制ROC曲线,观察最佳临值和此时的诊断灵敏度、特异度。将nSLN 是否转移作为因变量,将单因素分析中P<0.05 的因素作为自变量进行多因素Logistic回归分析。
结果
经统计学处理得到NLR、PLR 最佳临界值及相关指标(见表2)。

表2 NLR、PLR 临界值及相关指标
154 例患者中nSLN+者为73 例,nSLN-者为81 例,nSLN 转移率为47.4%(73/154)。中位年龄为54 岁(29~79 岁);肿瘤T 分期中,T1期转移率为19.7%(12/61),T2期,为47.7%(21/44),T3期为81.6%(21/44);在存在脉管侵犯的患者,nSLN 的转移率为57.4%(62/108);HER-2 阳性者中,nSLN 转移率为56.8%(54/95);NLR>2.82 的患者中,nSLN转移率为69.0%(58/84),PLR>141.38 者中,nSLN转移率为68.9%(62/90);中位SLN 阳性数目为2 枚(1~6 枚),SLN 阳性数目>2 枚者,nSLN 转移率为76.0%(57/75)。
采用单因素分析提示,原发肿瘤T 分期、脉管侵犯、SLN 阳性数目、HER-2 表达状态、NLR、PLR是nSLN 转移的危险因素(见表3);进一步Logistic回归分析显示,原发肿瘤T 分期、NLR>2.82 和SLN阳性数目>2 枚是nSLN 转移的独立危险因素(见表4)。

表3 nSLN-组与nSLN+组乳腺癌患者的临床病理特征比较[n(%)]
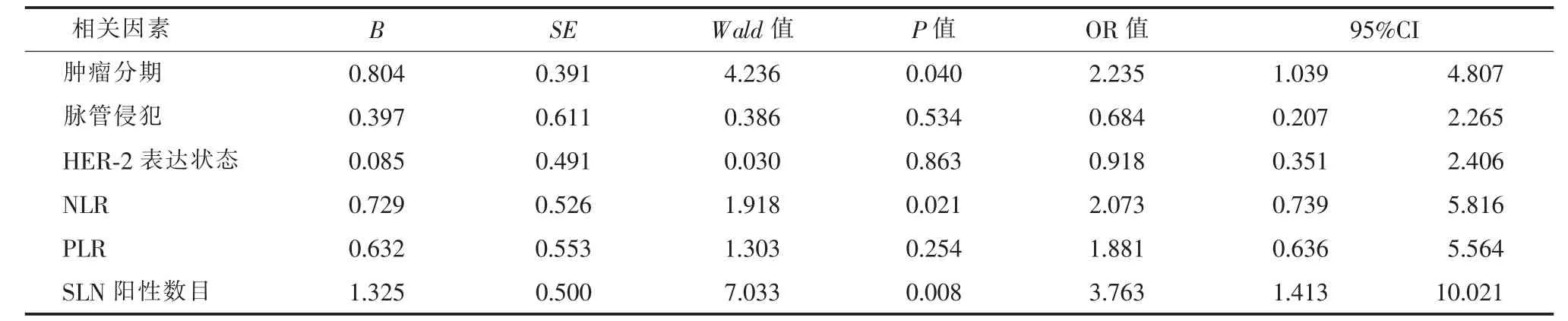
表4 nSLN 转移相关危险因素的多因素Logistic 回归分析
讨 论
一、SLN 阳性乳腺癌患者行ALND 的必要性
目前众多研究显示,并非所有SLN 阳性患者均需常规行ALND。ACOSOG Z0011 研究[7]表明,SLN 转移≤2 枚时,符合条件接受保乳治疗的患者不行ALND 是安全的,而行ALND 的患者中nSLN转移率约为27%。本研究中,SLN 阳性数目≤2 枚占51.3%(79/154),该部分患者发生nSLN 转移的比例为20.3%(16/79),低于Z0011 试验结果。同样,AMAROS 试验[8]表明行乳房切除术的患者不行ALND 时,可以腋窝放疗代之。
二、原发肿瘤直径
既往观点认为,肿瘤越大,越靠近乳头、皮肤等淋巴管丰富部位,更易发生淋巴结转移[9];相关研究也表明,原发肿瘤大小是SLN 阳性乳腺癌患者发生nSLN 转移的危险因素[10],均支持本研究的结果。
三、脉管浸润
脉管浸润最早被纪念斯隆-凯特琳癌症中心纳入预测nSLN 转移的研究中,随后该研究结果也表明脉管侵犯是患者发生nSLN 转移的危险因素[11]。本研究中出现脉管侵犯患者发生nSLN 转移的百分比为57.4%(62/108);而没有脉管侵犯的患者,其发生nSLN 转移的百分比为23.9%(11/46),两者间有显著差异。但本研究行多因素分析,未能证实脉管侵犯是SLN 阳性乳腺癌患者发生nSLN 转移的独立危险因素。结合上述研究,考虑原因可能与本研究样本量小有关。
四、HER-2 阳性表达
HER-2 为肿瘤相关抗原EGFR 家族中的一员,在正常乳腺组织中呈低表达状态,在乳腺癌组织中的表达高于正常组织;HER-2 阳性乳癌患者较HER-2 阴性者更易出现淋巴结转移[12]。孟垒等[13]以三阴性乳腺癌为参考,发现HER-2 过表达是患者发生nSLN 转移的独立危险因素。本研究行单因素分析显示,HER-2 阳性表达是SLN 阳性乳腺癌患者发生nSLN 转移的危险因素,与既往报道一致。
五、SLN 转移数目
本研究中SLN 阳性数目>2 枚时,nSLN 转移率为76.0%(57/75);SLN 阳性数目≤2 枚时,nSLN 转移率20.3%(16/79),差异有统计学意义。故本研究认为,SLN 转移数目越多,患者发生nSLN 转移的可能越大,与既往研究[10,13]结果一致。
六、炎症指标
本研究还分析了NLR、PLR 与nSLN 转移间的关系。随着肿瘤微环境与肿瘤细胞的作用日益受到关注,炎症已被证实与乳腺肿瘤生长、血管生成及远处转移密切相关[14]。中性粒细胞增多导致机体抑制免疫反应的能力增强,活化后的中性粒细胞产生白细胞介素、肿瘤坏死因子α及粒细胞集落刺激因子等,促进肿瘤细胞分化、生长[15]。淋巴细胞减少表明机体免疫监视能力减弱,诱导肿瘤细胞凋亡和抑制肿瘤细胞增殖、迁移的能力降低。而肿瘤细胞可改变血小板表型和血小板RNA 谱等,从而诱导肿瘤-血小板聚集;反之,血小板可发挥抗凋亡作用,发出增殖信号和分泌血管生成因子,从而促进肿瘤细胞生长[16]。
NLR、PLR 等外周血相关免疫指标因简单易得、稳定可靠,常被用于肿瘤(如胆囊癌、肝癌、肺癌等[17-18])的诊断及预后评估。也有学者就其对乳腺癌诊断及预后进行了研究,结果发现,术前外周血NLR、PLR 是鉴别乳腺良、恶性肿块的有效指标[19]。术前NLR 可能是预测乳腺癌患者术后的有效生物标志物[20],高PLR 患者接受新辅助化疗后的疗效较低PLR 患者明显差,NLR、PLR 均与乳腺癌死亡风险增加独立相关[21]。但目前国内外关于NLR、PLR 对乳腺癌患者nSLN 转移预测价值的研究尚少。本研究将其与临床病理资料一并分析,旨在发现更多影响SLN 阳性乳腺癌患者nSLN 转移的危险因素,更全面地为临床治疗提供参考,这也是本研究不同于以往同类研究之处。
薛婷等[22]分析得出,NLR、PLR 与nSLN 转移相关,且NLR 是nSLN 转移的独立危险因素,NLR、PLR 诊断nSLN 转移的最佳临界值分别为2.39、132.17,与本研究结果相近。Ishizuka 等[23]的研究发现,nSLN 转移组的PLR 明显降低,与以往报道中高PLR 与患者预后不良的结论相悖[24],推测可能是发生nSLN 转移的这部分患者宿主免疫系统对淋巴结的反应导致了外周血淋巴细胞增多,因而导致低PLR。但该研究并未得出NLR 与nSLN 转移相关的结论,这与Azmi 等[25]的研究一致。本研究行单因素分析的结果也支持高PLR 是nSLN 转移的危险因素。目前部分研究显示的NLR、PLR 与nSLN 转移间关系的结果不同,考虑其原因可能是外周血检验试剂不同、排除标准不完全或地域人种的差异导致的,但NLR、PLR 等外周血免疫指标简单易得、稳定可靠,可较好地反映出机体抗肿瘤免疫与炎症反应间的动态变化与制衡,其诊断价值期待后续大量研究进一步证实。
总之,本研究显示,在SLN 阳性乳腺癌患者中,原发肿瘤T 分期越高、NLR>2.82 和SLN 阳性数目>2 枚者发生nSLN 转移的可能较大,对于这部分患者,进行ALND 更有意义。本研究尚存在一些不足之处,如SLN 检测准确率无法评估,对微转移可能存在低估,只针对SLN 宏转移分析,若加入SLN微转移病例可使研究更加完整;此外,本研究样本量不足,尚需进一步积累。

