元宝枫种子发育过程中油脂积累与可溶性糖、蛋白质之间的关系
马秋月 王亚楠 李淑顺 闻婧 朱璐 颜坤元 李淑娴 任杰 张斌 李倩中

摘要: 元宝枫是中国重要的木本油料树种,具有重要的观赏价值和药用价值。本研究对元宝枫种子发育过程中脂肪酸含量的动态变化以及油脂积累与可溶性糖积累和蛋白质积累之间的关系进行分析。结果表明,油体和蛋白体在元宝枫花后80 d时开始发育,且后期数量均大量增多,直至填滿整个细胞。元宝枫种子发育过程中,油脂含量整体呈现“上升-下降-上升”的趋势,其中油酸和亚油酸是2种主要的脂肪酸,且积累模式大致相同;蛋白质含量在种子发育过程中不断增加,在花后210 d达到最大值(161.18 mg/g),且蛋白质积累与油脂积累呈显著正相关(P>0.05)。本研究结果为元宝枫育种和栽培管理提供了重要理论依据。
关键词: 元宝枫;种子发育;脂肪酸;可溶性糖;蛋白质
中图分类号: S789.5 文献标识码: A 文章编号: 1000-4440(2021)04-0982-08
The lipid accumulation and its relationship with soluble sugar and protein in Acer truncatum Bunge seeds development
MA Qiu-yue1, WANG Ya-nan2, LI Shu-shun1, WEN Jing1, ZHU Lu1, YAN Kun-yuan1, LI Shu-xian2,REN Jie3, ZHANG Bin2, LI Qian-zhong1
(1.Institute of Leisure Agriculture, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China;2.Co-Innovation Center for Sustainable Forestry in Southern China, Nanjing Forestry University, Nanjing 210037, China;3.Institute of Agricultural Engineering, Anhui Academy of Agricultural Sciences, Hefei 230031, China)
Abstract: Acer truncatum Bunge is an important woody oil tree with ornamental and medicinal values in China. The dynamic changes of fatty acid content and the relationship of oil accumulation with soluble sugar accumulation and protein accumulation were analyzed during the development of A. truncatum seeds. The results showed that oil bodies and protein bodies were firstly observed at 80 d after flowering, and the number gradually increased until the whole cell was filled. The lipid content showed an upward-downward-upward trend in the seed development. Oleic acid and linoleic acid were two main fatty acids, and the accumulation patterns were similar. The protein content increased continuously during seed development and reached the maximum value(161.18 mg/g) at 210 d after flowering. Protein accumulation was positively correlated with the lipid accumulation (P>0.05). The results of this study would provide a theoretical basis for the breeding and cultivation management of A. truncatum.
Key words: Acer truncatum;seed development;fatty acid;soluble sugar;protein
油脂是人类维持生命活动所需能量的主要来源,食用植物油的需求量随着经济的发展以及人民生活质量的提高逐步增加。中国对食用油的需求量也不断加大,食用油供给紧缺,寻找品质好、使用价值高的木本油料作物已经成为国家食品发展的重要议题之一。木本油料加工是中国的传统工业,其油脂中含有大量的不饱和脂肪酸和功能性脂肪酸,不仅可以食用还能起到保健作用,是优质的食用油来源[1-3]。
元宝枫(Acer truncatum)作为著名秋季观叶树种,除具有很高的观赏价值外,也是中国重要的多功能木本油料树种[4-7]。其种仁含油率高达约48%,不饱和脂肪酸含量可达90%以上,除富含油酸和亚油酸等不饱和脂肪酸外,还含有5%~6%的神经酸[6-9],而神经酸是大脑神经细胞和神经组织的核心天然成分,也是大脑发育和维持的必须营养物质,在治疗阿尔茨海默病、记忆力减退、艾滋病等的应用中潜力巨大[10-12]。元宝枫种仁油(元宝枫籽油)理化特性与花生油、大豆油、核桃仁油等十分相近,可作为优质的食用油[6,8-9],2011年元宝枫籽油被卫生部批准为新资源食品,元宝枫于2014年被国务院办公厅列为重点推广的木本油料树种,可见其发展与应用前景广阔。目前,元宝枫的研究主要集中于资源开发和利用方面,对种子发育过程中油脂和脂肪酸的积累规律以及它们与糖类和蛋白质积累之间的关系鲜有报道。
一般来讲,在油料种子的成熟过程中,种子体积不断增大,脂肪酸含量也会急剧上升,同时各种活性成分含量也会发生明显变化。在植物种子中,油脂主要以三酰甘油(TAG)的形式贮藏在种胚或者胚乳的油体中[13-14]。在种子发育过程中,光合作用合成的碳水化合物被转化为不同的贮藏化合物,如油脂、糖类、蛋白质等[15-16],但是积累模式在不同植物间的差异不同。本试验通过对元宝枫种子发育过程中脂肪酸的积累及其与糖类和蛋白质积累之间的关系进行研究,以期为后期元宝枫种子油脂的品质改良以及种子油脂合成机制的研究提供理论依据。
1 材料与方法
1.1 植物材料
以江苏省南京市溧水区槭树良种基地生长良好的3株8年生元宝枫树为试验材料,取花后80 d、120 d、150 d、180 d、210 d的元宝枫翅果,分别在内部、外部、上部、下部取样,装于封口袋带回实验室,取出种子和种胚,并于当天测定种子质量,观察种胚形态建成。同时,剩余样品经液氮速冻后保存于-80 ℃冰箱,用于油脂、蛋白质和糖类等组分分析。
1.2 种子和种胚发育的观察与分析
随机选取10粒不同发育阶段的种子和种胚的翅果,用体式显微镜(Olympus szx16)观察各个时期的种子及种仁的发育状况;使用直尺、游标卡尺对元宝枫翅长、翅宽、种子横径、种子纵径以及种子厚度进行测量(精确到0.01 mm),并计算平均值。随机取20粒不同发育时期的元宝枫种子,用分析天平称质量,比较发育过程中种子鲜质量的变化。随后按照GB 2772-1999的要求,采用低恒温烘干法,烘17 h至恒质量,计算各时期种子的含水量。
1.3 油体观察
参照赵翠格等[17]的方法,在4 ℃用手术刀将去皮后的种仁取中间部分,切成约1 mm3的小块,经戊二醛(2%)和锇酸(2%)双重固定后,包埋于Spurr树脂中。通过超薄切片机(LKB8800)切片,经醋酸双氧铀-柠檬酸铅双重染色后用透射电子显微镜(JEM100CX)拍照观察。
1.4 油脂提取与分析
随机选取不同发育时期的种子,用刀片将种子切碎后放置于冷冻干燥机中冻干(压力为0.001 MPa),样品达到恒质量后研磨,每个样品取1.5 g放于105 ℃烘箱中烘30 min后,采用索式抽提法提取种子油脂。采用氢氧化钠甲醇溶液甲酯化后,在配有TR-WAXMS毛细管色谱柱(30.00 m×0.25 mm×0.25 μm)的日本岛津气相色谱质谱联用仪QP2010 ultra上进行脂肪酸成分分析。载体为高纯氦气,流量为1 ml/min,分流比为10。升温程序:80 ℃保持2.5 min,以15 ℃/min升至210 ℃,然后以2 ℃/min升至230 ℃,保持10 min,进样口温度为200 ℃。通过与已知脂肪酸甲酯标准品比较进行定性,采用峰面积归一法进行相对定量,以十七烷酸甲酯标准品计算脂肪酸的绝对定量。
1.5 蛋白体的观察
将花后不同时期的元宝枫种仁,用FAA固定液固定后用石蜡包埋,用Laica切片机将其切成厚度为8 μm的薄片,通过希夫-奈酚黄S染色后,在装有DP70摄像系统的显微镜(Olympus BX51)下观察蛋白体并拍照。
1.6 可溶性糖和蛋白质含量分析
分别取花后80 d、120 d、150 d、180 d、210 d的种子样品,剥去种皮,各取0.5 g样品,切碎研磨后放于5 ml乙醇中,80 ℃水浴30 min,8 000 r/min离心10 min,重复2次,收集上清液,利用蒽酮法分析可溶性糖含量。分别将0.5 g不同发育阶段的种仁在蒸馏水中研磨后,8 000 r/min下离心10 min,收集上清液,以牛血清蛋白为标准品,利用分光光度法测定可溶性蛋白含量[18]。
1.7 统计分析
使用Excel进行数据分析,以SPSS进行差异显著性和相关性分析。
2 结果与分析
2.1 翅果和种子发育
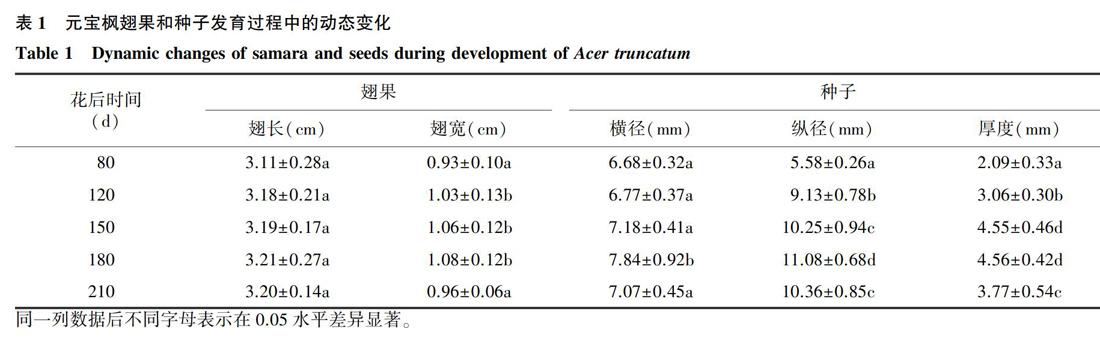
元宝枫一般在4月初开花,果期为4月中旬到11月上旬,由一个雌蕊产生2翅2种子的果实,呈元宝形,翅果扁平,成熟的种子椭圆形,无胚乳。在整個种子发育阶段,种皮和种仁颜色在80~150 d呈绿色,之后种皮颜色呈现棕褐色,而种仁为淡黄色。由表1 可以看出,在花后80~210 d的各发育阶段,元宝枫翅果的翅长差异不显著,但翅宽在210 d时显著降低到0.96 cm,这主要是由于果实的干燥脱水所致。在种子发育过程中,种子横径、纵径及厚度分别由花后80 d 的6.68 mm、5.58 mm、2.09 mm增加到花后180 d的7.84 mm、11.08 mm、4.56 mm,差异显著。当发育到210 d时,种子的横径、纵径、厚度均较180 d时显著下降。
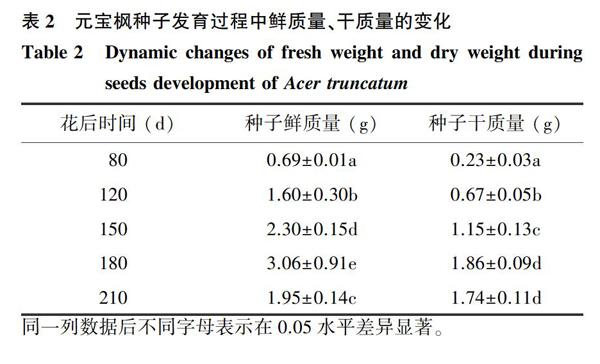
从表2可知,元宝枫种子发育过程中的鲜质量呈先增加后减少的趋势。将种子的发育分为2个时期:第一时期为花后80~180 d,是种子迅速增长期,花后180 d时鲜质量、干质量达到最大值;第二时期为种子的成熟脱水期,主要为花后180~210 d,种子的鲜质量及干质量分别下降至1.95 g、1.74 g。总的来说,整个发育阶段,鲜质量的变化速度始终快于干质量,鲜质量在所有测定阶段间均表现出显著差异,而干质量仅在花后80 d、120 d、150 d、180 d间呈显著差异,在花后180~210 d干质量比较恒定。
2.2 油脂的积累动态
为进一步明确元宝枫种子在发育过程中亚细胞状态下油脂积累的过程,本研究采用透射电镜观察元宝枫种子发育过程中油体的动态变化,结果显示,在花后80 d时可观察到少量油体存在,主要存在于液泡与细胞壁的边缘,呈近圆形(图1A、图1B)。随着种子的发育,油体逐渐向细胞中间分布,油体的数量逐渐增加,花后150 d时,大部分细胞内已经充满了油体,各油体的大小差异较大(图1D、图1E)。在180 d时油体已基本充满了整个细胞空间,油体间排列紧密,体积显著增大。此时期是油脂大量积累的时期(图1F、图1G)。花后210 d时,油体间开始出现融合(图1H、图1I)。
2.3 主要脂肪酸组分
和其他植物油脂成分类似,元宝枫种子油脂中主要由饱和脂肪酸(SFA)、不饱和脂肪酸[多不饱和脂肪酸(PUFA)和单不饱和脂肪酸(MUFA)]两大类组成。本研究对元宝枫主要的6种脂肪酸成分进行了测定和分析,结果显示,在80 d时均能检测到一定含量的脂肪酸(除神经酸外),但含量较低(表3);随后除神经酸外的其他脂肪酸呈现出“上升-下降-上升”的变化趋势,但各物质的变化规律略有不同:油酸和棕榈酸含量在花后120 d时含量最高,分别约为22.71%和4.19%,而亚油酸、花生一烯酸和芥酸含量均在210 d时达到最大值;与此不同的是,神经酸含量一直处于上升趋势,直到含量在210 d时达到约5.00%(表3);成熟种子的脂肪酸相对含量从高到低依次为亚油酸>油酸>芥酸>花生一烯酸>神经酸>棕榈酸。
由图2可知,3种类型的脂肪酸含量在花后80~210 d呈上升-下降-上升的变化趋势,在花后120 d达到峰值,分别为45.3%、23.2%、4.2%;随后开始显著下降,150 d时含量分别为35.1%、19.8%、3.0%;花后150~210 d 时,3种类型的脂肪酸含量又开始缓慢上升,且在210 d时MUFA和PUFA含量增加到整个发育过程的最高值,分别为47.1%和27.8%。在油脂积累过程中,各类型脂肪酸含量一直是单不饱和脂肪酸>多不饱和脂肪酸>饱和脂肪酸。
2.4 蛋白体观察及可溶性蛋白质含量变化特征
植物中储藏的蛋白体主要由质体、内质网、液泡发育而来[18]。观察石蜡切片发现,元宝枫种子中蛋白体是由液泡发育而来。元宝枫种子在花后80 d时胚细胞内可以观察到少量的蛋白体,但形状不规则(图3A);花后120 d时蛋白体的体积变大,液泡由1个大液泡分裂成多个小液泡,随着种子的发育,胚细胞中液泡数量变多,蛋白体的数量不断增加,但依旧存在于液泡的边缘(图3B);花后150 d时,分裂出更多的小液泡,同时占满了胚细胞空间,液泡边缘的蛋白体增多(图3C);花后180 d时,蛋白体开始聚合,胚细胞由长椭圆形变为椭圆形(图3D);花后210 d时,蛋白体已经完全聚合到一起,此时的蛋白体多为不规则的近圆形聚合体,向胚细胞的中央或者一侧集中,大部分蛋白体不与细胞壁接触,胚细胞的形状开始变得不规则(图3E)。
为更加深入了解元宝枫种子发育过程中可溶性蛋白质含量的变化特征,本研究对种子发育过程中可溶性蛋白质含量进行测定,结果显示,其含量一直呈增长的趋势(图4);花后80 d可溶性蛋白质含量为6.20 mg/g,到花后150 d时,迅速增加到102.71 mg/g,增加了96.51 mg/g;随后可溶性蛋白质的增加速度缓慢,花后180 d时含量为132.23 mg/g,;到210 d时增加至161.18 mg/g。
2.5 可溶性糖含量的变化特征
由图5可知,在元宝枫种子发育过程中,可溶性糖含量呈上升-下降-上升的变化趋势。花后80~120 d时元宝枫种子中可溶性糖含量呈增加趋势,120 d时显著增加到发育过程中的最大值;在120~180 d时含量呈下降的趋势,在210 d时可溶性糖含量又显著上升,但仍显著低于花后120 d时的含量。
2.6 油脂积累与可溶性糖含量和蛋白质含量的相关性
为了探讨元宝枫种子中油脂积累与可溶性糖代谢和蛋白质代谢之间的关系,对其进行相关性分析,由表4可以看出,果实中油脂积累与可溶性蛋白含量呈显著正相关,相关系数为0.937(P<0.05), 说明在元宝枫种子发育过程中,随着可溶性蛋白质含量的增加,油脂也不断积累,元宝枫种子中的有效物质的积累越来越丰富。
3 讨论
掌握油脂的积累规律是提高元宝枫油脂产量,提升元宝枫经济价值的关键[19]。本研究中元宝枫
种子在花后80 d出现油体,表明元宝枫油脂的积累在种子发育较晚的时期才开始进行,这与核桃(Juglans regia)、文冠果(Xanthoceras sorbifolia)的研究结果类似[19-20]。植物的光合作用产生的糖类物质会参与植物种子发育过程中油脂和蛋白质的积累[19]。以往的研究结果表明,可溶性糖会在油脂快速积累之前大量积累,但在油脂积累过程中却不断减少,有观点认为此时的糖类为油脂的合成提供所需的原料物质,但也有观点认为种子发育早期的糖类主要是用于参与细胞分裂相关的新陈代谢,并不足以满足油脂合成的积累需求[20-22],本研究发现,花后80~120 d元宝枫中可溶性糖含量呈增加趋势,且在120 d时达到整个发育过程中的最大值,而后呈下降的趋势,此时正是油脂积累的最快速阶段,因此我们推測可溶性糖为油脂的合成提供重要的原料及能量来源。
元宝枫蛋白质含量约27%,高于花生(约23%)、葵花籽(约20%)等的蛋白质含量[21]。研究结果表明,元宝枫蛋白质富含18种氨基酸,部分脂肪酸含量高于花生或棉籽蛋白质[22],是一种营养价值很高的优质蛋白质。近年来,除对元宝枫油脂进行主要研究外,蛋白质的理化性质及相关功能特性也陆续有相关报道[23-26]。本研究发现在元宝枫种子发育过程中油脂积累呈现“上升-下降-上升”的趋势,而可溶性蛋白质含量一直呈增长的趋势,且蛋白体的数量和含量也是持续增加,相关性分析结果表明油脂和蛋白合成具有显著正相关性,这与核桃[19]、文冠果[20]、拟南芥[27]的研究结果相似[19]。但不同的物种间差异较大,如油茶[28]、油菜[29]以及白羽扇豆[15]的研究结果却显示油脂积累与蛋白质积累呈负相关。
随着元宝枫种子的不断发育,油脂积累过程中的MUFA、PUFA及SFA呈上升-下降-上升的变化趋势。在不饱和脂肪酸中,亚油酸的含量最高,其次为油酸,除神经酸外的其他的脂肪酸的积累规律也是上升-下降-上升的变化趋势,但神经酸一直处于不断积累的过程;神经酸是一种单不饱和脂肪酸,目前仅在蒜头果(Malania oleifera)[30]、文冠果[31]、盾叶木、元宝枫、鸡爪槭(Acer palmatum)、色木槭(Acer pictum)6种木本油料树中含有,且含量差异较大[32]。已有的研究结果显示,不同脂肪酸的积累过程受到不同脂肪酸合成酶、延长酶、还原酶以及脱水酶等的作用,如硬脂酸会在△9-硬脂酰-ACP脱饱和酶(SAD)的作用下形成油酸,而油酸不仅会在脱饱和酶2(FAD2)作用下形成亚油酸,还会被脂肪酸延长酶(FAE)转换成长链脂肪酸(如二十碳烯酸和芥酸)[33]或超长链脂肪酸(如神经酸)[5],因此在整个油脂积累的过程中,不同脂肪酸的含量会因为不同时期关键酶的表达特性,呈现不同的积累变化趋势。研究结果显示,FAD2基因的过表达有助于亚油酸含量的储存[34-35],同样的,超表达β-酮脂酰-CoA合酶(KCS)基因同样也会提升种子中神经酸的积累[5,30]。
果实的生长发育不仅受到果实中营养物质含量的影响,与植物生长的外界营养供给也有重要的关系[36-39]。结合元宝枫种子的发育特性可知,其花后的80~120 d是种子中各种营养物质积累的关键阶段。本研究初步获得了元宝枫种子生长发育的形态特征,各发育时期的油体和蛋白体的细胞学动态形成过程以及各营养物质之间的关系,为后期制定科学的元宝枫栽培管理措施,增强元宝枫综合产业开发研究提供了重要的理论依据。
参考文献:
[1] 罗 艳,刘 梅. 开发木本油料植物作为生物柴油原料的研究[J]. 中国生物工程杂志, 2007,27(7):68-74.
[2] 王性炎. 加快木本油料发展保障食用油供需安全[J]. 中国油脂, 2009, 34(9):1-4.
[3] 杨志玲. 几种野生木本油料及其经济价值的研究[J]. 经济林研究, 2001, 19(4):36-37.
[4] 张若晨. 彩叶植物元宝枫在园林绿化中的应用[J]. 现代园艺, 2020,43(19):114-115.
[5] MA Q Y, SUN T L, LI S S, et al. The Acer truncatum genome provides insights into nervonic acid biosynthesis [J]. The Plant Journal, 2020, 104(3) :662-678.
[6] 王性炎,王姝清. 新资源食品——元宝枫籽油[J]. 中国油脂, 2011, 36(9):56-59.
[7] 呼晓姝,郝 俊,王建中. 超声波辅助提取元宝枫油的研究[J]. 中国粮油学报, 2007, 22(5):98-100.
[8] 吴隆坤,张雪萍,贾有青,等. 高含油元宝枫籽油的提取及理化性质研究[J]. 中國粮油学报, 2020, 35(4):66-70.
[9] 呼晓姝. 元宝枫种仁油的提取及其神经酸分离纯化的研究[D]. 北京:北京林业大学, 2010.
[10]CHEN J R, HSU S F, HSU CD, et al. Dietary patterns and blood fatty acid composition in children with attention-deficit hyperactivity disorder in Taiwan [J]. Journal of Nutritional Biochemistry, 2004, 15(8): 467-472.
[11]PAMPLONA R, DALFO E, AYALA V, et al. Proteins in human brain cortex are modified by oxidation, glycoxidation, and lipoxidation: effects of Alzheimer disease and identification of lipoxidation targets [J]. Journal of Biological Chemistry, 2005, 280(22): 21522-21530.
[12]TANAKA K, SHIMIZU T, OHTSUKA Y, et al. Early dietary treatments with Lorenzos oil and docosahexaenoic acid for neurological development in a case with Zellweger syndrome [J]. Brain and Development, 2007, 29(9): 586-589.
[13] KAUSHIK V, YAGAV M K, BHATLA S C, et al. Temporal and spatial analysis of lipid accumulation,oleosin expression and fatty acid partitioning during seed development in sunflower (Helianthus annuus L.) [J].Acta Physiologiae Plantarum, 2010, 32: 199-204.
[14] BAUD S, DUBREUCQ B, MIQUEL M, et al. Storage reserve accumulation in Arabidopsis: metabolic and developmental control of seed filling [J]. The Arabidopsis Book, 2008,6:e0113.
[15] BOREL S, PUKACKA S, MICHALSKI K, et al. Lipid and protein accumulation in developing seeds of three lupine species: Lupinus luteus L., Lupinus albus L., and Lupinus mutabilis Sweet [J]. Journal of Experimental Botany, 2009, 60(12): 3466-3453.
[16]DURRETT T P, BENNING C, OHLROGGE J. Plant triacylglycerols as feedstocks for the production of biofuels [J]. The Plant Journal, 2008, 54(4): 593-607.
[17]赵翠格,刘 頔,李凤兰, 等.植物种子油脂的生物合成及代谢基础研究进展[J]. 种子, 2010,29(4):56-56.
[18]郭红彦. 银杏营养贮藏蛋白质的分离鉴定及特性研究[D]. 南京:南京林业大学, 2007.
[19]陈 虹,潘存德,王 蓓,等.核桃种子发育主要营养物质积累之间的关系及脂肪酸动态变化[J].河北农业大学学报,2016,39(1):57-62.
[20]赵 娜,张 媛,王 静,等.文冠果种子发育及油脂累积与糖类、蛋白质累积之间的关系研究[J].植物研究,2015,35(1):133-140.
[21]BAUD S, BOUTIN J P, MIQUEL M, et al. An integrated overview of seed development in Arabidopsis thaliana ecotype WS[J]. Plant Physiology & Biochemistry, 2002, 40(2):151-160.
[22]ANDRIOTIS V M E, PIKE M J, KULAR B, et al. Starch turnover in developing oilseed embryos[J]. New Phytologist, 2010, 187(3):791-804.
[23]王性炎,李艳菊,王姝清. 食品蛋白新资源——元宝枫蛋白[J]. 中国油脂, 2007, 32 (8):30-33.
[24]刘昱迪,李佳美,王坤华,等.元宝枫籽蛋白的营养性及理化性质研究[J].食品科学,2021,42(2):271-277.
[25]魏希颖,吕居娴,李映丽. 元宝枫及同属植物种子总蛋白质含量和氨基酸的测定[J]. 陕西师范大学学报(自然科学版), 2004, 32(4):90-93.
[26]李 莉. 元宝枫种仁蛋白强化面包加工技术的研究[J]. 安徽农业科学, 2006,34(14):3465-3466.
[27]FOCKS N, BENNING C. Wrinkled1: A novel, low-seed-oil mutant of arabidopsis with a deficiency in the seed-specific regulation of carbohydrate metabolism[J]. Plant Physiology, 1998, 118(1):91-101.
[28]姜志娜,譚晓风,袁 军,等. 油茶果实和叶片中主要营养物质含量的变化规律[J]. 中南林业科技大学学报, 2012, 32(5):42-45.
[29]KENNEDY Y, YOKOI S J, SATO T, et al. Genetic variation of storage compounds and seed weight in rapeseed (Brassica napus L.) germplasms [J]. Breeding Science, 2011, 61(3):311-315.
[30]XU C Q, LIU H, ZHOU S S, et al. Genome sequence of Malania oleifera, a tree with great value for nervonic acid production[J]. GigaScience, 2019, 8(2):1-14.
[31]LIANG Q, LI H Y, SK L I, et al. The genome assembly and annotation of yellowhorn (Xanthoceras sorbifolium Bunge)[J]. GigaScience, 2019, 6(6):1-15.
[32]王性炎,樊金栓,王妹清. 中国含神经酸植物开发利用研究[J]. 中国油脂, 2006, 31(3):69-71.
[33]FOFANA B, CLOUTIER S, DUGUID S, et al. Gene expression of stearoyl-ACP desaturase and Δ12 fatty acid desaturase 2 is modulated during seed development of flax (Linum usitatissimum)[J]. Lipids, 2006, 41(7):705-712.
[34]WU P, ZHANG L, FENG T, et al. A conserved glycine is identified to be essential for desaturase activity of IpFAD2s by analyzing natural variants from idesia polycarpa[J]. International Journal of Molecular Sciences, 2018, 19(12):1-15.
[35]JADHAV A, KATAVIC V, MARILLIA E F, et al. Increased levels of erucic acid in Brassica carinata by co-suppression and antisense repression of the endogenous FAD2 gene [J]. Metabolic Engineering, 2005, 7(3):215-220.
[36]李文杨,尹 娟,岳建华. GA3处理对葡萄叶片叶绿素含量和果实品质的影响[J]. 江苏农业科学,2019,47(11):194-197.
[37]卯新蕊,李昊聪,申志慧,等. 桃果实矿质元素与糖酸指标的相关性分析[J].江苏农业学报,2020,36(1):164-171.
[38]张 敏,唐冬梅,仲伟敏,等. 花粉供体对贵长猕猴桃果实品质的影响[J]. 南方农业学报,2019, 50(11):2504-2511.
[39]梁文静,肖 萍,催 萌,等. 油茶果实和种子生长发育的动态[J]. 南昌大学学报(理科版),2019, 43(1):47-52.
(责任编辑:陈海霞)
收稿日期:2020-11-17
基金项目:国家自然科学基金项目(32001357);江苏省农业科技自主创新基金项目[CX(20)3155)]
作者简介:马秋月(1987-),女,吉林公主岭人,博士,助理研究员,主要从事槭树遗传育种研究。(E-mail)yue.870808@163.com
通讯作者:李倩中,(Tel)025-84390496;(E-mail)qianzhongli@jaas.ac.cn

