肝脏脱细胞基质微颗粒促进HepG2 细胞球状体形成与肝相关功能分化的研究
胡佳辰 金岩 刘文佳
肝脏组织工程研究是肝脏再生医学中的重要分支,旨在构建出肝功能替代治疗中的生物人工肝支持系统(Bioartificial liver support system,BALSS),或用于药物肝毒性筛查的生物肝组织[1]。然而,足量、易于获取的肝功能性细胞的来源问题仍未得到有效解决。HepG2 等永生化肝细胞系具有一定的肝细胞功能,具有较好的应用潜力,但肝细胞功能水平较差,是限制其在BALSS 和毒性筛查应用中的主要障碍[2-3]。
细胞的培养方式是影响细胞功能状态的关键[4-5],通过改变HepG2 细胞的普通2D 培养方式,其肝相关功能也可得到提升。由于细胞的3D 培养形式使细胞更接近于体内的3D 生存模式,因而能提高体外培养细胞的功能基因表达,更有利于细胞的功能分化[6]。研究表明,3D 球状体的培养形式相比于普通的2D 培养,能更好地促进永生化肝细胞系和人原代肝细胞(Primary human hepatocytes,PHH)的肝功能表达[6-7]。另外,细胞外的基质微环境也是影响细胞功能状态的重要因素[8-9]。细胞外基质(Extracellular matrix,ECM)是体内细胞外基质微环境的重要载体。ECM 中包含了胶原蛋白、弹性蛋白、纤维连接蛋白、层粘连蛋白以及蛋白多糖等纤维骨架成分,这些成分为多种细胞生长因子的贮存和细胞的黏附提供了条件,从而促进细胞的存活和分化[10]。因此可以推测,以3D 形式构建球状体的同时加入ECM,能够更好地促进HepG2 细胞球状体的形成和肝相关功能的分化。
肝脏脱细胞细胞外基质(Decellularized extracellular matrix,dECM)是通过脱细胞的方法获取的组织特异性ECM[11]。通过对肝脏组织进行洗脱剂和酶等的灌流和洗脱,肝脏组织中的细胞成分被去掉,留下了组织特异性的ECM 成分和部分生长因子[10-11]。研究表明,在体外培养HepG2 或PHH时加入dECM 制备的凝胶,能够更好地维持细胞的存活与功能状态[12];另外,dECM 支架再细胞化后能支持肝实质细胞的存活和功能,如白蛋白分泌、尿素合成和细胞色素P450 表达,其水平接近于正常肝脏[13]。由于dECM 具有种属间低免疫原性的特点[14],异种dECM 可以应用,并成为dECM 的重要来源。此外,dECM 具有多种应用形式,包括细胞支架与水凝胶等。微颗粒形式的dECM 能够更好保留ECM 的天然特性,同时能够应用于HepG2 细胞的3D 球状体构建。本研究推测dECM 微颗粒能够通过促进HepG2 球状体形成和提供微环境,进而促进HepG2 细胞的肝功能分化。
1 材料和方法
1.1 实验试剂和仪器
SD 大鼠,雄性,体质量250 g,SPF 级,空军军医大学动物实验中心提供。本研究符合动物实验伦理原则。HepG2 细胞系(Procell CL-0103)由武汉普诺赛生命科技有限公司提供。
肝素钠(江苏万邦生化医药股份有限公司);氢氧化钠,Triton X-100(上海麦克林生化科技有限公司);氯仿,异丙醇(天津市富宇精细化工有限公司);DMEM 高糖培养基(Gibco,美国);胎牛血清(Sigma-Aldrich,美国);Trizol,LIVE/DEAD 细胞活性毒性检测试剂盒(Invitrogen,美国);DEPC 水,引物(上海生工生物工程有限公司);5×PrimeScript RT Master Mix,RNase Free H2O,2×TB Green Premix Ex Taq Ⅱ(TaKaRa,日本);超低吸附培养板(Corning,美国),静脉留置针18 G(江西洪达医疗器械集团有限公司);人白蛋白酶联免疫吸附测定试剂盒(武汉伊莱瑞特生物科技股份有限公司);尿素检测试剂盒Urea Assay Kit(Abcam,美国)。
蠕动泵(LongerPump,英国);真空冷冻干燥机(北京松源华兴科技发展有限公司);石蜡切片机(Leica,德国);CO2恒温细胞培养箱(Thermo Scientific,美国);倒置相差显微镜,倒置荧光显微镜(Olympus,日本);离心机(Eppendorf,德国);酶联免疫检测仪(Bio-Tek,美国);基因扩增仪(Biometra GmbH,德国);实时荧光定量PCR 仪(Bio-Rad,德国)。
1.2 肝脏脱细胞基质的制备
将肝素钠生理盐水浸润静脉留置针管腔,并排空气泡,备用。SD 大鼠麻醉后备皮。沿腹正中线及肋下缘剪开腹壁,形成T 型切口,暴露肝脏与肠管。暴露肝门区及门静脉,置入留置针,经留置针注入肝素钠生理盐水,同时剪断下腔静脉,冲洗肝脏。冲洗后,剪断腔静脉、肝动脉及胆管、肝周各韧带,游离肝脏。将游离肝脏的留置针与蠕动泵管连接,以3.5 mL/min的速度依次灌流含肝素钠的PBS 溶液1 h;双蒸水,30 min 进行溶胀;含0.02%EDTA 的PBS 溶液,30 min;含1%Triton 与0.05%NaOH 的水溶液,进行脱细胞处理,持续12 h;双蒸水,4 h;含庆大霉素的PBS,8 h。将制备好的脱细胞支架放入含有双抗的PBS 溶液中,4 ℃保存。
1.3 脱细胞基质微颗粒的制备
将脱细胞基质放于液氮中冷冻2 min,随后在液氮冷冻的条件下于研磨机中研磨成粉末。分装于离心管中,于真空冷冻干燥机中冻干24 h。用PBS 重悬dECM 冻干粉末,2 000 r/min 离心5 min,沉淀,PBS 重悬为dECM 大颗粒。吸取上清,20 000×g离心15 min,弃上清,沉淀,PBS 重悬为dECM 小颗粒。再离心后,用0.3%过氧乙酸重悬沉淀,室温放置10 min进行消毒。随后离心,使dECM 沉淀,PBS 重悬清洗,重复清洗5 遍。
1.4 正常肝脏与dECM 的组织染色与形态学观察
将肝脏与dECM 浸入4%多聚甲醛中固定,过夜。取出组织块,流水冲洗,脱水,石蜡包埋,切片,脱蜡,HE、Masson 与免疫组织化学染色。扫描电镜样品制备时,将新鲜肝脏(对照)与dECM 浸入戊二醛电镜固定液中固定过夜,然后放入真空冷冻干燥机中冻干24 h。掰断或撕开截面,喷金,放入扫描电镜观察。
1.5 HepG2 细胞的培养与接种
含10%FBS 的高糖DMEM 培养基培养HepG2细胞,每2~3 d 换液一次,细胞融合至80%时传代。普通3D 培养时(对照组),将500μL 细胞悬液接种于24 孔平底超低吸附培养板或200μL 细胞悬液接种于96 孔U 型底超低吸附培养板。与dECM 混合进行3D 细胞培养时(dECM 组),用培养基重悬dECM 沉淀,加入24 孔平底超低吸附培养板或96孔U 型底超低吸附培养板中,再加入含相同细胞数量的细胞悬液。接种后的细胞培养板,置于含5%CO2、37 ℃恒温培养箱中孵育,每2 d 换液一次。24孔平底超低吸附培养板换液时,吸尽孔内培养基,加入500μL 新鲜完全培养基;96 孔U 型底超低吸附培养板换液时,只吸除孔内100μL 培养基,再加入100μL 新鲜完全培养基。
1.6 HepG2 细胞培养上清的人白蛋白和尿素氮检测
回收24 孔平底超低吸附培养板第4、6、8 天换液时的培养上清,-80 ℃保存。检测当日于冰上解冻,振动混匀并离心。按照人白蛋白酶联免疫吸附测定试剂盒和尿素检测试剂盒的方法步骤,进行检测。
1.7 实时荧光定量PCR
3D 培养12 d 时,提取dECM 组及对照组96 孔U 型底超低吸附培养板中HepG2 细胞球状体的总RNA。2D 培养时,细胞融合至90%时,提取总RNA。从培养箱中取出细胞培养板置于冰上,吸除培养液,加入PBS 清洗2 遍。吸尽PBS,每孔加入250μL Trizol,于冰上裂解5 min。将培养板孔中的Trizol 吹吸均匀后,移入无酶EP 管中。获得RNA沉淀后,用75%乙醇洗涤。用20μL DEPC 处理水溶解RNA 沉淀,测量RNA 浓度。配制10μL 的反转录体系,加入RNA 500 ng,5×RT Mix 和相应体积无酶水,进行反转录并获得cDNA。配制10μL 定量PCR 体系,依次加入TB Green Premix Ex Taq Ⅱ5μL,上下游引物各0.4μL,无酶水3.2μL,cDNA 1μL。上下游引物序列详见表1。上机进行扩增循环,获得相应数据后,以GAPDH 管家基因作为内参,根据ΔΔCt 值作图。

表1 PCR 引物序列Table 1 PCR primer sequence
1.8 统计学分析
使用GraphPad Prism 8 进行统计学分析。数据以表示,组间比较采用Student’st检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 脱细胞基质的制备与表征
正常肝脏溶胀后,经过12 h 脱细胞灌流,可见肝脏逐渐变成无色至白色之间的半透明样果冻状物质(图1A)。在脱细胞的过程中可见,有色的肝实质细胞成分被逐渐洗去,而半透明的ECM 成分被保留下来。在HE 与Masson 组织学染色中可见,dECM 呈纤维网络状结构;与正常肝脏相比,已无细胞状与肝小叶样的形态结构,但可见管腔样的形态结构;dECM 的Masson 染色为蓝色纤维样形态,提示为胶原纤维;DAPI 荧光染色可见dECM 中无细胞核状结构;SEM 显示dECM 为无细胞纤维状结构(图1B)。免疫组织化学染色显示,dECM 保留了胶原、型胶原、纤连蛋白、层粘连蛋白几种ECM 的主要成分(图1C)。

图1 脱细胞细胞外基质的制备与表征Fig.1 Preparation and characterization of decellularized extracellular matrix
2.2 dECM 颗粒的制备与粒径分布
经过液氮冷冻研磨,dECM 呈细颗粒状冰晶粉末,真空冷冻干燥后再用PBS 重悬,为白色悬浊液(图2A)。悬液在2 000 r/min 的速度下离心获得较大的dECM 颗粒,其粒径分布测量显示,体积加权平均直径为98 μm;去掉大颗粒dECM,在较高速度离心下可获得较小直径的dECM 颗粒,其粒径主要分布在数百纳米到数微米之间(图2B)。
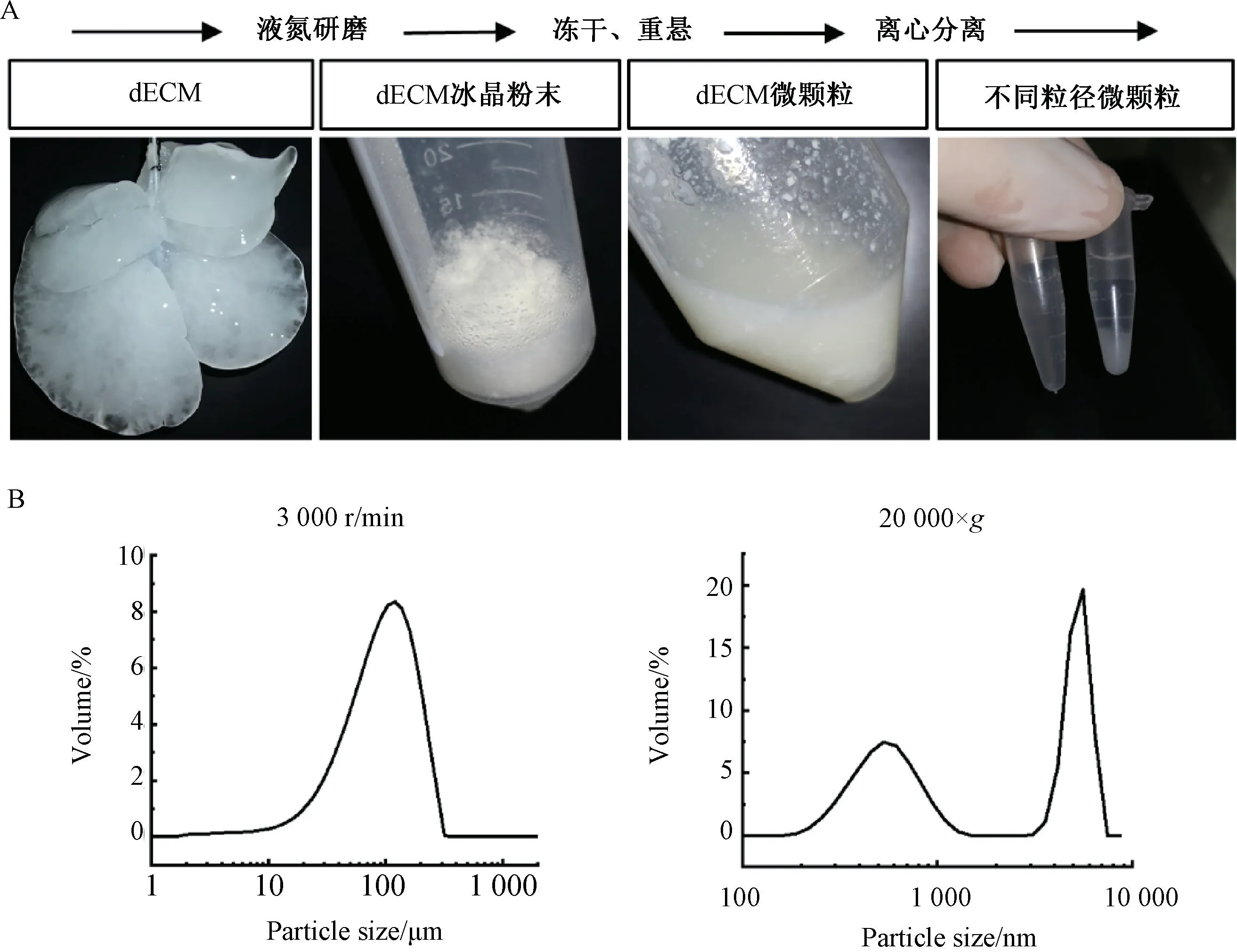
图2 脱细胞基质微颗粒的制备和粒径分布Fig.2 Preparation and particle size distribution of decellularized matrix microparticles
2.3 dECM 颗粒促进HepG2 细胞形成球状体
在U 型或平底超低吸附培养板中培养HepG2细胞,接种时加入dECM 颗粒,细胞更容易形成致密的细胞团块,即球状体(图3A、图3B)。Live/Dead染色显示,细胞团中的细胞存活,其中无dECM 对照组中有个别红染亮点(死细胞),表明dECM 颗粒能够更好地促进细胞存活(图3C)。
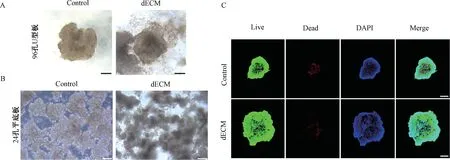
图3 脱细胞基质颗粒促进HepG2 球状体形成Fig.3 Decelluarized matrix particles promoted the formation of HepG2 spheroids
2.4 dECM 颗粒促进HepG2 球状体肝相关功能分化
连续收集细胞培养上清,dECM 组的细胞培养上清中可检测到更高浓度的白蛋白和尿素氮;对照组与dECM 组的培养上清中,白蛋白与尿素氮浓度均随着培养天数的增加而增加,而dECM 组增加的趋势更为明显(图4A、图4B)。PCR 结果显示,以3D 形式培养的HepG2 球状体,相对于2D 培养,有更高的肝功能相关基因表达;而加入dECM 的3D球状体培养组,肝功能相关基因表达水平更高,其中包括CYP 类Ⅰ类代谢酶、UGT 类Ⅱ类代谢酶、OAT2Ⅲ类代谢酶;另外,3D 培养组中Ki67 基因表达水平均低于2D 组,说明细胞处于低增殖状态(图5)。
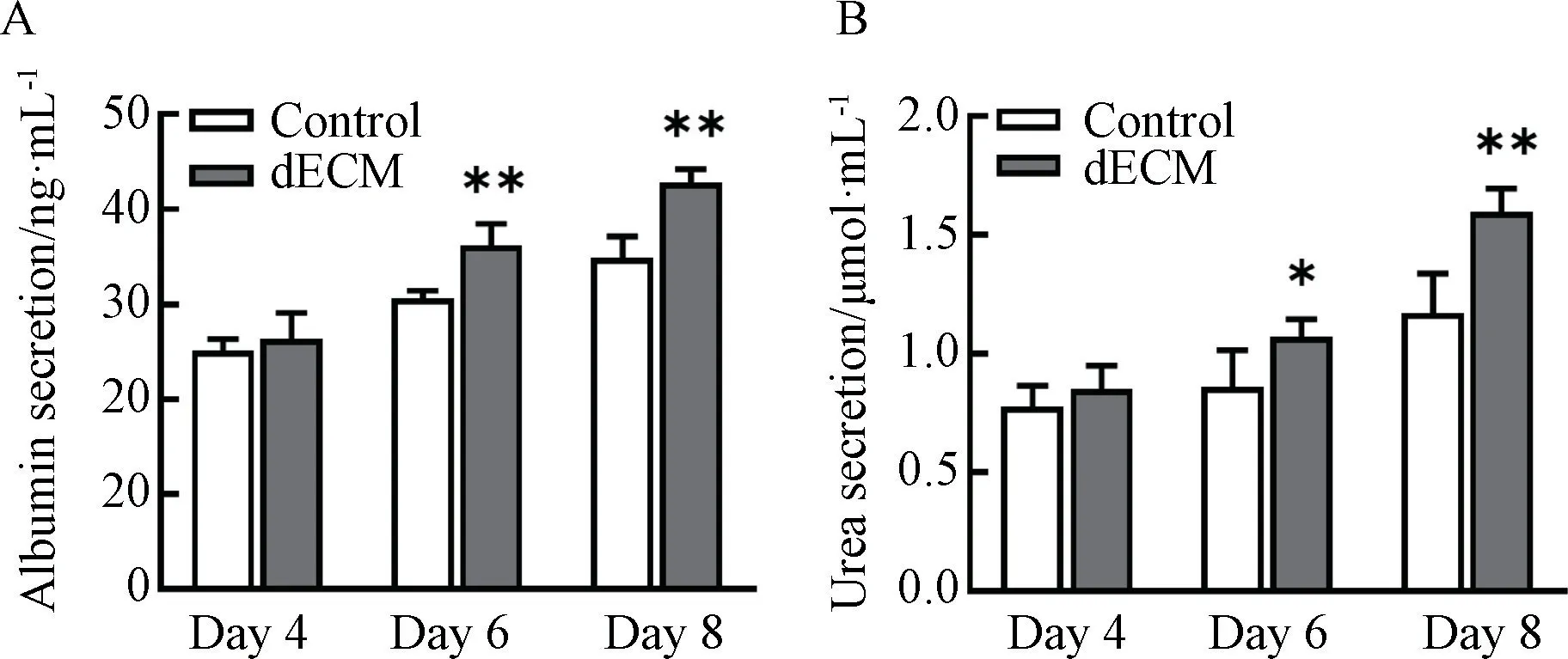
图4 HepG2 球状体分泌功能评估Fig.4 Evaluation of secretory function of HepG2 spheroid
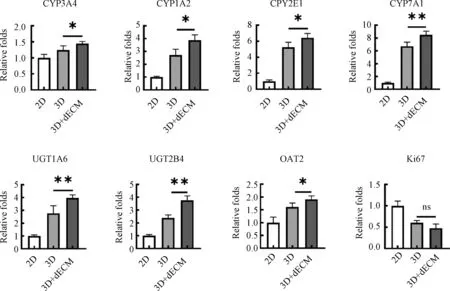
图5 HepG2 细胞球状体肝功能相关基因的表达Fig.5 Expression of liver function related genes in HepG2 Spheroids
3 讨论
HepG2 细胞系是被广泛应用于肝脏组织工程与肝功能相关研究领域的类肝细胞系,来源于一个15 岁的白人男性的肝癌组织,是人的肝癌细胞系,但具有一些肝脏实质细胞特有的功能。这些功能包括多种血浆蛋白的分泌,如白蛋白、转铁蛋白、维甲酸结合蛋白、β-脂蛋白、补体等,以及一定的物质代谢和解毒的能力[15]。由于上述特性和易于获取、可大量扩增、处理简单且寿命无限等特征,HepG2 细胞系成为生物人工肝支持系统(Bioartificial liver support system,BALSS)的常用细胞源,以及药物毒性筛查常用的肝实质细胞替代细胞系。虽然人原代肝细胞(Primary human hepatocytes,PHH)最接近体内肝实质细胞的状态,是药物与毒素的肝毒性检测最具有体外参考价值的“金标准”[16],但难于获取,性状在体外培养中难以维持且存在个体差异,因此无法广泛应用[17]。另外,由于PHH 不能扩增和大量获取,也限制了其成为BALSS 的细胞来源。因此,永生化的类肝细胞系成为在这些领域中替代PHH 的重要细胞来源。HepG2 细胞系是这类细胞系中的重要一员,相关的研究与应用较多。
HepG2 细胞系与PHH 相比,肝功能和代谢相关的基因表达和蛋白质水平都较低,成为限制其应用的最主要因素。其原因是,在传统的2D 培养中,HepG2 细胞呈二维平面状态生长,缺乏极性,表达低水平的细胞色素代谢酶、外源物质转运体和核受体,以及较低的蛋白分泌水平。而3D 形式的HepG2 细胞球状体形式培养,能显著提高HepG2 细胞的肝功能状态和水平[6]。同时,3D 球状体低增殖、高功能状态的特性,为高通量的药物肝损伤预测和提供BALSS 的细胞来源提供了便捷。另一原因是,体外细胞培养缺乏体内维持细胞功能状态的微环境和因子,而ECM 是这些因子和微环境的载体。天然ECM 中结合有多种酶、生长因子和其他生物活性分子,从而影响细胞功能[18]。Lee 等[12,19]的研究表明,用ECM 凝胶为HepG2 细胞提供生长环境时,能明显提高其功能状态,分泌更多的白蛋白和尿素氮,并促进细胞的体外存活。同时,ECM 中也存在很多细胞黏附位点,能通过增加细胞黏附,从而促进球状体的形成。因此,在ECM 环境中培养的HepG2球状体相比于二维培养的HepG2 细胞,理论上具有更好的肝细胞功能。
然而,利用单一的ECM 成分或个别成分的混合使用,很难完全模仿天然ECM 的特性。通过脱细胞方法获得的dECM 能较完整保留组织特异性的ECM 成分,因此具有天然ECM 的属性和功能,能够为细胞提供定植、存活和诱导功能分化等信号[20]。通过灌流脱细胞直接获得的肝脏dECM 具有完整的器官形态结构,但是并不便于直接应用。为便于使用和制作细胞生物支架,以往研究中常将dECM 用酶消化,以形成凝胶。但这些消化的过程会破坏dECM 中的成分,而影响dECM 的生物活性。利用液氮冷冻研磨法将dECM 制备成微颗粒,能够避免酶解消化过程,最大限度保留ECM 中的活性成分。同时,微颗粒形式的dECM 也便于后续的消毒处理、保存运输和化学修饰等;并且dECM 微颗粒也能直接应用于细胞的三维培养,能够促进3D 球状体的形成和提高细胞的功能状态。
本实验利用灌流脱细胞法获得的dECM 保留了天然ECM 中的多种成分,并且可研磨成不同直径的微颗粒。用不同离心速度分离微颗粒,可以获得直径在数百纳米到数微米不等的dECM 微颗粒。实验结果表明,将这些粒度较小的dECM 微颗粒应用于HepG2 细胞的3D 培养,可以促进HepG2 细胞形成更致密的球状体;加入dECM 微颗粒的HepG2 球状体组,细胞分泌白蛋白和尿素氮的水平增加;PCR结果也表明,加入dECM 微颗粒后,细胞的肝功能相关基因的表达水平也提升。因此,dECM 微颗粒能够通过促进HepG2 细胞球状体的形成和提供细胞外基质微环境,进一步提高HepG2 细胞的肝相关功能状态。
综上所述,dECM 以微颗粒的形式结合细胞的3D 培养,是提高HepG2 细胞肝相关功能状态的一种有效方法。该方法可以使HepG2 细胞在药物肝毒性筛查和生物人工肝装置等肝脏组织工程领域的应用中具有更好的功能状态,发挥更大的应用潜力。同时,也为其他永生化肝细胞系在肝脏组织工程领域中的应用提供了借鉴。

