新型甘油/明胶基水凝胶在创面修复中的应用效果研究
杜林 陆雯丽 刘庆芬 顾芬
如何修复皮肤缺损、减少瘢痕形成是临床亟待解决的问题。生物材料的进步与发展有望为解决该问题提供新思路及新策略。其中,明胶已被广泛地应用于多个领域[1-3]。明胶基凝胶允许水溶性添加剂,具有生物可降解性。但是,明胶基凝胶在空气中因快速干燥而导致硬化,影响其作为创面修复材料的稳定性和耐久性。研究证明,在明胶中加入食品级添加剂,如糖、甘油、柠檬酸等,不会损害材料的生物相容性和安全性,可产生具有弹性和韧性的凝胶组合物[4-5]。
我们以明胶为基底,加入可食用甘油,用以增强明胶的热稳定性及保水性,并利用柠檬酸使其交联,制备了新型甘油/明胶基水凝胶(GG 水凝胶),研究其生物相容性和修复皮肤缺损的效果,为进一步临床应用提供基础。
1 材料与方法
1.1 试验材料及仪器
高糖DMEM(Hyclone,美国);胎牛血清(FBS)、1%的青链霉素和胰蛋白酶-EDTA(Thermo Fisher Scientific,美国);明胶、柠檬酸和甘油(Merck,德国);CCK-8 试剂(Dojindo,日本);活死细胞染色试剂盒(上海翊圣生物科技有限公司)。
多功能酶标仪(Tecan Spark,瑞士),共聚焦显微镜(Leica,德国)。
1.2 方法
1.2.1 制备GG 水凝胶
将甘油(8 g)溶解在去离子水中(8 g)并加热至60 ℃。冷却至室温后,加入明胶粉末(4 g),浸泡1 h。混合物在70 ℃的烘箱中真空下搅拌1 h(2 350 r/min,45 kPa),并加入1%柠檬酸以获得均匀的成胶前液体。浇筑模具中,冷却即可得到凝胶。
1.2.2 细胞培养
人皮肤成纤维细胞(HSFs)来源于中国科学院生物化学与细胞生物学研究所。标准细胞培养环境下(37 ℃、5%CO2以及饱和湿度),使用含10% FBS和1%青链霉素的DMEM 培养,细胞达到80%融合后传代。
1.2.3 GG 水凝胶的生物相容性
用CCK-8 法和活/死细胞染色分别测定细胞活力和增殖能力。将1×104个HSFs 包裹在200μL凝胶中。在培养1 d、3 d 和7 d 时,将原培养基换成含有CCK-8 试剂的新鲜培养基,并于37 ℃下培养1.5 h。使用多功能酶标仪测量490 nm 处的光密度(OD)值。以活死细胞染色试剂盒在培养7 d 时进行检测,共聚焦显微镜观察并拍照。
1.2.4 GG 水凝胶修复皮肤缺损
18 只6 周龄SPF 级小鼠,雌雄不限,平均体质量20 g(上海斯莱克实验动物有限责任公司)。动物实验通过上海交通大学医学院附属第九人民医院实验动物伦理委员会批准。
小鼠麻醉后背部备皮,并在背部中间造成直径10 mm 的全层皮肤缺损。将小鼠随机分为3 组:对照组(n=6)、GG 水凝胶治疗组(n=6)和GG 水凝胶+细胞治疗组(n=6)。对照组为空白对照,不予任何处理;GG 水凝胶治疗组:将凝胶前体液200μL涂抹于皮肤缺损创面;GG 水凝胶+细胞治疗组:将凝胶前体液200μL 与1×104个HSFs 混合后涂抹于皮肤缺损创面。术后小鼠全部单笼饲养,自由进食和饮水。术后即刻和术后11 d 对创面行大体观察并拍照,使用Image J 软件(1.51 版)进行创面面积定量分析。
术后11 d 创面取材,4%多聚甲醛固定过夜,石蜡包埋切片,HE 染色[6-7]。
1.2.5 统计学分析
采用GraphPad Prism 8 进行统计学处理。组间比较采用单因素方差分析和Tukey 后分析法。P<0.05 表示差异具有统计学意义。
2 结果
2.1 GG 水凝胶的生物相容性
用CCK-8 法测定凝胶内部的HSFs 增殖情况。结果显示,术后7 d 时的OD 值明显高于术后1 d 和3 d 时(P<0.001),说明GG 水凝胶内部的HSFs 能够维持增殖。活死细胞染色实验表明,超过95%的HSFs 在水凝胶表面存活长达1 周。上述结果表明,HSFs 可以在GG 水凝胶内生长、增殖,维持其代谢活性,GG 水凝胶具有良好的生物相容性(图1、2)。

图2 活死染色法测定HSFs 在GG 水凝胶内部的存活情况(不同方向观测到的荧光图像)Fig.2 Viability of HSFs in GG hydrogel measured by living/dead staining(fluorescent images observed in different directions)
2.2 GG 水凝胶用于皮肤缺损修复
如图3 所示,小鼠全层皮肤缺损创面涂抹GG水凝胶前体液后,大体观察可见各组在整个实验过程中均未发现明显的感染及其他并发症。与对照组和GG 水凝胶治疗组相比,GG 水凝胶+细胞治疗组伤口愈合明显更快。定量分析显示,术后11 d 时,GG 水凝胶+细胞治疗组剩余的创面面积仅为最初面积的8.3%±1.0%,明显小于对照组的49.5%±0.9%(P<0.05)。
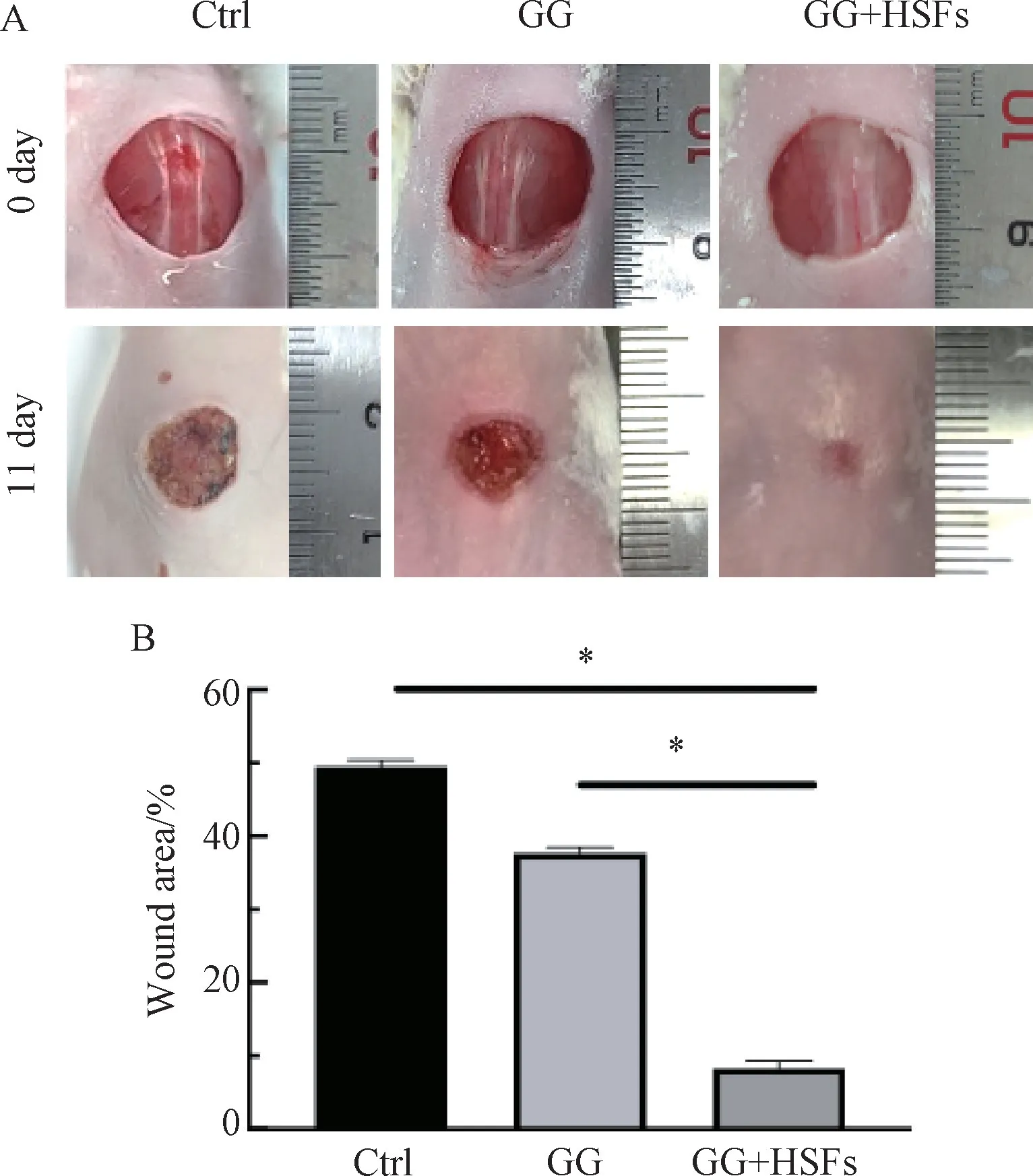
图3 术后创面大体观察及创面面积定量分析Fig.3 Gross observation and area quantitative analysis of the wound after operation
为了研究水凝胶的渗透作用和伤口完全闭合后的组织重塑情况,术后11 d 时对创面组织取材并行HE 染色观察。结果显示,对照组小鼠组织中含有少量的新生肉芽组织、新生毛细血管及胶原蛋白沉积,同时伴有大量的炎性细胞;GG 水凝胶治疗组中水凝胶发生了降解,创面新生肉芽组织明显形成;GG 水凝胶+细胞治疗组中表皮细胞分层明显,排列整齐,表皮和真皮连接紧密,可见毛细血管増生,血管周围无明显炎性细胞浸润,并且可观察到皮脂腺等皮肤附属器,且成纤维细胞排列有序,与周围组织相互交叉。上述证据表明,GG 水凝胶输送HSFs 并作为原位形成的皮肤替代物可用于治疗皮肤缺损创面(图4)。
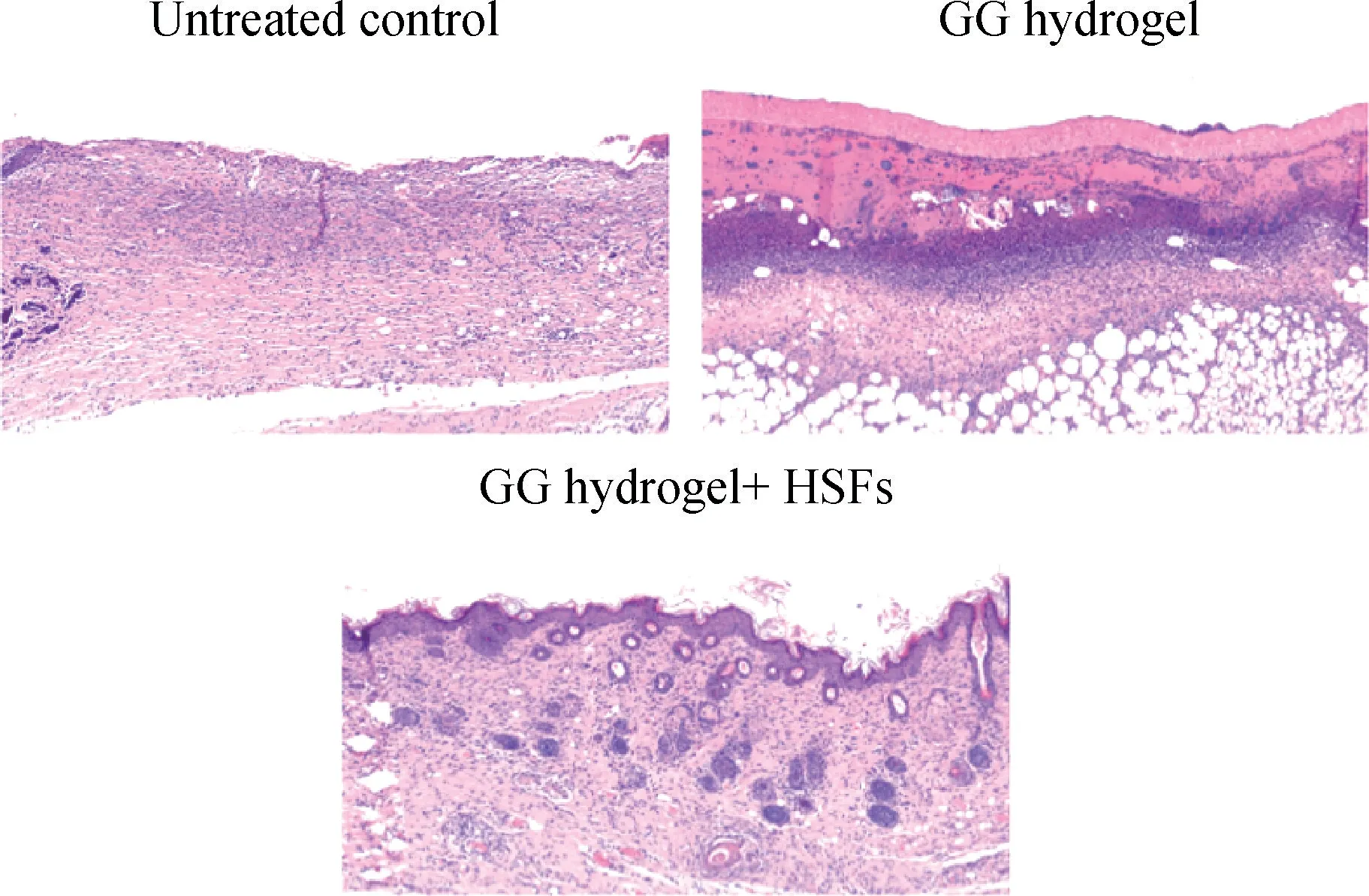
图4 HE 染色法测定各组小鼠全层皮肤缺损修复情况(10×)Fig.4 Repair of full-thickness skin defects in each group determined by HE staining(10×)
3 讨论
研究表明,细胞因子在创面愈合中具有重要作用[8],而且有效的细胞输送方法不仅可提高移植细胞的存活率,而且对保持其多能特性和功能状态至关重要。将细胞混入水凝胶中可以方便地输送细胞,且水凝胶可适应任意大小、形状的创面或空腔[9]。本研究中,天然明胶和甘油分子为水凝胶提供了细胞黏附基质。结果表明,HSFs可以很好地黏附和扩散在GG 水凝胶中,保持活力,持续增殖。体内试验我们利用小鼠全层皮肤缺损模型,检测GG 水凝胶包裹HSFs 用于治疗皮肤缺损的可能性。结果显示,含有HSFs 的水凝胶显著改善了创面的再上皮化,并促进了创面闭合。在创面愈合的早期阶段,GG 水凝胶有效地抑制了创面中炎性细胞的浸润。本研究中,水凝胶在体内大约11 d 后有明显分解,表明其降解速率是适当的,可引导宿主成纤维细胞浸润到损伤区域,促进颗粒组织形成,可防止过度收缩和纤维化。明胶是一种基质金属蛋白酶敏感的生物降解分子,来源于胶原蛋白。研究表明,明胶水凝胶的降解速度是可调的,通过优化水凝胶的降解速率,相信GG 水凝胶包裹细胞的治疗方法能更好地满足临床治疗的需要。
综上所述,本研究构建的甘油/明胶基水凝胶具有优异的稳定性及生物学性能,有望用于临床皮肤缺损修复。

