Foxc2 基因对MC3T3⁃E1 细胞成骨能力影响的实验研究
王敏娇 司家文 沈洪洲 游清玲 沈国芳
Foxc2 作为Fox 家族C 亚家族中的一员,在真核生物中十分保守。Forkhead 蛋白在调控胚胎发育、代谢、免疫、应激反应以及分化调控等方面均发挥了重要的作用[1]。Foxc2 初期在小鼠胚胎头部的神经嵴、中胚层来源的间充质细胞以及躯干部的非脊索中胚层中广泛表达,而后在颌面部局限表达[2]。在关键成骨基因过表达或敲除的小鼠中可观察到面部发育异常,同时Foxc2 的表达也有相应的变化[3-4]。本研究拟选取小鼠前成骨细胞系MC3T3⁃E1,通过慢病毒及siRNA 转染改变其Foxc2 表达,明确Foxc2 的功能,并通过基因芯片技术筛查差异表达基因,探索参与相关通路的Foxc2 下游靶基因。
1 材料与方法
1.1 主要材料、试剂和仪器
MC3T3⁃E1 细胞(亚克隆14,中国科学院细胞库),α-MEM 培养基(Gibico,美国),血清(Gibico,美国),胰酶(Gibico,美国),成骨诱导液(Cyagen,美国),甲状旁腺激素(Sigma,美国),辛伐他汀(Sigma,美国),慢病毒载体(上海和元生物),siRNA(上海拓然生物有限公司,中国),实时定量PCR 试剂盒(TaKaRa,日本),PCR 引物(上海生工生物科技有限公司),Foxc2 抗体(Abcam,美国),GAPDH/Runx2 抗体(CST,美国),碱性磷酸酶显色试剂盒(南京碧云天生物技术有限公司)。
荧光定量PCR 仪(ABI,美国),Odyssey 双色红外激光成像仪(LI-COR,美国),表达谱芯片(Agilent,美国)。
1.2 实验方法
1.2.1 MC3T3⁃E1 细胞的成骨诱导培养
以成骨诱导液、甲状旁腺激素(浓度10-8mmol/L)、辛伐他汀(浓度10-8mmol/L)诱导培养MC3T3⁃E1细胞。收集细胞样品,通过后续实验确认Foxc2 表达水平的变化。
1.2.2 慢病毒转染构建Foxc2 稳定过表达MC3T3⁃E1 细胞系
采用慢病毒plenti-Foxc2 及plenti-EGFP 转染MC3T3⁃E1 细胞构建MC3T3⁃E1Foxc2+(实验组)及MC3T3⁃E1EGFP(对照组)。以2×105个/cm2的密度将MC3T3⁃E1 细胞接种于6 孔板中,次日更换为含5 μg/mL Polybrene 的无血清培养基。加入慢病毒感染靶细胞,感染24 h 后换成含10%FBS 的无抗生素α-MEM 培养基。培养72 h 后通过嘌呤霉素筛选获得Foxc2 稳转细胞株。
1.2.3 siRNA 干扰Foxc2 表达
采用siRNA 干扰技术构建MC3T3⁃E1si-Foxc2(实验组)及MC3T3⁃E1si-NC(对照组)。选用Lipo2000 为转染介质,待6 孔板内的细胞达到80%左右,开始转染。准备两只EP 管,A 管加入250μL Opti-MEM 和10μL 20 μmol/L 的siRNA 储存液,B 管加入250μL Opti-MEM(无血清)和5μL lipo2000,然后混匀AB两管,室温孵育20 min,形成siRNA/lipo2000 混合液,将以上混合液加入含有细胞的1 500μL 培养基的培养孔中,来回轻柔摇晃细胞培养板。细胞在37 ℃、5%CO2培养箱温育48 h,进行转染后的其他检测步骤。
1.2.4 CCK-8 试剂盒检测
将处于对数生长期的细胞用胰酶消化,制成细胞悬液,接种至96 孔板,每孔控制细胞数1 000 个左右,每组设4 个复孔。37 ℃、5%CO2条件下孵育培养7 d。每孔加入10μL 的CCK-8 溶液,轻轻敲击培养板使其混匀,37 ℃下孵育2 h,分别测量450 nm处每孔的光密度(OD)值。根据OD 值绘制增殖曲线。
1.2.5 流式细胞仪检测
周期:消化并收集两组细胞沉淀,预冷的70%乙醇固定,4 ℃过夜;次日再次收集细胞沉淀,PBS漂洗,以除去乙醇;调整细胞密度至1×109个/L,每个EP 管内加入300μL PI/RNase 混匀,避光孵育15 min 后,上流式细胞仪FACStar 进行检测。
凋亡:细胞培养达到85%融合时,将上清培养液收集到离心管内,PBS 漂洗,收集细胞沉淀于上一步的离心管内;将细胞重悬于1×buffer 中,分别加入5μL Annexin Ⅴ-PE 和5μL 7-AAD 染剂,避光室温孵育15 min。移入流式管,1 h 内流式细胞仪检测细胞凋亡率。
1.2.6 基因mRNA 以及蛋白表达检测
实时定量PCR:收集细胞,无菌预冷PBS 清洗2次,Trizol 提取细胞总RNA,并反转录合成cDNA,进行实时荧光定量反应。反应体系:上下游引物各0.5μL,cDNA 模板1μL,ROX 0.5μL,SYBR 10μL,加入DEPC 水7.6μL 补足,共计20μL。每组样本设3 个复孔。反应结束后,根据已检测的Ct值即循环阈,采用ΔΔCt 法计算基因相对表达量变化(表1)。

表1 实时定量PCR 引物序列Table 1 Primer oligonucleotide sequences used for real-time PCR
Western blot:RIPA 裂解液充分裂解细胞并提取总蛋白,BAC 蛋白试剂盒测定蛋白浓度,取20 μg 进行SDS-PAGE,再转移至PVDF 膜上,用5%脱脂奶粉封闭1 h,一抗4 ℃孵育过夜。然后加入荧光二抗室温避光孵育1 h,放入Odyssey 双色红外激光成像仪,扫描显色。
1.2.7 ALP 染色
采用成骨诱导液培养细胞,方法同1.2.1。于第7 天收集细胞,4%多聚甲醛固定,PBS 漂洗,碱性磷酸酶孵育液孵育3~6 h,PBS 漂洗,待风干后观察染色情况。
1.2.8 茜素红染色
采用成骨诱导液培养21 d,4%多聚甲醛固定,PBS 漂洗,每孔加入新鲜过滤的茜素红孵育液500μL染色。扫描仪及光学显微镜观察茜素红染色情况。
1.2.9 高通量表达谱芯片及下游靶基因实时定量PCR 初步验证
对MC3T3⁃E1Foxc2+及MC3T3⁃E1EGFP细胞进行细胞基因芯片检测,主要步骤包括样品采集及总RNA提取、总RNA 的纯化和质量控制、cDNA 的合成、荧光标记cRNA 的合成纯化和浓度测定、cRNA 样品片段化和芯片杂交、芯片洗涤、芯片扫描、实验数据的处理分析。根据芯片数据分析结果选定潜在下游靶基因,并通过实时定量PCR 进行验证,操作同1.2.6。
1.3 统计学分析
采用SPSS 17.0 进行统计分析,组间比较采用t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 Foxc2 在MC3T3⁃E1 细胞成骨诱导后出现上调
在成骨诱导液、PTH、辛伐他汀的诱导后收集细胞样品进行检测,Foxc2 基因的表达水平在诱导初期即出现上调,而后缓慢回落至基线水平(图1)。

图1 实时定量PCR(A、C、E)和Western 印迹法(B、D、F)检测成骨刺激下的Foxc2 表达变化Fig.1 Real-time PCR analysis(A,C,E) and Western blot analysis(B,D,F) of Foxc2 expression after osteogenic stimulation
2.2 Foxc2 在MC3T3⁃E1 细胞株实现持续高表达
通过慢病毒转染,嘌呤霉素筛选培养MC3T3⁃E1Foxc2+细胞株及MC3T3⁃E1EGFP细胞株,共聚焦显微镜检测到FITC 绿色荧光。继续培养,收集细胞样品进行后续实验。实时定量PCR 检测结果显示,MC3T3⁃E1Foxc2+组Foxc2 mRNA 表达水平上调超过80 倍(P<0.05);Western blot 检测结果显示,MC3T3-E1Foxc2+组出现过表达目的条带。上述结果提示,慢病毒成功转染MC3T3⁃E1 细胞并有效表达(图2)。
2.3 Foxc2 过表达抑制细胞增殖
如图3 所示,两组细胞增殖活性初期无明显差异;第4 天时,MC3T3⁃E1Foxc2+细胞增殖活性降低,其在450 nm 处的OD 值小于MC3T3⁃E1EGFP细胞,而后差异逐渐增大,D4~D7 的差异具有统计学意义(P<0.05)。流式细胞仪分析显示两组细胞凋亡无明显差异。通过各周期细胞比例分析,MC3T3⁃E1Foxc2+组的G1 期细胞比例增加,S 期和G2/M 期的细胞比例降低,其中G1 期细胞比例变化差异显著(P<0.05)。

图3 慢病毒转染后两组MC3T3⁃E1 细胞增殖情况Fig.3 Proliferation of MC3T3⁃E1 cells after lentivirus transfection in the two groups
2.4 Foxc2 过表达促进MC3T3⁃E1 细胞成骨向分化
成骨诱导液培养7 d,实验组的Runx2 的mRNA 和蛋白表达水平均高于对照组,差异具有统计学意义(P<0.05)。诱导至第7 天时进行ALP 染 色,两组细胞均有着色,符合MC3 T3⁃E1 细胞的特性,对比发现过表达Foxc2 的实验组染色较深且着色细胞较多。第21 天时,茜素红染色实验,两组均成功观察到钙结节(图4)。
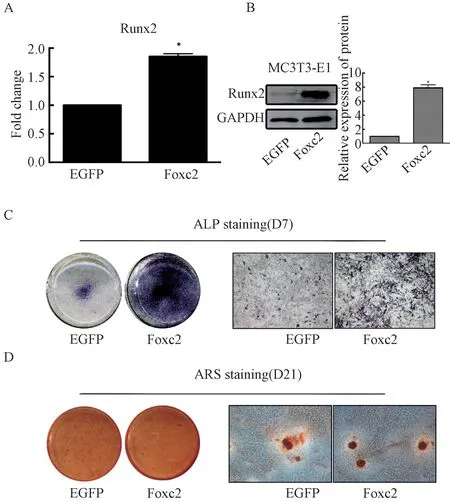
图4 慢病毒转染后两组MC3T3⁃E1 细胞成骨分化观察Fig.4 Osteogenesis of MC3T3⁃E1 cells after lentivirus transfection in the two groups
2.5 siRNA 干扰Foxc2 表达,反向验证基因功能
提取siRNA 干扰MC3T3⁃E1 的细胞样品,实验组的Foxc2 的mRNA 及蛋白表达均减低,提示Foxc2-siRNA 成功转染。Foxc2 的表达水平降低后,可以观察到细胞的增殖能力较对照组有所提高,Runx2 的蛋白表达水平均有所下降,且ALP 染色变浅(图5)。
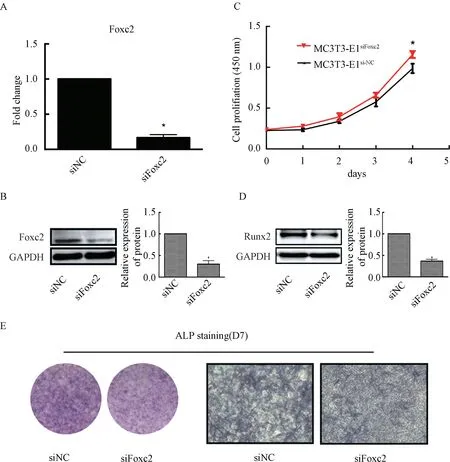
图5 Foxc2-siRNA 对MC3T3⁃E1 细胞的作用Fig.5 Effect of Foxc2-siRNA on MC3T3⁃E1 cells
2.6 基因芯片初步筛选下游靶基因并初步验证
MC3T3⁃E1Foxc2+细胞与MC3T3⁃E1EGFP组差异表达的基因有1 234 条,其中上调基因950 条,下调基因284 条。将差异表达的基因带入KEGG 数据库进行通路分析,显示有25%的差异基因参与了细胞因子间的受体相互作用。选取MMP9、MMP13、EREG基因作为研究目标,并通过实时定量PCR 成功验证芯片结果(图6、7)。
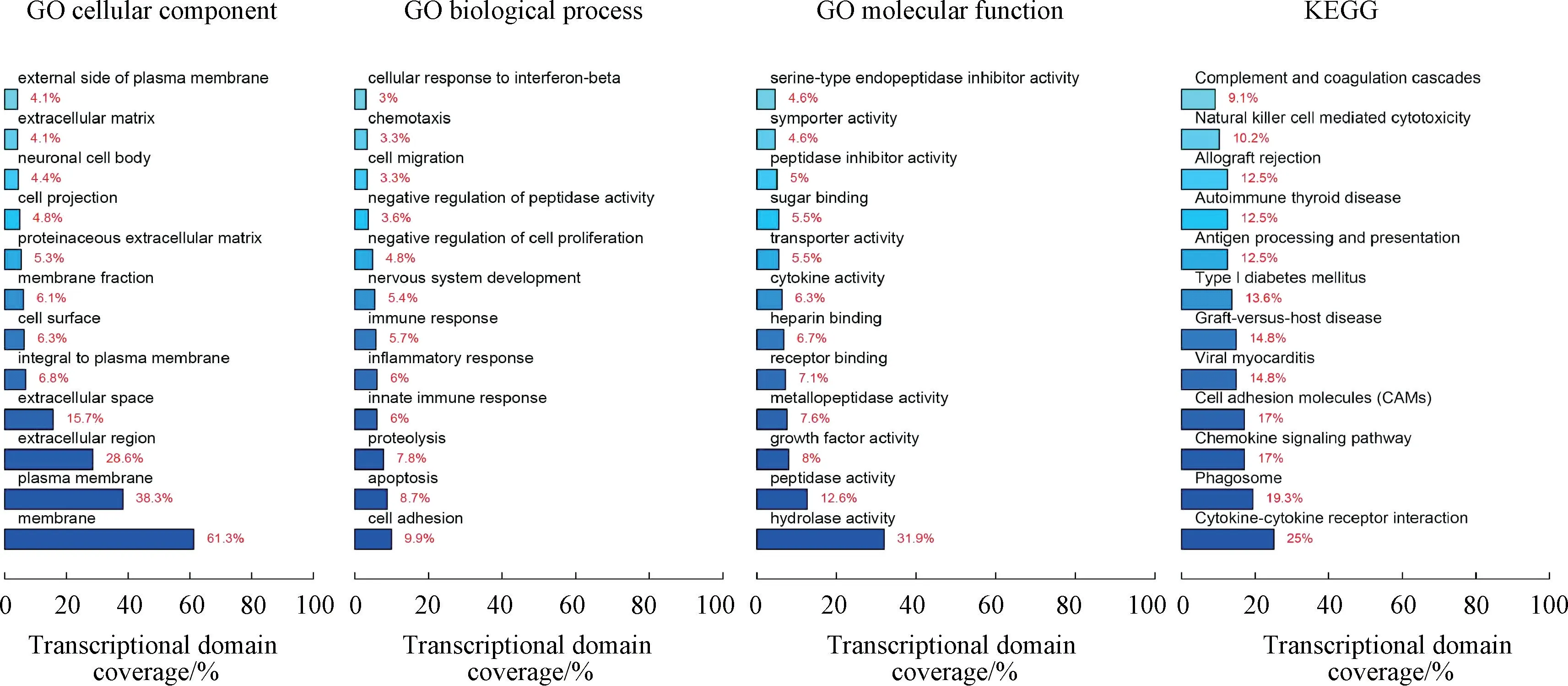
图6 GO 分析和KEGG 通路分析Fig.6 GO analysis and KEGG pathway analysis
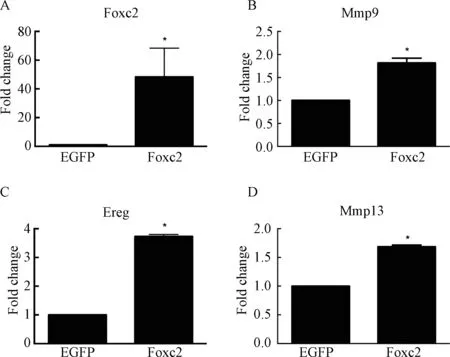
图7 实时定量PCR 验证芯片结果Fig.7 Real-time PCR verification of gene chip results
3 讨论
Foxc2 蛋白在人和小鼠两种种属间呈高度保守状态,参与了机体的众多生理过程。如果使用非特异基因敲除方法获得Foxc2 基因敲除小鼠,大多数的Foxc2-/-小鼠胚胎会在出生前死亡,少数可以出生,但存在明显发育缺陷,如主动脉弓离断、颅颌面骨缺损等,在口腔颌面部主要表现为正中腭裂、软腭缺失、上颌骨和蝶骨大翼发育不全及位置转移等[2,5]。淋巴水肿-重睫综合征(Lymphedema-distichiasis syndrome,LDS)是一种常染色体显性遗传病,人Foxc2 基因突变是导致LDS 的重要原因,LDS 常同时伴发椎骨畸形、硬膜外囊肿、上睑下垂、腭裂等症状,提示Foxc2 基因与人颅颌面发育密切相关[6-7]。Foxc2 同样影响人体脂代谢与骨改建,Yamada 等[8]于2006 年针对日本老年人群的研究指出,绝经后女性的桡骨远端以及整个机体的骨密度水平与Foxc2 的基因多态性明显相关。动物实验的结果同样验证了Foxc2 的功能:在小鼠肥胖-骨形成异常模型中可以发现Foxc2 表达水平在病变小鼠的白色脂肪组织内出现下调,同时病变小鼠的骨形成出现障碍[9]。上述研究均提示Foxc2 参与了颅颌面软硬组织发育过程及机体骨形成过程。
近些年关于Foxc2 功能的多项体外研究显示,在多种成骨诱导因子培养下,多种具有分化潜能的前体细胞内的Foxc2 表达水平显著升高[10-14]。本课题组前期研究表明,成骨诱导后的羊水干细胞中可检测到Foxc2 的高表达,初步证实了Foxc2 基因的过表达可抑制C3H10T1/2 细胞增殖;上调成骨相关基因Runx2 的表达,可促进细胞成骨向分化并抑制脂向分化[15]。但是,关于Foxc2 在成骨分化过程中的作用仍需继续研究。
Kim 等[16]指出,Foxc2 维持β-catenin 的活性,刺激TCF/LEF 转录活性,激活经典的Wnt-βcatenin 通路,同时cAMP-PKA 途径也参与其中。Gozo 等[17]提出,持续高表达的Foxc2 将促进前成肌细胞C2C12 成骨向分化的趋势,其主要机制在于Foxc2 直接作用于Wnt4 启动子区域,可激活Wnt4和BMP4 信号通路,从而抑制细胞成肌分化并转为骨向分化。Hsu 等[18]通过CRISPR 技术激活BMSC的内源性Wnt10b 及Foxc2 的共表达,可促进其骨向分化。Park 等[19]提出,Foxc2 的表达水平在骨代谢因子(甲状旁腺激素/BMP2)的刺激下出现上调,并且存在剂量表达相关效应。过表达Foxc2 可以刺激整合素β1 的表达,整合素β1 直接结合到Forkhead结构域的启动子上,从而调节细胞分化。
本研究中,首先采用多种成骨诱导因子作用于MC3T3⁃E1 细胞[20],观测到Foxc2 的表达水平在细胞成骨分化过程中出现上调,而后逐步回落。成骨刺激作用较强的因子,如PTH,更易使Foxc2 在刺激的早期即出现上调。后续体外研究,通过设计慢病毒及siRNA 改变Foxc2 在MC3T3⁃E1 细胞中的表达水平,从而检测Foxc2 对细胞增殖活性、凋亡、周期以及分化能力的影响。稳转细胞系中,Foxc2 抑制MC3T3⁃E1 细胞的增殖活性,增加了G1 期细胞比例。G1 期细胞主要是增加质量且为后续的DNA 复制做好准备,Foxc 过表达使得细胞阻滞在G1 期,无法进行后续S 期及G2 期的DNA 复制加倍,导致细胞增殖活性降低。在分化能力的观察中,首先成骨关键转录因子Runx2 的表达水平在MC3T3⁃E1Foxc2+组出现明显上调,第7 天进行碱性磷酸酶染色,MC3T3⁃E1Foxc2+组ALP 染色较深,光学显微镜下着色细胞较多。第21 天,茜素红染色实验中,两组均成功观察到钙结节,此时两组无明显差异。siRNA 干扰实验结果同样验证了Foxc2 对MC3T3⁃E1 细胞体外骨向分化的影响。第一部分实验中,我们观测到Foxc2 的上调都出现在骨向诱导的早期,而后表达下调,逐渐回落甚至低于基线水平,提示Foxc2 在细胞成骨分化过程中仍受到其他负性因子的调控,故在培养第21 天,即成骨后期的茜素红染色钙结节实验中,两组细胞无明显差异。收集成骨诱导培养3天的MC3T3⁃E1Foxc2+细胞及MC3T3⁃E1EGFP细胞样品,通过基因芯片进一步分析筛选下游靶基因,结果两组差异表达的基因共计1 234 条,其中上调950 条基因,下调基因284 条。将差异表达的基因导入数据库进行GO 分析和KEGG 通路分析,25%的差异基因参与了细胞因子间的受体相互作用,17%的差异基因参与了趋化因子信号通路,同样有17%的差异基因参与了细胞黏附分子通路(CAMs)。查阅文献,结合芯片结果,初步选取数个差异基因,如MMP家族、EREG 等。MMP 家族已经被证实在骨骼的发育中起着重要作用[21],主要参与软骨细胞的增殖分化、成骨细胞及破骨细胞的募集、骨形成与改建等进程,MMP 功能的转变同样会影响骨质的形成。研究表明,EREG 可以与ERER 受体结合形成二聚体,通过激活AKT- mTOR 通路及MAPK 通路促进MC3T3⁃E1 细胞骨向分化[22]。关于MMP9、MMP13及EREG 基因的实时定量PCR 结果也初步验证了基因芯片结果,为后续的研究提供了方向。
综上所述,本研究探讨了Foxc2 基因对MC3T3-E1 细胞体外骨向分化的影响,初步证明Foxc2 基因负向调控MC3T3⁃E1 细胞增殖活性,同时正向促进Runx2 表达并促进细胞体外骨向分化。本课题利用基因芯片进行筛选,查阅文献并结合数据分析,通过实时定量PCR 初步验证了数个差异基因,如Mmp9、Ereg 等,后续研究将在此基础上继续展开,明确其下游机制。

