TNFRSF4基因在头颈鳞癌中的表达及预后价值研究
陈寻 李海同 骆云珍 李群 陈晓红


[關键词] 头颈鳞癌;TNFRSF4;分子标志物;诊断;预后
[中图分类号] R739.9 [文献标识码] A [文章编号] 1673-9701(2021)15-0001-04
The expression and prognostic value of TNFRSF4 gene in head and neck squamous cell carcinoma
CHEN Xun1 LI Haitong1 LUO Yunzhen1 LI Qun2 CHEN Xiaohong1
1.Department of Otorhinolaryngology Head and Neck Surgery, Jiaxing Second Hospital in Zhejiang Province, Jiaxing 314000, China; 2.Department of Otorhinolaryngology Head and Neck Surgery, Ningbo Medical Center Lihuili Hospital, Ningbo 315000, China
[Abstract] Objective To study the correlation between TNF receptor super-family member 4 (TNFRSF4, also known as OX40 gene) and the clinical characteristics of patients with head and neck squamous cell carcinoma and its prognostic value. Methods The public database The Cancer Genome Atlas (TCGA, https://portal.gdc.cancer.gov/) was used to obtain the expression level of TNFRSF4 in 502 patients with head and neck squamous cell carcinoma, and the prognostic value of the expression level was analyzed. Results This study confirmed that the expression level of TNFRSF4 in head and neck squamous cell carcinoma tissues was significantly higher than that in adjacent tissues, and that the expression of TNFRSF4 was closely related to the lymph node metastasis and T stage of patients with head and neck squamous cell carcinoma, suggesting that TNFRSF4 was involved in the progression of head and neck squamous cell carcinoma. Cox regression model analysis confirmed that the expression of TNFRSF4 could be an independent clinical indicator for prognostic evaluation of head and neck squamous cell carcinoma. The ROC curve showed that the area under the curve (AUC) of TNFRSF4 in the diagnosis of head and neck squamous cell carcinoma was 0.897, and the sensitivity and specificity were 84.1% and 85.0%, respectively. The methylation level of TNFRSF4 promoter region was an important factor affecting its expression level. Conclusion TNFRSF4 gene plays an important role in the occurrence and development of head and neck squamous cell carcinoma. Detection of TNFRSF4 gene may be used as a potential diagnostic marker for head and neck squamous cell carcinoma and is a clinical indicator for judging the good prognosis of head and neck squamous cell carcinoma.
[Key words] Head and neck squamous cell carcinoma; TNFRSF4; Molecular markers; Diagnosis; Prognosis
鳞癌是头颈肿瘤恶性肿瘤中最常见的病理类型[1]。头颈部鳞癌根据肿瘤的位置可以分为口腔、口咽、喉和下咽部鳞状细胞癌。由于头颈鳞癌早期临床症状不典型,大部分患者发现时已发生淋巴结转移成为晚期患者。晚期患者的治疗手段有限,缺乏有效靶向治疗,是远期生存率较低的主要原因[2]。TNFRSF4属于肿瘤坏死因子受体(TNF receptor super-family member 4,TNFRSF4)家族主要成员,是免疫共刺激通路的免疫检查点。TNFRSF4主要在活化CD4+和CD8+细胞中诱导性表达[3]。TNFRSF4与配体结合后能够促进T细胞克隆性增殖,增强T细胞记忆、增殖、免疫监视和杀伤细胞,阻止免疫耐受的形成[4]。此外,TNFRSF4表达阳性T细胞能够降低肿瘤免疫微环境中抑制因素,并且能够有效抑制肿瘤侵袭和转移的功能[5]。有研究发现在结直肠癌中TNFRSF4表达阳性淋巴细胞水平越高,患者总体生存时间越长[6]。但是TNFRSF4参与头颈鳞癌发生发展的机制尚未阐明。因此,本文分析TNFRSF4表达在头颈鳞癌中的表达及预后价值,现报道如下。
1 资料与方法
1.1 数据来源
公共数据库The Cancer Genome Atlas(TCGA,https://portal.gdc.cancer.gov/)是美国国家癌症研究所和美国人类基因组研究所共同监督的一个项目,应用高通量的基因组分析技术帮助人们对癌症有更好的认识,提高癌症的预防、诊断和治疗能力。本文通过TCGA数据库下载502例头颈鳞癌和20例癌旁组织TNFRSF4表达数据、基因甲基化水平及临床病理信息(包括性别、年龄、生存数据、临床分期、饮酒史和吸烟史)。头颈鳞癌患者包括男368例,女134例;平均年龄(61.07±11.89)岁;Ⅰ、Ⅱ期114例,Ⅲ、Ⅳ期374例,14例信息不确切;淋巴结转移阳性241例,淋巴结转移阴性242例,19例信息不确切;远处转移5例,无远处转移483例,14例信息不确切。
1.2 方法
1.2.1 头颈鳞癌TNFRSF4表达与甲基化的相关性 为进一步了解TNFRSF4基因中cg位点分布情况,本文首先通过UCSC Genome Browser(https://genome.ucsc.edu/)共获取TNFRSF4基因的9个cg位点基因位置(cg09586191,cg23166857,cg23394673,cg14661234,cg22335801,cg12759096,cg01437515,cg20544186和cg09503311)得知,cg09586191和cg23166857位于TNFSF4的啟动子区域内。通过TCGA下载头颈鳞癌中TNFRSF4基因cg位点甲基化水平的数据。此后利用R软件中Corrplot包分析头颈鳞癌中TNFRSF4甲基化与表达之间的相关性。
1.2.2 头颈鳞癌中TNFRSF4的生存分析 首先应用单因素Cox回归模型计算头颈鳞癌患者的临床病理特征(性别、年龄、TNM分期、饮酒史、吸烟史和TNFRSF4表达水平)与整体生存相关性;应用多变量Cox回归分析校准相关临床病理因素的影响,进一步判断TNFRSF4表达水平的预后价值。
1.3 统计学方法
应用SPSS 18.0统计学软件采用独立样本t检验分析头颈鳞癌组织与癌旁组织TNFRSF4表达差异和患者临床病理特征与TNFRSF4表达相关性;采用单因素及多因素Cox回归模型分析TNFRSF4表达与头颈鳞癌生存相关性。应用R软件中Corrplot包分析绘制TNFRSF4各甲基化位点与TNFRSF4表达水平的相关性。
2 结果
2.1 TCGA数据集中头颈鳞癌和癌旁组织中的TNFRSF4表达水平比较
从TCGA数据库中下载TNFRSF4表达数据,比较头颈鳞癌与癌旁组织TNFRSF4表达差异,结果显示头颈鳞癌中TNFRSF4表达水平明显高于癌旁组织[(7.64±1.21) vs. (5.71±0.95),t=-6.98,P<0.001]。
2.2 TNFRSF4表达水平与头颈鳞癌临床病理特征的关系
结合公共数据库中头颈鳞癌患者的临床病理特征,我们分析TNFRSF4表达水平与头颈鳞癌临床信息的相关性。由表1可见,TNFRSF4表达水平与患者的淋巴结转移状态及T分期相关(P<0.05)。而与患者的年龄、性别、吸烟史、饮酒史、M分期、肿瘤部位等临床因素无相关性(P>0.05)。
2.3 单因素Cox回归模型分析TNFRSF4表达在头颈鳞癌预后价值
结合头颈鳞癌生存数据,我们应用单因素Cox回归模型分析临床病理因素(饮酒史、吸烟史、TNM分期、性别、年龄和TNFRSF4表达水平)与总生存的相关性。由表2可知,年龄、远处转移(M分期)是头颈鳞癌不良预后因素,而性别(男性)及TNFRSF4高表达水平是头颈鳞癌预后的保护因素。
2.4 多因素Cox回归模型分析TNFRSF4表达在头颈鳞癌预后价值
通过多因素Cox回归模型分析校准年龄、M分期及性别等因素对头颈鳞癌预后影响,结果发现TNFRSF4表达及M分期成为头颈鳞癌患者预后的独立影响因素。见表3。
2.5 TNFRSF4甲基化水平是影响其表达水平的主要原因
肿瘤细胞中甲基化水平能够显著影响基因的表达水平,从而参与肿瘤的发生发展。本研究首先通过UCSC Genome Browser(https://genome.ucsc.edu/)了解TNFRSF基因的cg位点分布情况。随后获取TNFRSF4的甲基化数据,并通过Pearson方法分析TNFRSF4表达水平与甲基化水平相关性。由封三图1可知,TNFRSF4的2个位于启动子区域的cg位点的甲基化水平与TNFRSF4的表达水平呈明显负相关。
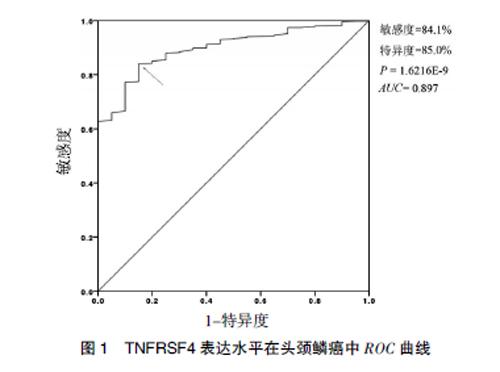
2.6 TNFRSF4表达检测对头颈鳞癌的诊断价值
通过绘制受试者曲线评估TNFRSF4表达检测在头颈鳞癌诊断的应用价值。结果显示,检测TNFRSF4表达水平的曲线下面积为0.897,在约登指数(敏感度+特异度-1)最大时,敏感度和特异度分别是84.1%和85.0%,提示TNFRSF4可成为辅助诊断头颈鳞癌的分子标志物。见图1。
3 讨论
近年来,头颈鳞癌患者的死亡率居高不下,严重威胁人类的健康[7]。深入研究肿瘤发生发展的作用机制是提高喉癌生存率的关键因素。头颈鳞癌的发生与吸烟、饮酒、人乳头瘤病毒(Human papilloma virus,HPV)等多种致病危险因素相关[8],其共性均能导致机体出现免疫缺陷[9]。大量研究证实,外周T细胞免疫耐受是自身免疫性疾病(包括肿瘤)发生的主要分子机制[10]。免疫耐受发生是由于抗原特异度T细胞功能抑制。研究发现,肿瘤微环境中存在大量功能受损的免疫细胞,也同时存在由肿瘤细胞分泌的免疫抑制细胞因子。这些因子能够产生局部和全身免疫抑制作用,从而使肿瘤细胞发生免疫逃逸[11-12]。相较于抑制免疫耐受研究进展,目前关于逆转已建立的免疫耐受研究成果甚少。
TNFRSF4(又称OX40)和其配体结合后能够促进T细胞的克隆增生和记忆T细胞的产生和维持[13-15],增强低反应性T细胞活性[3],阻止免疫耐受的形成和打破已经建立的免疫耐受[16]。有文献讨论乳腺癌、黑色素瘤、淋巴瘤中TNFRSF4表达分布情况[17-18],在结直肠癌中发现TNFRSF4高表达患者生存时间明显延长[6],并且靶向TNFRSF4治疗能显著发挥抗乳腺癌、黑色素瘤等作用[19]。尽管在皮肤鳞状细胞癌中活化T细胞的数量非常多,皮肤鳞状细胞癌仍趋于持续生长及发生远处转移。为明确这一现象的分子机制,研究者分离皮肤鳞状细胞癌患者的外周血淋巴细胞,分析发现调节T细胞(Regulatory T cells,Tregs)的水平远远高于效应T细胞(CD4+和CD8+T细胞),并且TNFRSF4阳性主要存在肿瘤Tregs上,而通过靶向激活肿瘤Tregs上TNFRSF4能抑制Tregs的免疫抑制效应,增加肿瘤CD4+T细胞增殖发挥抗肿瘤效应[20]。此外作者亦发现发生远处转移的皮肤鳞癌患者中TNFRSF4阳性的肿瘤Tregs相较于未发生远处转移的更丰富,提示TNFRSF4靶向激动剂更适用于发生远处转移的皮肤鳞癌患者[20]。而在头颈鳞癌中上述现象是否同样存在。本项研究将探讨TNFRSF4表达与头颈鳞癌各临床因素相关性,初步探索TNFRSF4表达在头颈鳞癌的临床应用价值。
本研究发现,头颈鳞癌中TNFRSF4表達水平显著高于癌旁组织中,并且在发生淋巴结转移头颈鳞癌患者中TNFRSF4表达水平明显高于未发生淋巴结转移的患者,这似乎暗示对于发生淋巴结转移的头颈鳞癌,应用TNFRSF4靶向激动剂能更大程度增加肿瘤CD4+T细胞增殖发挥抗肿瘤效应,但这一现象需要更进一步细胞实验及体内实验验证。结合单因素和多因素Cox比例风险模型结果,提示TNFRSF4是头颈鳞癌良预后的分子标志物。由上述实验结果,笔者猜想通过靶向激活剂提高肿瘤患者体内TNFRSF4表达水平,从而一定程度阻止免疫耐受的形成和打破已经建立的免疫耐受进而发挥抗肿瘤效应。此外,本研究结果发现启动子甲基化水平是影响TNFRFSF4表达水平的重要因素。通过抑制头颈鳞癌患者基因组DNA甲基化水平提高肿瘤患者机体TNFRFSF4表达水平或许能激活机体免疫监管作用,逆转免疫耐受。
综上所述,本研究证实了头颈鳞癌中TNFRSF4表达水平显著增高,能成为头颈鳞癌患者预后评估的独立危险因素,具有成为头颈鳞癌靶向治疗的潜在临床研究价值。
[参考文献]
[1] Pan R,Zhu M,Yu C,et al.Cancer incidence and mortality:A cohort study in China,2008-2013[J].Int J Cancer,2017,141(7):1315-1323.
[2] Coca-Pelaz A,Takes RP,Hutcheson K,et al.Head and neck cancer:A review of the impact of treatment delay on outcome[J].Adv Ther,2018,35(2):153-160.
[3] Aspeslagh S,Postel-Vinay S,Rusakiewicz S,et al.Rationale for anti-OX40 cancer immunotherapy[J].Eur J Cancer,2016,52:50-66.
[4] Buchan SL,Rogel A,Al-Shamkhani A.The immunobiology of CD27 and OX40 and their potential as targets for cancer immunotherapy[J].Blood,2018,131(1):39-48.
[5] Bell RB,Leidner RS,Crittenden MR,et al.OX40 signaling in head and neck squamous cell carcinoma:Overcoming immunosuppression in the tumor microenvironment[J].Oral Oncol,2016,52:1-10.
[6] Petty JK,He K,Corless CL,et al.Survival in human colorectal cancer correlates with expression of the T-cell costimulatory molecule OX-40(CD134)[J].Am J Surg,2002, 183(5):512-518.
[7] Jou A,Hess J.Epidemiology and molecular biology of head and neck cancer[J].Oncol Res Treat,2017,40(6):328-332.
[8] Ferlay J,Soerjomataram I,Dikshit R,et al.Cancer incidence and mortality worldwide:Sources,methods and major patterns in GLOBOCAN 2012[J].Int J Cancer,2015, 136(5):E359-386.
[9] Ferris RL.Immunology and immunotherapy of head and neck cancer[J].J Clin Oncol, 2015,33(29):3293-3304.
[10] Vinay DS,Ryan EP,Pawelec G,et al.Immune evasion in cancer:Mechanistic basis and therapeutic strategies[J]. Semin Cancer Biol,2015,35(Suppl):S185-S198.
[11] Czystowska M,Gooding W,Szczepanski MJ,et al.The immune signature of CD8(+) CCR7(+) T cells in the peripheral circulation associates with disease recurrence in patients with HNSCC[J].Clin Cancer Res,2013,19(4):889-899.
[12] Willoughby J,Griffiths J,Tews I,et al.OX40:Structure and function-What questions remain?[J].Mol Immunol,2017,83:13-22.
[13] Bansal-Pakala P,Halteman BS,Cheng MH,et al.Costimulation of CD8 T cell responses by OX40[J].J Immunol,2004,172(8):4821-4825.
[14] Polesso F,Sarker M,Weinberg ADet al.OX40 agonist tumor immunotherapy does not impact regulatory T cell suppressive function[J].J Immunol,2019,203(7):2011-2019.
[15] Nuebling T,Schumacher CE,Hofmann M,et al.The immune checkpoint modulator OX40 and its ligand OX40L in NK-Cell immunosurveillance and acute myeloid leukemia[J].Cancer Immunol Res,2018,6(2):209-221.
[16] Bansal-Pakala P,Jember AG,Croft M.Signaling through OX40 (CD134) breaks peripheral T-cell tolerance[J].Nat Med,2001,7(8):907-912.
[17] Marabelle A,Kohrt H,Sagiv-Barfi I,et al.Depleting tumor-specific Tregs at a single site eradicates disseminated tumors[J].J Clin Invest,2013,123(6):2447-2463.
[18] Xie F,Wang Q,Chen Y,et al.Costimulatory molecule OX40/OX40L expression in ductal carcinoma in situ and invasive ductal carcinoma of breast:An immunohistochemistry-based pilot study[J].Pathol Res Pract,2010, 206(11):735-739.
[19] Weinberg AD,Rivera MM,Prell R,et al.Engagement of the OX-40 receptor in vivo enhances antitumor immunity[J].J Immunol,2000,164(4):2160-2169.
[20] Lai C,August S,Albibas A,et al.OX40+ regulatory T cells in cutaneous squamous cell carcinoma suppress effector T-cell responses and associate with metastatic potential[J].Clin Cancer Res,2016,22(16):4236-4248.
(收稿日期:2020-09-01)

