回顾性分析74例大咯血患者行支气管动脉栓塞术的安全性和有效性
刘 松 王 猛 乔元岗* 邱忠华 张伟伟 焦桂花
咯血是临床常见的病症之一,是指喉以下呼吸道任何部位的出血经口腔排出[1]。咯血的原因常为支气管扩张、肺癌、肺结核等,传统内科治疗效果差,容易复发,尤其是大咯血(通常规定24h内咯血>500ml,或1次>100ml),因其造成窒息、失血性休克等,往往会危及患者生命。经过大量的实践证明,支气管动脉栓塞术(bronchial artery embolization,BAE)作为一种微创治疗技术,已成为控制大咯血很重要的手段[2]。本研究通过回顾性分析经BAE治疗74例大咯血患者的临床资料,探讨该技术的安全性和有效性。
1.资料与方法
1.1 一般资料 2017年1月至2018年12月我科收治的74例大咯血患者,所有患者资料完整,均行BAE治疗。其中男性49例,女性25例,年龄26~76岁,平均年龄(57.51±13.56)岁。病因分布如下:肺结核7例(9.46%),支气管扩张50例(67.57%),肺癌5例(6.76%),支气管动脉畸形2例(2.70%),肺部感染10例(13.51%)。
1.2 纳入标准 急性大咯血危及生命;反复大咯血内科治疗无效者;肺部基础条件差,不能耐手术手术切除;无介入治疗禁忌。排除标准:不接受BAE治疗;合并凝血功能障碍;局麻药或造影剂过敏;心肺、肝肾功能严重损害或衰竭者;支气管动脉与脊髓动脉有交通而治疗时导管不能避开脊髓动脉。
1.3 术前准备
1.3.1 检查及治疗准备:术前所有患者完善三大常规、心电图、肝肾功等检查,排除手术禁忌证;完善支气管动脉CTA了解病变血管情况;停用缩血管药物。
1.3.2 知情同意:术前应充分告知患者及其家属与BAE相关的医疗风险及获益,并要求其签署知情同意书。
1.3.3 器材准备:手术器材选用飞利浦FD20医用DSA数字减影机;5F导管鞘(日本Terumo公司)、0.035英寸超滑导丝(埃普特);5F猪尾导管、Cobra导管、Simmon-1导管、猎人头导管、胃左动脉导管(美国Cook公司)、Stride微导管(日本Asahi公司);弹簧钢圈(美国Cook公司)、聚乙烯醇(polyvinylalcohol,PVA)颗粒栓塞剂、明胶海绵颗粒栓塞剂。造影剂为碘海醇30g(辰欣药业股份有限公司)
1.4 手术方法 患者取平卧位,采用改良Seldinger技术穿刺股动脉,置入5F动脉导管鞘,导丝引导下将5F猪尾导管选送至主动脉弓、胸主动脉处,结合支气管动脉CTA,造影观察支气管动脉及非支气管性体动脉等责任血管位置及形态,根据血管走形更换cobra、胃左导管或西蒙导管等,寻找支气管动脉开口,进入支气管动脉后行动脉造影术。造影完成后,将微导管引入其中,明确支气管出血动脉后将导管前端置于出血动脉内,根据造影表现采取PVA颗粒栓塞剂、明胶海绵栓塞剂、弹簧圈联合栓塞的“三明治”术式。栓塞前确认靶血管未参与脊髓动脉供血,栓塞直至动脉栓塞出血动脉呈“残根样”,远端血管染色消失。术毕拔管,加压固定穿刺点。穿刺侧肢体制动8h,24h拆除绷带后可下床活动。
1.5 疗效判定标准及随访 ①治愈:术后24h内止血,连续6月无复发;②显效:咯血次数减少,咯血量明显减少,仅痰中带血;③有效:咯血次数降低,咯血量较治疗前减少50%以上;④无效:未达到上述标准。治疗总有效率=(治愈+显效+有效)/总例数×100%[3]。经住院、门诊或电话随访患者1月、6月及12月的咯血复发情况。
2.结果
2.1 血管造影表现 出血动脉造影表现为血管扭曲,迂曲增粗,造影剂外渗。4例患者合并支气管动脉-肺动脉瘘,2例患者合并支气管动脉-肺静脉瘘。肺部肿瘤血管造影表现为肿瘤供血动脉走行迂曲,分支血管增多,病灶区呈丛状分布,动脉中晚期见肿瘤染色。见图1、图2。
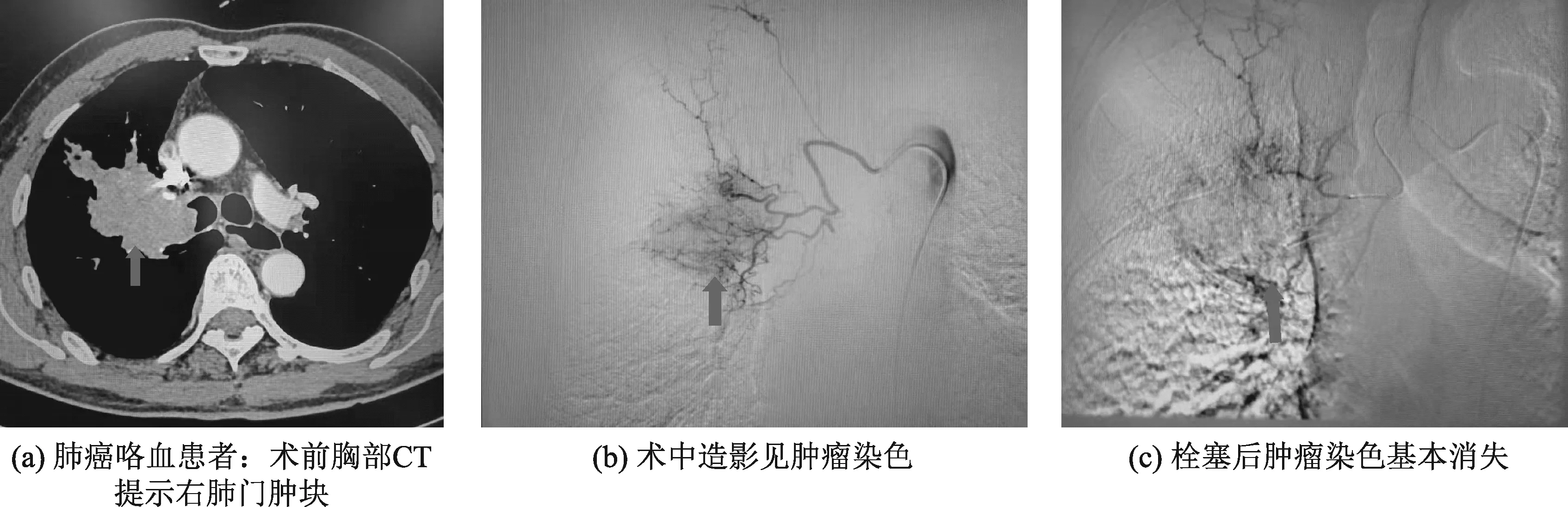
图1 肺癌咯血患者造影

图2 支气管扩张并咯血患者造影
2.2 责任血管分布情况 74例患者共栓塞126支咯血责任动脉,每例1~4支,其中1支31例,2支35例,3支7例,4支1例。在126支病变血管中,109支(86.5%)为支气管动脉,17支(13.5%)为非支气管体循环动脉。见表1。

表1 出血责任动脉分布
2.3 疗效评价 74例患者均成功实施支气管动脉栓塞术。经过随访发现,共治愈63例,显效患者7例,有效患者2例,无效患者2例,止血总有效率为97.3%;复发3例,复发率为4.05%。2例无效病例均为肺癌大咯血患者,术后48h再次出血死亡。3例复发患者中1例为肺癌,术后33d再次咯血;2例为支气管扩张,分别于术后47d、55d再次咯血,复发患者均再次行BAE治疗后未再咯血。见表2。

表2 咯血术后疗效分析
2.4 术后并发症 术后发热5例(6.76%),胸痛7例(9.46%),经对症治疗后恢复正常,均未发生脊髓损伤及异位栓塞等严重并发症。
3.讨论
大咯血是常见的临床急症,病情进展凶险,患者可因气道阻塞窒息或大出血休克死亡,内科保守治疗效果往往不佳,外科手术风险亦大,死亡率高达50%[4]。大咯血的病因较复杂,本组病例以支气管扩张、肺结核、肺部感染为主要病因,与文献报道相符[5]。
1974年Remy等[6]首次报道成功行介入栓塞支气管动脉治疗大咯血,目前BAE已成为治疗咯血的有效手段。动脉诊断性造影寻找责任血管是BAE术治疗成功的第一步。支气管动脉(bronchial artery,BA)通常开口于胸5椎体上缘至胸6椎体下缘水平,是公认的咯血责任血管。相关研究[7]表明,非支气管性体动脉(nonbronchial systemic arteries,NBSA)也可能为责任血管。本组病例共发现126支咯血责任动脉,每例患者责任血管数变异较大(每例1~4支),其中1支31例,2支35例,3支7例,4支1例。在126支咯血责任动脉中,109支(86.5%)为支气管动脉,17支(13.5%)为非支气管性体动脉,提示支气管动脉为主要责任血管。非支气管性体动脉分别为胸廓内动脉5支,肋间动脉5支,膈下动脉4支,胃左动脉1支,甲状颈干1支。结合术中造影结果,符合异位起源的支气管动脉遵循的就近原则,即肺底病变主要由膈下动脉供血等[8]。随着支气管动脉CTA技术的普及,术前即可清晰显示咯血动脉起源、形态、走行等空间解剖关系。文献[9]报道术前支气管动脉CTA检查诊断准确率高达90%以上,本组病例术前均完善支气管动脉CTA,有利于判断责任血管部位。当然在临床工作中,对于须紧急抢救患者,可先对CT怀疑的患侧进行治疗,以尽快止血。
文献[4]报道BAE止血的成功率为76.4%~96%,本研究采用“三明治”术式行永久性栓塞责任血管,治愈63例,显效7例,有效2例,无效2例,止血成功率达97.3%。2例无效病例均为肺癌大咯血患者,且为高龄,术后48h再次出血,并发窒息死亡。肺部基础病变进展和病变动脉漏栓或血管再通是BAE术后咯血复发的主要原因[10]。治疗咯血后复发的第1个高峰出现在术后1~2个月,主要原因是漏栓支气管动脉或非支气管性体动脉,第2个高峰出现在栓塞后1~2年,主要原因是栓塞动脉再通或病变进展导致侧支循环建立和新非支气管性体动脉形成[2]。通过随访,1例肺癌及2例支气管扩张患者在术后1~3月再次出现咯血,再次行BAE后未再咯血。复发原因为肺癌患者肿瘤病变进展所致,再次行栓塞的同时一并灌注化疗药物控制肿瘤;2例支气管扩张患者是因漏栓非支气管性体动脉所致。本研究中部分患者术后有发热、胸痛等栓塞综合征表现,经对症治疗后恢复正常,均无异位栓塞和损伤脊髓等严重并发症。近年来,栓塞材料不断改进,为介入科医生提供了更多的选择,如多个文献[11,12]报道了应用Embosphere微球治疗肺癌大咯血,取得了不错的疗效。总之,合理治疗原发病、术中超选择技术、选择适当栓塞材料有助于降低术后并发症发生率。
综上所述,BAE术治疗大咯血疗效确切,复发率低,并发症少,安全性高。本研究为回顾性研究,入选患者样本量有限,随访时间短,故仍需前瞻性、多中心研究来验证本结论。

