恩替卡韦仿制药与原研药治疗慢性乙型肝炎的疗效及安全性研究Δ
谢 英,马 骁,赵艳玲
(1.解放军总医院第五医学中心药剂科,北京 100039; 2.成都中医药大学药学院,四川 成都 611137)
慢性乙型肝炎(chronic hepatitis B,CHB)是我国法定传染病中发病率居第2位的疾病[1]。我国现有CHB患者2 000万~3 000万例,仅11%的患者得到规范的抗病毒治疗,而由于治疗不及时等原因,每年约30万人死于乙肝并发症[2-3]。核苷酸类似物是CHB的主要治疗药物,恩替卡韦是一线推荐的核苷酸类似物[4]。恩替卡韦分散片(润众)是第1批“4+7”药品带量采购中标品种,尽管其通过了仿制药一致性评价,但是人们对于其在真实世界中的疗效、安全性仍有疑虑[5-6]。本研究为了解恩替卡韦仿制药在真实世界中的疗效和安全性,开展了多中心的恩替卡韦仿制药与原研药24周疗效及安全性的比较。
1 资料与方法
1.1 资料来源
纳入2018年9月至2019年3月于解放军总医院第五医学中心、首都医科大学附属佑安医院及首都医科大学附属地坛医院3家传染病特色医院门诊就诊的CHB患者资料进行回顾性研究。入组患者的诊断标准均符合《慢性乙型肝炎防治指南(2015年版)》[7],同时获得伦理委员会批准[批准号:FRM-EC-018-02-V2.0(20141120)-2019022D]。纳入标准:年龄≥18岁;入组前12周未使用其他抗乙型肝炎病毒(hepatitis B virus, HBV)药物(包括其他商品名的恩替卡韦);剂量为5 mg/d,空腹服用。排除标准:合并免疫缺陷性疾病、其他类型肝炎、失代偿期肝病、肝癌和肾脏疾病者;入组前12周内服用过糖皮质激素或其他免疫抑制剂者。初步符合上述标准的原研药组患者有2 471例,仿制药组患者有10 909例。
1.2 方法
从电子病历系统收集患者门诊数据,如基线数据,包括年龄、性别、是否存在肝硬化、乙型肝炎e抗原(HBeAg)、乙型肝炎e抗体(HBeAb)和HBV DNA。随访时间为24周,患者随访时间窗为±4周。对两组患者的相关数据进行统计、对比分析。
1.3 观察指标
疗效评估主要指标为完全病毒学应答(complete virologic response,CVR)率,次要指标为HBeAg转阴率及血清学转换率。CVR定义为检测不到HBV DNA(HBV DNA<100 IU/ml);HBeAg血清学转换率定义为HBeAg转阴且HBeAb转阳。安全性评估指标包括血小板减少率、血肌酸激酶升高率和血肌酐升高率。
1.4 统计学方法

2 结果
2.1 人口学资料及基线特征
根据纳入、排除标准,初步纳入原研药组患者2 471例,仿制药组10 909例,两组患者基线资料见表1。

表1 两组初始纳入患者基线资料比较Tab 1 Comparison of baseline information between initial enrolled patients in two groups
2.2 病毒学应答
经进一步筛选,排除失访患者数据后,两组最终纳入患者病毒学应答情况比较见表2。未进行PSM前,两组患者CVR的差异无统计学意义(P=0.374>0.05);经PSM校正基线后,两组患者CVR的差异仍无统计学意义(P=0.576>0.05)。

表2 两组最终纳入患者病毒学应答率比较Tab 2 Comparison of virologic response rates between two groups
2.3 血清学应答
两组最终纳入患者的HBeAg转阴率、HBeAg血清学转换率比较见表3。未进行PSM前,两组患者HBeAg转阴率的差异无统计学意义(P=0.594>0.05);经PSM校正基线后,两组患者HBeAg转阴率的差异仍无统计学意义(P=0.687>0.05)。未进行PSM前,两组患者HBeAg血清学转换率的差异无统计学意义(P=0.075>0.05);经PSM校正基线后,两组患者HBeAg血清学转换率的差异仍无统计学意义(P=0.683>0.05)。

表3 两组最终纳入患者血清学转换比较Tab 3 Comparison of serological conversion rates between two groups
2.4 安全性
(1)两组最终纳入患者的血小板减少率比较见表4。未进行PSM前,两组患者血小板减少率的差异无统计学意义(P=0.333>0.05);经PSM校正基线后,两组患者血小板减少率的差异仍无统计学意义(P=0.340>0.05)。(2)两组最终纳入患者的血肌酐升高率比较见表5。未进行PSM前,两组患者血肌酐升高率的差异无统计学意义(P=0.435>0.05);经PSM校正基线后,两组患者血肌酐升高率的差异仍无统计学意义(P=0.435>0.05)。(3)两组最终纳入患者的血肌酸激酶升高率比较见表6。未进行PSM前,两组患者血肌酸激酶升高率的差异无统计学意义(P=0.952>0.05);经PSM校正基线后,两组患者血肌酸激酶升高率的差异仍无统计学意义(P=0.952>0.05)。

表4 两组最终纳入患者血小板减少率比较Tab 4 Comparison of thrombocytopenia rates between two groups
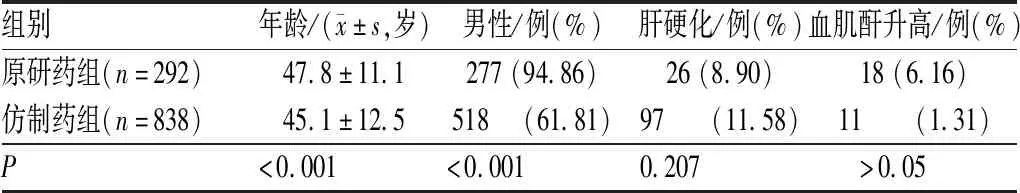
表5 两组最终纳入患者血肌酐升高率比较Tab 5 Comparison of creatinine kinase elevation rates between two groups

表6 两组最终纳入患者血肌酸激酶升高率比较Tab 6 Comparison of creatine kinase elevation rates between two groups
3 讨论
恩替卡韦是鸟嘌呤核苷类似物,也是目前一线治疗CHB的药物中最早进入我国的口服抗病毒药[9]。24个国家的临床研究结果均证实了恩替卡韦仍是高效、安全且低耐药的CHB治疗药物[10]。然而,恩替卡韦的长期疗效还受制于药物的依从性[10-11]。国内CHB患者的依从性较低,与抗病毒药的经济性密切相关[12]。第1批“4+7”城市集中带量采购纳入了恩替卡韦分散片(润众),不仅降低了患者药费负担,同时对CHB并发症的发生率及病死率可能会有间接影响。
仿制药一致性评价的核心是生物等效性[13]。目前已有多个恩替卡韦品种通过了仿制药一致性评价。徐京杭等[14]的前瞻性随机、对照、多中心临床研究结果证实,通过生物等效性研究的恩替卡韦仿制药与原研药在临床有效性和安全性方面相当。恩替卡韦仿制药的研究既应关注其与原研药的生物等效性,也要关注其在真实世界中与原研药的疗效和安全性是否相同[15]。恩替卡韦分散片(润众)已于2017年通过了仿制药一致性评价,具有与原研药的生物等效性,但仍需要真实世界研究结果证实其疗效与安全性,为其临床大规模应用提供可靠依据。
临床研究结果发现,24周的早期病毒学应答(HBV DNA转阴)是CHB抗病毒治疗效果的重要参考指标[16-17]。本研究结果显示,恩替卡韦仿制药24周的CVR与原研药的差异无统计学意义(P>0.05),通过基线数据校正后仍发现两者均可达到相似的早期病毒学应答。此外,两者在24周的HBeAg血清学转换率(包括HBeAg清除伴或不伴HBeAg/HBeAb血清学转换)也无差异。上述结果表明在真实世界中,恩替卡韦仿制药早期的抗病毒疗效不劣于原研药。
恩替卡韦安全性评价主要依赖于主动的或被动的不良反应报告。本研究中的研究对象为门诊患者,不良反应报告难以获得,故以客观实验室检查指标进行安全性评价。核苷酸类似物相关不良反应主要包括肾功能损伤、低磷性骨病、肌损伤、乳酸酸中毒和周围神经病等[18]。恩替卡韦可引起肌损伤、血小板减少及血肌酐升高等不良反应[19-20],故本研究纳入的客观指标为血肌酸激酶、血小板及血肌酐。本研究结果发现,恩替卡韦仿制药24周的肌酸激酶升高率、血小板减少率及血激酐升高率与原研药的差异均无统计学意义(P>0.05),该结果可在一定程度上反映恩替卡韦仿制药的安全性不劣于原研药。
综上所述,在真实世界中,恩替卡韦仿制药早期抗病毒疗效和安全性与原研药相似。但是,本研究为多中心、回顾性研究,失访患者较多,门诊患者可采集到的信息有限,随访周期较短,需要进一步的深入研究。

