木薯淀粉制备热转化糊精及其特性研究
杨亚鸽,刘 洁,刘亚伟
河南工业大学 粮油食品学院,河南 郑州 450001
热转化糊精作为一种改性淀粉,具有低分子量[1-2]、高溶解度[2]以及低黏度[3]的特点,常用作包埋剂[1]、胶黏剂[4]以及抗性糊精的制备[5]。通常是在酸或其他催化剂存在的条件下,加热预先干燥的淀粉进行热解来制备热转化糊精。根据淀粉热处理条件的不同,热转化糊精可以分为白糊精、黄糊精和英国胶等3种[6]。
淀粉在形成热转化糊精的过程中主要涉及水解反应、转糖苷反应以及再聚合反应[7]。水解反应主要发生在转化的初始阶段,淀粉中的α-1,4糖苷键或α-1,6糖苷键都有可能发生水解,导致分子量和黏度的降低;随着糊精化反应的进行,断裂的α-1,4糖苷键与邻近的游离羟基结合发生转糖苷反应,产生新的分支结构;此外,葡萄糖和低聚糖在酸和高温下也可以发生再聚合反应形成较大的分子,导致黏度略微升高和还原糖含量降低[7]。由于在热转化过程中淀粉产生了不能被酶消化的多糖成分[8],因此具有膳食纤维的功能特性。
目前国内对热转化糊精的研究多数集中在制备与工业应用方面,已有的报道多以玉米淀粉为原料制备热转化糊精,使用薯类淀粉的报道还不多见。相比玉米淀粉的糊精化,木薯淀粉转化更加容易。木薯淀粉几乎不含会影响热转化过程的脂类,而且生产及控制更为容易,使得木薯热转化糊精在稳定性和颜色方面存在优势[9]。因此作者以木薯淀粉为原料,采用酸热处理的方法制备高纤维的热转化糊精,并对其理化特性进行测定,为深入探究热转化糊精的变化规律提供参考。
1 材料与方法
1.1 试验材料
木薯淀粉:河南恒瑞淀粉科技股份有限公司;膳食纤维测定试剂盒:爱尔兰Megazyme公司;盐酸、冰乙酸、氢氧化钠、无水乙醇、3,5-二硝基水杨酸等均为分析纯。
1.2 仪器与设备
EUROSTAR 40 digital搅拌器:德国IKA公司;HH-6 J数显恒温水浴锅:上海维城仪器有限公司;HWCL-3磁力搅拌反应浴:郑州长城科工贸有限公司;GSF6膳食纤维测定仪:意大利VELP公司;RE-52AA旋蒸仪:上海亚荣生化仪器厂;PHS-2F pH计:上海精密科学仪器有限公司;LC-20AT高效液相色谱仪、RID-10 A检测器:日本SHIMADZU公司;CR-400色彩色差计:日本KONICA MINOLTA公司;50iPOL偏光显微镜:日本Nikon公司;D8 DVANCE X-射线衍射仪:德国Bruker公司。
1.3 试验方法
1.3.1 热转化糊精的制备及工艺优化
称取一定量的木薯淀粉与质量分数1%盐酸溶液混合,盐酸溶液稀释后加入淀粉(淀粉∶盐酸=2∶1,g/mL)并于室温下过夜平衡,使淀粉与盐酸均匀混合。将混合物进行干燥(水分低于5%)后放入聚四氟乙烯反应瓶中于油浴中反应,反应过程中充入氮气。待反应结束立即放入-20 ℃冰箱冷却,之后将样品研磨并用乙醇洗涤,再经干燥、研磨,过100目筛后放入双层自封袋备用。
选取热转化温度(100、120、140、160、180 ℃)、热转化时间(60、90、120、150、180、210、240 min)和盐酸用量(8%、10%、12%、14%、16%)3个因素进行单因素试验。在此基础上,通过正交试验设计确定最佳制备工艺。因素与水平见表1。
1.3.2 膳食纤维含量测定
参照GB/T 22224—2008《食品中膳食纤维的测定 酶重量法和酶重量法-液相色谱法》中第二法和GB 5009.88—2014《食品安全国家标准 食品中膳食纤维的测定》测定样品中膳食纤维含量。
1.3.3 白度测定
使用色彩色差计测定样品白度,数据以CIELAB表色系统(L*、a*、b*)表示。其中L*表示亮度,范围为0~100(黑色—白色);a*的范围为-100~100(绿色—红色);b*的范围为-100~100(蓝色—黄色),重复3次。样品的白度计算见式(1)。
WI=100-[(100-L*)2+a*2+b*2]1/2,
(1)
式中:L*、a*、b*为样品的色度空间值;WI为样品的白度。
1.3.4 光学显微镜观察
使用胶头滴管吸取1%的样品溶液滴至载玻片上,以甘油作为分散剂。加盖玻璃片后在放大倍数为200X下观察样品的颗粒形态与偏光十字的变化。
1.3.5 溶解度测定
样品溶解度测定参照Lovera等[10]的方法,略有改动。称取0.2 g样品于20 mL蒸馏水中,在室温下磁力搅拌30 min,之后将样品溶液在3 000 r/min下离心15 min,离心结束后取10 mL上清液于恒质量的烧杯中,然后在110 ℃烘箱中干燥4 h。样品溶解度计算见式(2)。

(2)
1.3.6 X-射线衍射测定
样品的结晶结构通过广角X-射线衍射仪测定。样品测定前置于50 ℃烘箱中过夜干燥,参数设置为工作电压40 kV,工作电流30 mA,2θ衍射角5°~45 °,扫描速率4 °/min[11]。相对结晶度计算见式(3)。
相对结晶度=[Ac/(Ac+Aa)]×100%,
(3)
式中:Ac为结晶区面积;Aa为无定性区面积。
1.3.7 酸热稳定性测定
称取一定量样品溶解于pH值分别为1、2、3、4、5、6、7的溶液中得到0.2%的样品溶液,将样品溶液于25 ℃下放置24 h,然后使用0.1 mol/L或1 mol/L的NaOH调pH值至7.0±0.1,进行pH值稳定性的测定;在热稳定性测定中,将配制好的样品溶液直接在85 ℃水浴中加热30 min,结束后立即冷却并中和[12-13]。采用DNS法[14]测定溶液中的还原糖含量(RSC),通过RSC变化判断其酸热稳定性。
1.3.8 数据处理
使用Origin 8.5对数据进行绘图,采用SPSS 20.0进行方差分析,结果取平均值±标准差。
2 结果与分析
2.1 单因素试验结果
2.1.1 热转化温度对膳食纤维含量和白度的影响
固定热转化时间120 min、盐酸用量10%不变,不同热转化温度(100、120、140、160、180 ℃)对PD膳食纤维含量和白度的影响如图1所示。随着热转化温度的升高,PD的膳食纤维含量显著升高,与此同时,白度显著降低。Weil等[15]的研究结果显示,淀粉在高温下更容易产生除α-1,4/α-1,6糖苷键之外的糖苷键,α-1,2、β-1,2、β-1,4、β-1,6等糖苷键的形成导致膳食纤维含量升高。另外,酸热转化初期产生的还原性端基使淀粉在高温下发生一定程度的焦糖化反应[16],引起白度下降。

注:曲线上不同的字母表示差异显著(P<0.05)。图2和图3同。图1 热转化温度对膳食纤维含量和白度的影响Fig.1 Effect of pyroconversion temperature on dietary fiber content and whiteness
2.1.2 热转化时间对膳食纤维含量和白度的影响
固定热转化温度160 ℃、盐酸用量10%不变,不同热转化时间(60、90、120、150、180、210、240 min)对PD膳食纤维含量和白度的影响如图2所示。膳食纤维含量随热转化时间的延长而增加,到150 min后增加平缓。这是由于在干燥和转化初阶段,水解反应占主导。随着反应的进行,淀粉分子链间的断裂与再聚合反应基本完成[17]。继续延长加热时间,膳食纤维的含量有所增加但白度显著降低。

图2 热转化时间对膳食纤维含量和白度的影响Fig.2 Effect of pyroconversion time on dietary fiber content and whiteness
2.1.3 盐酸用量对膳食纤维含量和白度的影响
固定热转化温度160 ℃、热转化时间120 min,不同盐酸用量(8%、10%、12%、14%和16%)对PD膳食纤维含量和白度的影响如图3所示。PD的膳食纤维含量随着盐酸用量的增加而逐渐升高,在16%时达到最高,为49.69%。同时PD的白度最低,为55.75。有研究表明在热转化过程中,盐酸的存在对酶抗性含量增加影响显著[18]。Weil等[15]研究热转化糊精时发现盐酸可以通过降低新生成糖苷键所需要的能量,产生更多的分支结构,导致膳食纤维含量的增加。
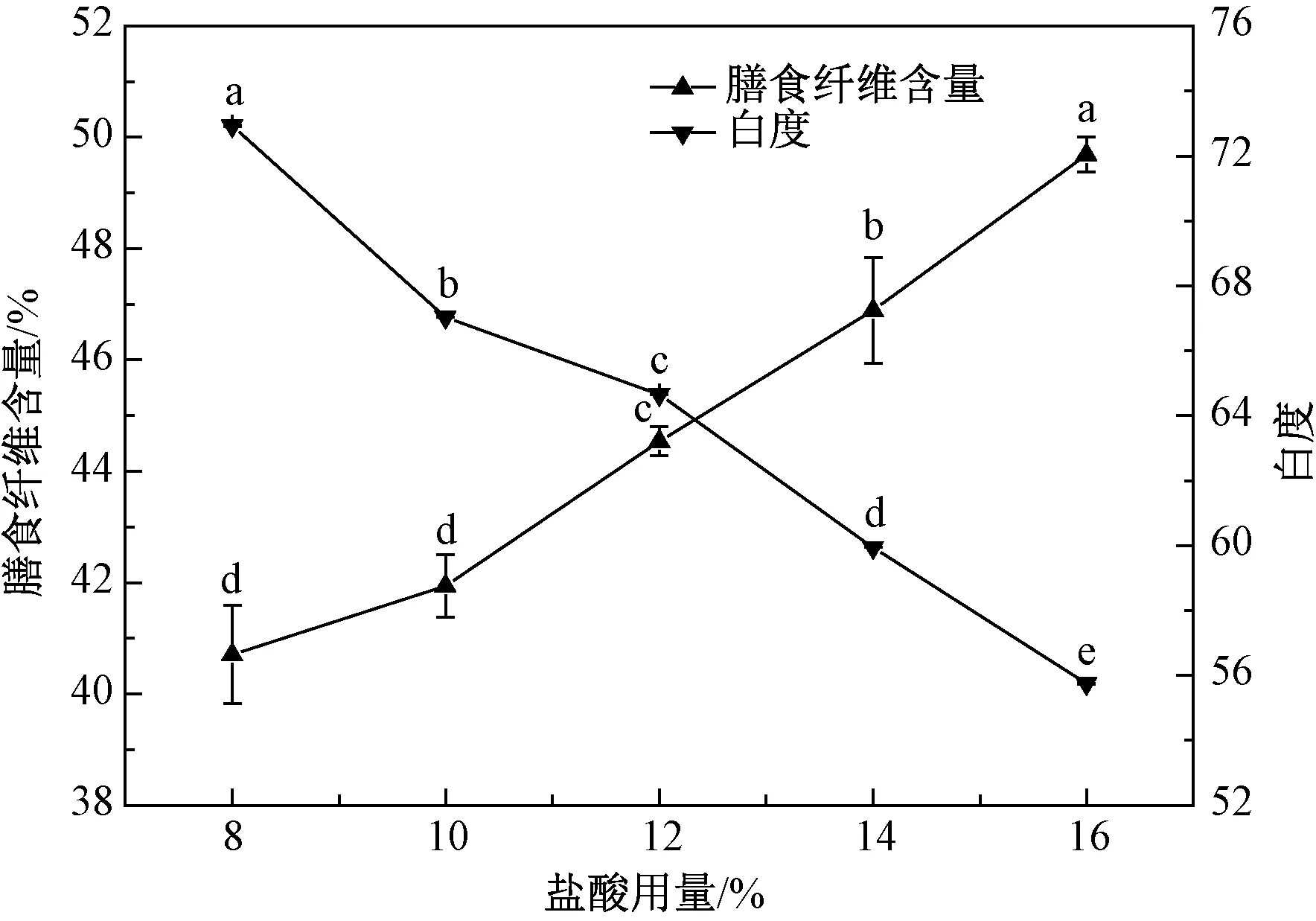
图3 盐酸用量对膳食纤维含量和白度的影响Fig.3 Effect of hydrochloric acid amount on dietary fiber content and whiteness
2.2 正交试验结果
由表2可知,各因素对膳食纤维含量影响的顺序为热转化温度>盐酸用量>热转化时间。方差分析(表3)结果显示,3个因素均对膳食纤维含量影响显著(P<0.05)。由表2中k1、k2和k3确定最佳制备条件为B3A3C2,即热转化温度为170 ℃,热转化时间为150 min,盐酸用量为14%,此时膳食纤维含量为60.65%。按照此条件进行验证试验,得到膳食纤维含量为60.79%,白度为45.27。验证值与优化结果的误差<0.2%,表示数据可靠。

表2 正交试验设计与结果Table 2 Orthogonal test design and results

表3 膳食纤维含量方差分析Table 3 Variance analysis of dietary fiber content
2.3 光学显微镜分析
TS和PD在100%甘油中的显微图像如图4所示,天然TS通常具有一个或多个圆断面。与原淀粉(图4A)相比,PD(图4B)的颗粒形态无明显变化,同时可以看到PD为黄色的颗粒,脐点清晰可见且颗粒完整性依旧保持。这与文献[19-20]的报道结果一致。在偏振光下观察TS(图4a)和PD(图4b)时,两者都具有偏光十字现象。偏光十字现象与淀粉分子链的排列相关[21]。PD的偏光十字现象不明显,说明酸热处理在一定程度上破坏了淀粉的结晶结构,但颗粒内部的分子链依旧存在有序排列的结构。

注:A、a分别为木薯淀粉的光学和偏光图像;B、b分别为热转化糊精的光学和偏光图像。图4 光学和偏光显微镜图Fig.4 Characterization of TS and PD with bright-field and polarized light microscopy
2.4 溶解度分析
TS几乎不溶于冷水,而PD在冷水中的溶解度为93.81%。相比TS的溶解度(0.50%),PD的溶解度显著提高。这是因为在热转化过程中,高温引起淀粉分子链的断裂与重聚,紧密的结晶区被破坏,使得PD几乎能够完全溶于水。相比甘油,水分子能够进入到PD颗粒的内部并引起结晶结构的破坏[20]。已知淀粉颗粒的内部结构往往比其外壳脆弱得多[19]。因此,结合光学显微镜的结果可知,淀粉在热转化过程中颗粒的外部并未被破坏,但是其内部的结晶结构变得松散。当水分子介入时,其颗粒结构迅速被破坏并溶解。
2.5 X-射线衍射分析
由图5可知,TS在2θ=15°和23°处出现强的衍射峰,在2θ=20°附近出现1个弱的衍射峰,在17°/18°出现1个双峰,表明TS为A型结晶[22]。相比原淀粉,PD在2θ=15°、20°和23°处的衍射峰强度降低甚至消失,17°/18°处的双峰变成一个峰。经计算得出TS的相对结晶度由29.41%降低到9.48%,说明酸热处理对淀粉的结晶结构有破坏作用,进一步证实了2.3中的分析结果。Li等[23]的研究结果也显示在200 ℃条件下制备的热转化糊精其结晶区仍未完全破坏。

图5 TS和PD的X-射线衍射图谱Fig.5 X-ray diffraction patterns of TS and PD
2.6 加热稳定性和pH值稳定性分析
表4为PD在不同pH值溶液中加热和贮藏的还原糖含量(RSC)变化,在85 ℃加热条件下,随着pH值的下降,PD的RSC从6.01%升高到13.25%。在25℃条件下贮藏24 h的PD溶液的RSC也具有类似的现象,RSC随着pH值的降低呈现增长趋势。通常情况下,加热比室温下贮藏可以获得更高的RSC[13]。从表4可知,在同一pH值溶液中,加热条件下PD的RSC大于室温贮藏的。当pH=1时,加热条件下的PD具有最高的RSC(13.25%),而室温贮藏PD的RSC(6.36%)略有升高但变化幅度较小。Glibowski等[12]研究菊粉在不同pH值下加热不同时间RSC的变化发现,在酸性环境中,菊粉的RSC随加热温度的升高也具有类似的变化规律。当在室温下贮藏时,PD在所有pH值下的RSC变化均在1%左右;PD在pH值为1的溶液中加热后具有最高的RSC,在pH值为2~7的溶液中RSC变化也在1%内。PD的高溶解度及在酸热环境中的稳定性有助于其在饮料行业中的应用。

表4 酸热条件对PD还原糖含量影响Table 4 Effect of acid-thermal on RSC of PD %
3 结论
通过单因素和正交优化试验,确定木薯热转化糊精的最佳工艺条件为热转化温度170 ℃、热转化时间150 min、盐酸用量14%,在此条件下制备的热转化糊精的膳食纤维含量为60.79%,白度为45.27。将制备的热转化糊精与木薯淀粉的特性进行对比发现,酸热处理破坏了木薯淀粉的结晶区,木薯淀粉的相对结晶度由29.41%降低到9.48%;此外,热转化糊精颗粒形态无明显变化,有序结构仍然存在,但热转化糊精在冷水中的溶解度显著提高。结合酸热稳定性结果,热转化糊精可以应用于酸性食品或饮料行业(pH>1)中,以此来减少糖类的使用。

