夏季长江口水体可溶性有机质组成的空间分布特征及其控制因素
王安月, 张 凯, 何 丁, 范代读, 孙永革*
夏季长江口水体可溶性有机质组成的空间分布特征及其控制因素
王安月1, 张 凯1, 何 丁1, 范代读2, 孙永革1*
(1. 浙江大学地球科学学院 有机地球化学研究组, 浙江 杭州 310027; 2. 同济大学 海洋地质国家重点实验室, 上海 200092)
本研究通过测定有色溶解有机物(CDOM)的吸收光谱、荧光可溶性有机质(FDOM)的激发-发射-矩阵三维荧光光谱(excitation-emission-matrix spectra, EEMs)和稳定碳同位素组成(13C), 系统探讨了长江口夏季水体可溶性有机质(DOM)的组成、来源、空间分布及河口混合行为等。研究结果表明, 可溶性有机碳(DOC)浓度整体呈现由陆到海逐渐降低的趋势, 表征有色溶解有机物含量水平的吸收系数(355)与盐度呈负相关关系, 指示可溶性有机质中荧光组分在河口的分布主要受稀释作用调控。利用EEMs并结合平行因子分析(PARAFAC)鉴定出代表陆源有机质的类腐殖质的荧光组分C2和C3, 以及代表原地生产力的类蛋白质荧光组分C1和C4。由近岸到外海, 表征海洋藻类生产力的C1组分在水体荧光有机质中所占比例增高, 陆源信号则呈现逐渐降低趋势, 与此相对应, 外海水可溶性有机质具有高的光谱斜率275-295/350-400比值和重碳同位素组成。基于盐度.可溶性有机碳浓度、盐度.13C值的河流-海洋双端元混合模型, 发现长江口最大混浊带存在可溶性有机碳的移除过程, 且表现为以物理稀释作用为主的缺失性非保守混合行为。研究成果揭示了水动力条件是控制长江口-东海陆架系统可溶性有机质组成和空间分布的关键因素。
可溶性有机质; 碳同位素; 混合行为; 三维荧光光谱-平行因子分析; 长江口
0 引 言
可溶性有机碳(DOC)是海洋中最大的有机碳库, 与大气中的CO2含量相当(相当于0.75×1018g 碳)。据估算, 每年约有0.25×1015g可溶性有机碳通过河流进入到海洋[1], 约占流入海洋总碳量(有机碳和无机碳共0.9×1015g)的30%, 更是占到流入海洋有机碳的60%之多[2]。可溶性有机碳从近海至远洋, 浓度发生急剧下降, 每年只有约0.1 Gt的可溶性有机碳在深海中流通, 说明有接近一半的可溶性有机碳从河口进入海洋的过程中发生了改变[3]。然而, 至今对于水体可溶性有机质(DOM)从河口至大洋的转化降解形式以及最终归缩的了解仍十分有限, 尤其是陆源有机质的输入和迁移转化途径, 已经成为了当前海洋碳循环研究的热点问题之一。
河口作为陆地生态系统和海洋生态系统的交汇处, 水动力条件、盐度梯度变化较大, 具有水体存留时间短、溶解态物质周转速率快和生物地球化学过程复杂且剧烈等特点, 是开展可溶性有机碳来源和归宿研究最复杂的水体之一, 其中可溶性有机碳在水体中是否遵循保守行为一直存有争议。理论上, 当只有淡水与海水两端元混合时, 可溶性有机碳浓度与盐度之间存在线性关系, 表现出保守性(不存在添加与去除过程)[4-5]。但越来越多的研究揭示, 可溶性有机碳在河口存在降解消耗、絮凝沉降、以及与颗粒有机碳(POC)的相互转化等行为, 使得可溶性有机碳浓度偏离于混合保守曲线, 通常表现出移除或者添加的行为[6-11]。Álvarez-Salgado.[12]在对Humber河口的研究中发现, 可溶性有机碳只有在盐度大于5的区域表现出良好的保守混合行为, 而当盐度小于5时, 可溶性有机碳表现出随盐度上升而快速的移除过程。张向上[9]在研究黄河口可溶性有机碳的混合行为时发现, 在盐度大于5的区域同样有较好的保守性混合行为, 海水稀释占了主导地位, 与前人不同的是, 在盐度小于5的区域, 由于颗粒有机碳向可溶性有机碳的转化, 使得可溶性有机碳浓度高于保守混合线, 表现出增高的趋势。Cauwet[13]对Yugoslavia Krka河口、Callahan.[14]对珠江口的研究发现, 可溶性有机碳仅在一个小范围的盐度梯度内与盐度呈现出较好的相关性, 若以整个河口水体为研究对象, 则没有明显的保守行为。Medeiros.[11]在观测亚马逊河-西大西洋体系中可溶性有机碳的动态变化过程中, 发现大量可溶性有机碳在河口内浓度低于保守混合线, 存在大量去除过程。由此可见, 河口区内部的物理、化学和生物过程对可溶性有机碳浓度的控制可能远比外部混合重要。因此, 多因素作用下可溶性有机碳化学组成的动态过程成为揭示河口区可溶性有机碳浓度动态过程控制因素的重要手段。
长江作为中国第一大河流, 其入海径流量占东海所有河流径流输入的90%~95%[15]。长江口区域的物质输送受到潮汐活动、陆源径流量以及东海复杂水系等多重因素的影响, 其中最大浑浊带的存在, 为可溶性有机碳物理、化学和生物反应提供了理想的场所, 是河口“过滤器”最突出的表现[16]。Ogawa.[17]沿长江口冲淡水方向对可溶性有机碳浓度的空间分布及其控制因素进行了系统研究, 结果显示, 可溶性有机碳浓度介于65~75 μmol/L之间, 主要受控于水文条件的变化而非叶绿素a (a)表征的生物量。对可溶性有机质的光谱研究揭示, 有色溶解有机物(CDOM)的组成主要受外源输入、保守性混合以及相态转化影响。有色溶解有机物主要荧光组分均表现为近岸高远岸低的特征, 荧光组分浓度与叶绿素a以及盐度的相关性指示浮游植物对有色溶解有机物组成的直接影响较小, 夏季长江的径流输入是该海域有色溶解有机物的主要来源。同时, 长江口外区域表层有色溶解有机物浓度显著受潮汐活动影响[18-20]。总体上, 生物来源的有色溶解有机物比例随着盐度的增加而增加[21], 而类腐殖质组分浓度随着盐度的增加而线性减小, 说明类腐殖质组分主要受到咸淡水物理混合的影响[22]。Guo.[23]应用保守混合模型提出长江口的有色溶解有机物遵守保守混合行为, 物理稀释作用是影响可溶性有机碳浓度分布的关键。然而, 平行因子分析(PARAFAC)揭示河口区表现出非保守性混合行为, 在最大浑浊带存在有色溶解有机物添加过程[24]。最大浑浊带区域荧光组分浓度的增加也被认为可能与沉积物再悬浮作用有关[22]。另一方面, 长江口最大混浊带混合行为还存在时间和空间上的差异性, 长江口北港在洪水季表现为保守性混合, 在枯水季则存在显著的添加, 而难降解的可溶性有机质主要通过南港入海口汇入东海, 黄浦江汇入南港后带入了大量的生物可利用性较高的可溶性有机质, 受人类活动影响大[21,25]。由此可见, 长江口最大浑浊带对于可溶性有机质的组成和空间展布起到直接调控作用, 在最大浑浊带很可能存在一个显著的可溶性有机碳添加过程。由于基于可溶性有机碳与盐度间的线性关系只能代表输入与消耗之间的平衡, 不能代表绝对的保守行为[8]。因此, 至今对于最大浑浊带的调控作用的了解仍十分有限, 关键在于可溶性有机质来源的动态过程难以很好地刻画。本研究拟利用紫外吸收光谱、激发-发射-矩阵三维荧光光谱和平行因子分析(EEMs- PARAFAC)等技术, 并结合可溶性有机碳碳同位素组成和保守混合模型, 试图探讨: (1) 夏季长江口可溶性有机质的组成、来源、空间分布特征及控制因素; (2) 最大浑浊带对于陆源物质的过滤作用。以期帮助了解可溶性有机质在河口的内部循环机制, 及其对于河口区碳循环、储存的影响。
1 材料与方法
1.1 样品的采集与预处理
2017年7月24日至30日, 利用同济大学海洋地质国家重点实验室组织的YES航次获得YE断面18个站位表层水样。该断面西起121°E徐六泾附近, 东至124.5°E, 南北跨度大, 覆盖水域广(图1)。每个站位取表层水样(约3 m深), 用孔径0.7 μm的GF/F膜(预先用马弗炉在450 ℃时灼烧5 h)和0.2 μm滤膜(millipore)过滤并收集于Nalgene瓶中(提前用pH=2的盐酸清洗并烘干), 于−20 ℃冷冻保存。
1.2 可溶性有机碳浓度的测定
水样带回实验室后, 解冻至室温。一部分用于可溶性有机碳浓度测定, 采用高温催化氧化法, 使用的仪器为日本岛津总TOC-L有机碳分析仪。
1.3 可溶性有机质富集和稳定碳同位素分析
按照Dittmar.[26]的流程, 采用PPL柱进行固相萃取富集可溶性有机质, 并用甲醇进行洗脱, 洗脱液置于安培瓶中封口, 置于−20 ℃冰箱中保存。
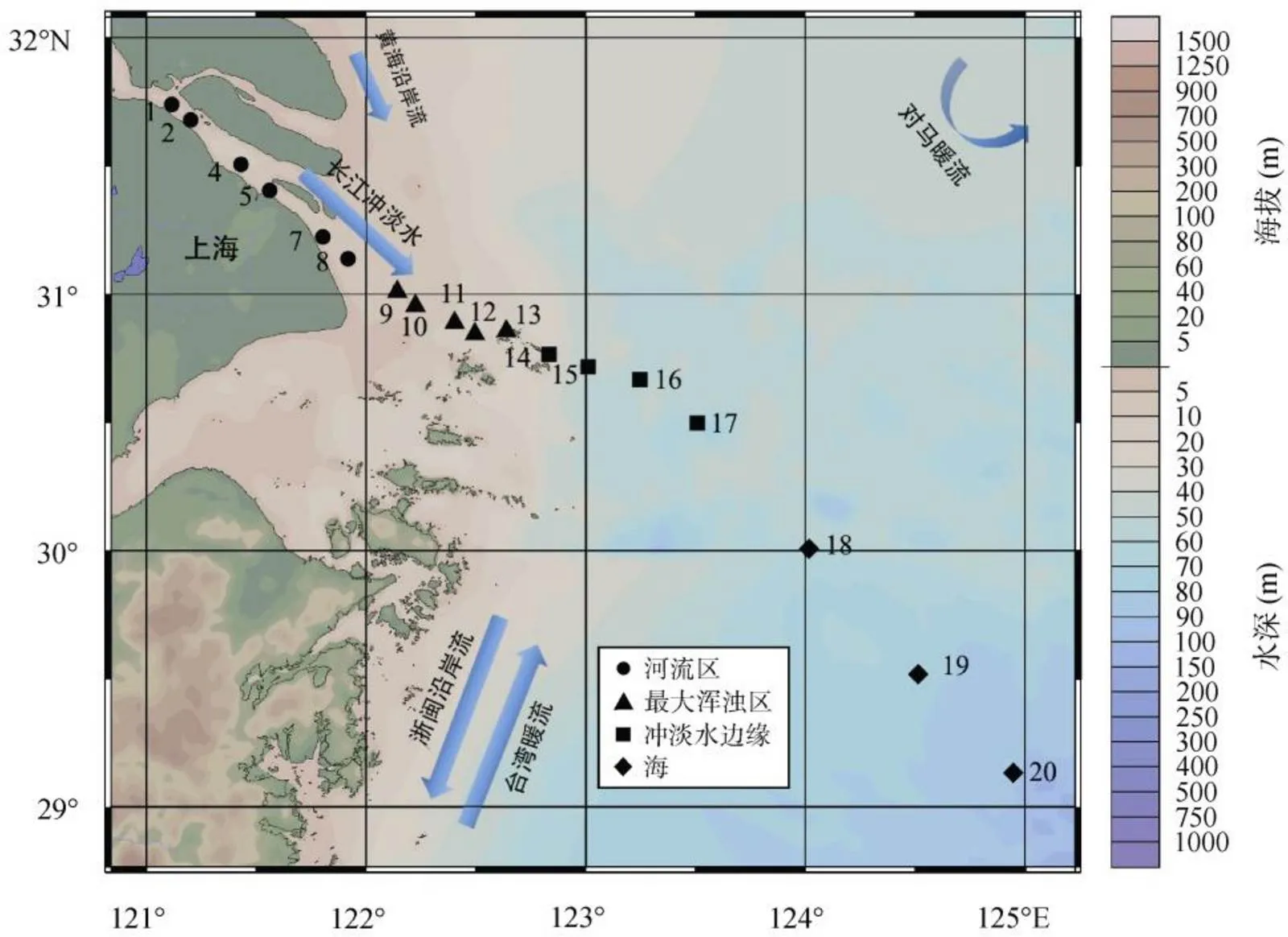
图1 长江口2017年7月采样站位图
可溶性有机质稳定碳同位素测定在连接有Thermo Fisher Flash 2000元素分析仪的Thermo Fisher MAT-253同位素质谱仪上完成。标准物质尿素监控仪器状态, 每6次进样测试1次尿素。分析精度小于±0.2‰, VPDB标准。
1.4 三维荧光光谱测定
采用三维荧光光谱仪(Aqualog)对过滤水样进行三维荧光光谱扫描。光谱激发波长范围为240~600 nm, 间隔3 nm; 发射波长为250~550 nm, 间隔3 nm。以Milli-Q水为空白参比, 对水样进行连续扫描, 获得各水样的光吸收曲线。
1.5 吸收光谱测定
采用紫外-可见光分光光度计(岛津UV-2450, 日本)对过滤水样进行紫外-可见光吸收光谱分析。扫描波长范围为200~700 nm, 步长1 nm, 光程1 cm, 以Milli-Q水作参比。采用式(1)将吸光度换算为吸收系数()。
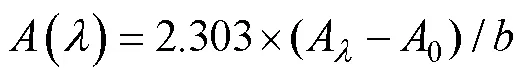
式中,A为波长处的吸光度,0为680~700nm的平均吸光度,为实验用比色皿的宽度。用于校正可溶性有机质过滤液中胶体颗粒引起的光散射效应。
有色溶解有机物的光吸收特性表现为在紫外可见光区最高, 到红外光谱区降为零, 光谱吸收近似呈指数衰减的规律[27], 可用式(2)进行表示。
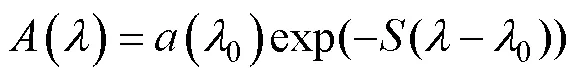
式中,(0)为有色溶解有机物的吸收系数;为波长;0为参照波长;为指数函数曲线斜率参数, 表示吸收系数随波长降低的程度。
本研究采用355 nm处的紫外吸收系数(355)表征水体中有色溶解有机物含量[10,23,28]。
光谱斜率比275-295/350-400是将指数方程(2)经自然对数转化后, 对275~295 nm或350~400 nm波长范围内的吸收系数进行线性拟合而得到。通过275-295和350-400的比值可以获得斜率比(S), 该值可用于有色溶解有机物来源识别。一般认为,S越大, 可溶性有机质相对分子质量越小, 海源有色溶解有机物的成分越大[29]。
1.6 荧光光谱-平行因子分析
PARAFAC是一种基于交互最小二乘法获得数据残差平方和最小的算法, 是一种解析三维荧光光谱常用的方法。PARAFAC利用模型来确定组分的峰位置, 使分析过程简便快捷, 并且提高了分析的灵敏度。利用其分析解的唯一性, 可以成功区分化学结构相似的荧光组分[30-31]。本研究采用PARAFAC模型对有色溶解有机物的三维荧光光谱进行分解, 以识别长江口水体有色溶解有机物的荧光组分特征。利用Matlab软件对获得的三维荧光光谱图进行模拟识别, 共得到4种组分, 其中有2种是类腐殖质组分, 2种是类蛋白质组分, 通过折半分析法验证结果的可靠性。
2 结果与讨论
2.1 长江口环境梯度分区及其对可溶性有机碳浓度的控制作用
一般认为, 长江冲淡水盐度值主要介于5~31之间, 主体盐度值为18~28[32]。夏季受台湾暖流影响, 冲淡水会在122°30′~123°50′E附近转向东北济州岛方向[33]。本航次水体盐度实测结果显示, 沿采样断面由西向东表现出盐度逐渐增加的过程, 其中16站位以东可能受台湾暖流的影响, 形成的上升流使得盐度快速递增(图2)。站位15以西, 即河口至123°E范围内, 属于长江冲淡水区域。站位14至17区间同时受到了长江冲淡水和台湾暖流的影响, 盐度梯度较小, 位于水舌边缘(图1)。由水体表底层浊度分布图可以发现在站位9至13范围内浊度值出现高值, 指示“最大浑浊带”的存在(图2)。为了便于讨论不同水文条件对可溶性有机质混合行为的影响, 将研究区域分为4部分(图1)。河流区: 站位1至8, 盐度接近于0; 最大浑浊带: 站位9至13, 以表底层水体高浊度为特征, 光照弱, 不利于初级生产者的生长; 冲淡水边缘: 122°30′E与123°30′E之间, 包含站位14至17; 外海区: 站位18以东的广阔海域。
由图2可见, 可溶性有机碳浓度整体呈现由陆到海逐渐降低的趋势。光谱研究进一步揭示, 表征有色溶解有机物含量水平的吸收系数(355)与盐度呈负相关(图3a), 与大多数河口研究结果相一致[25,34-36], 说明可溶性有机质中荧光组分在河口的分布主要受稀释作用调控[19,37,38]。8站位有色溶解有机物出现异常高值, 可能是由于8站位位于冲淡水与浑浊带的交汇处, 水动力较强, 强烈的再悬浮作用可以使海底表层沉积物释放含有高浓度类腐殖质荧光组分的间隙水, 增加水体中类腐殖质含量[39]。(355)与可溶性有机碳浓度同样具有显著的正相关关系(<0.01)。由于同等可溶性有机碳浓度下, 浑浊带水体(包括边缘站位8)具有更高的(355)值, 因此, 在不考虑最大浑浊带的情况下, 发现可溶性有机碳与(355)线性拟合程度更高(图3b)。浑浊带区水体具有更高(355)值的一个主要原因是浑浊带强的混合作用使海底表层沉积物再悬浮释放有色溶解有机物至表层水中, 从而造成水体有色溶解有机物浓度的升高[40-41]。另一方面, 有研究揭示, 在浑浊带区颗粒态有机物(POM)可以通过解吸作用释放可溶性有机质[39],同时, 颗粒态有机物和絮凝体的光降解作用也可以产生有色溶解有机物[42-44], 最终导致浑浊带水体有色溶解有机物含量水平异常升高。
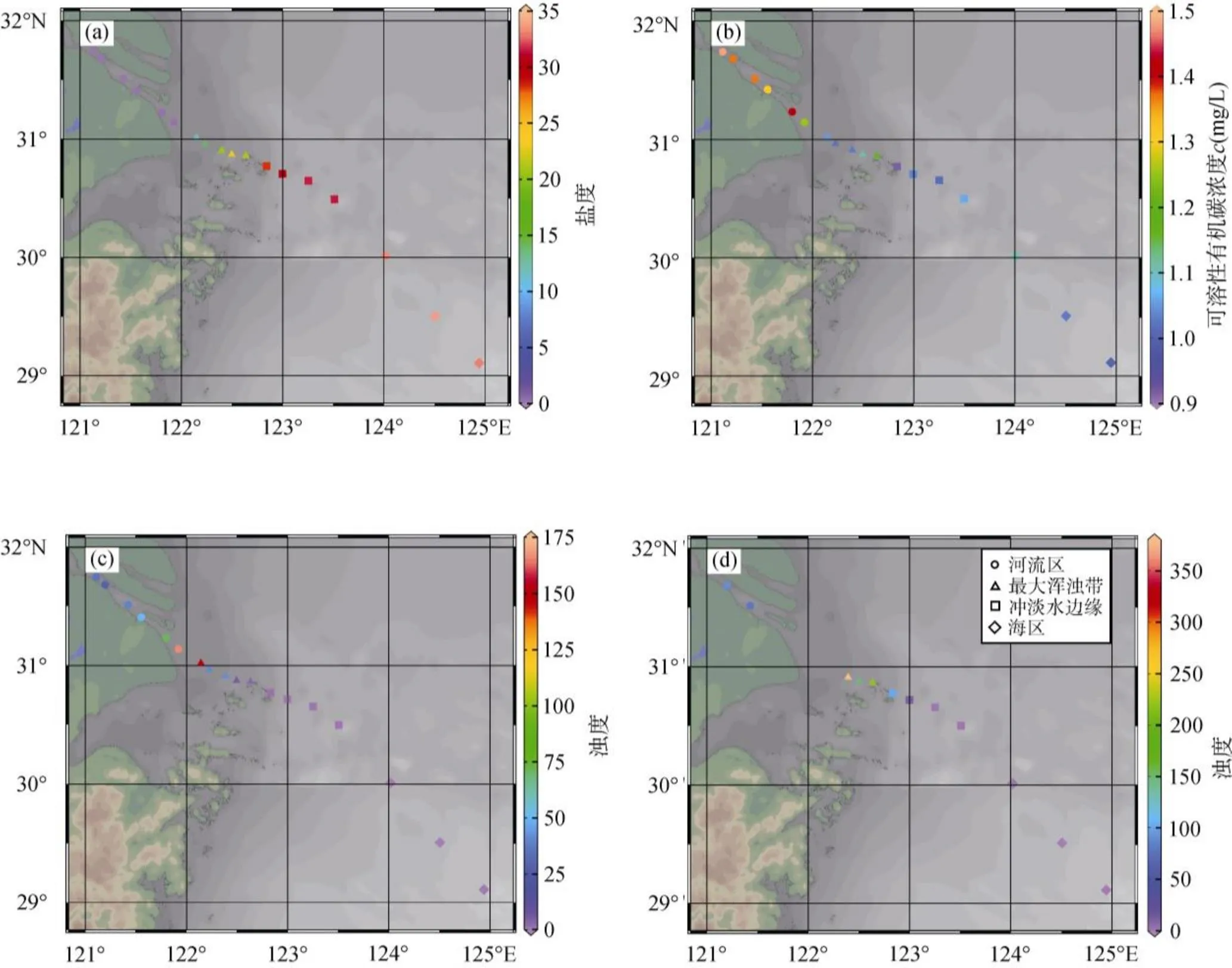
图2 YE断面表层盐度(a)、表层可溶性有机碳浓度(b)、表底层浊度(c、d)平面分布图
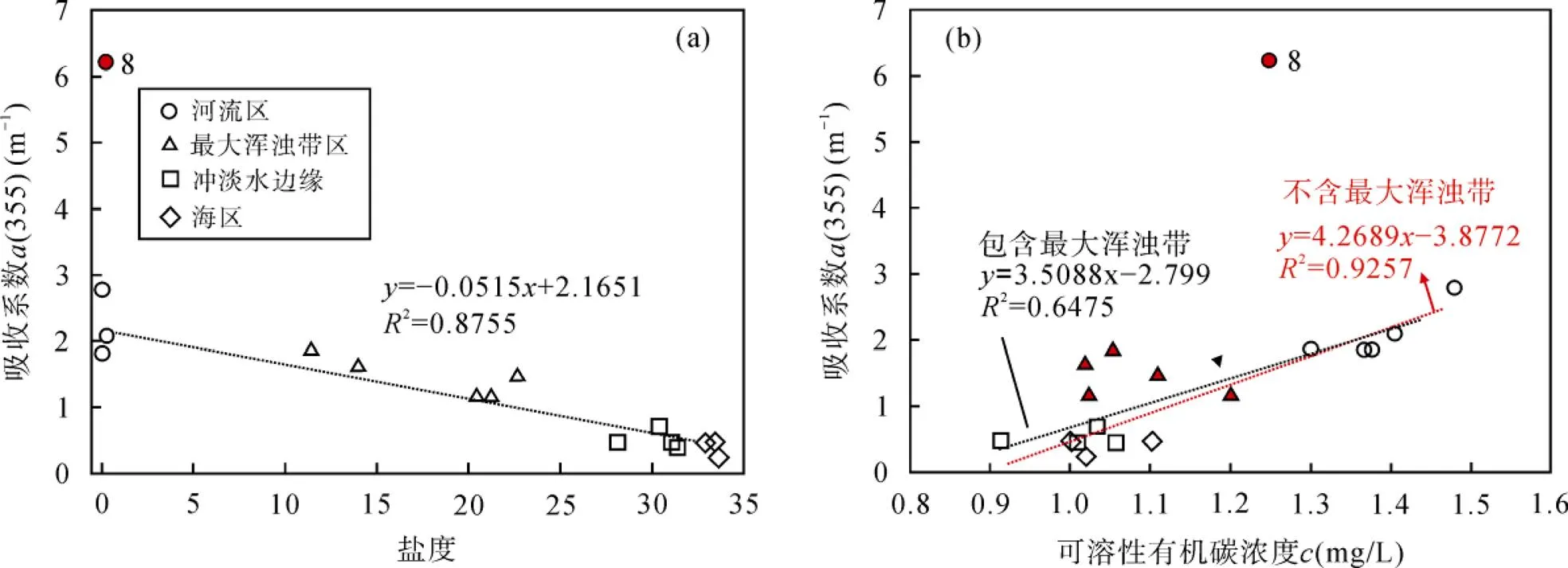
图3 吸收系数a(355)与盐度(a)、可溶性有机碳浓度(b)的关系图(站位8未计入统计)
2.2 水体可溶有机质有色溶解有机物的荧光组分特征、空间展布及其生源指示
利用PARAFAC鉴定出长江口表层水样品荧光可溶性有机质(FDOM)的4个荧光组分C1、C2、C3和C4(图4, 表1)。通过与文献比对, 并根据长江口水体实际背景, 确定C1为类色氨酸, 主要代表原地生产力, 该荧光信号在海洋样品中往往占主导地位[45-47]; C2和C3代表陆源类腐殖质生源, 其中C2主要与高营养水体或废水有关[45,48,49]。而C3的来源则比较广泛, 在生物活动较强的环境中较普遍[50], 如酵母细菌能够产生与它相似的组分[51], 废水中也发现过它的存在[52]; C4为类络氨酸, 其来源广泛, 可以是生物活动, 陆源输入, 也可以是人类活动产生[49]。长江口位于繁华的上海市, 大量的工业、生活废水都有可能成为长江口水体有机质的潜在源, 尽管有严格的管理存在。已经有研究人类活动所产生的类蛋白质组分是长江口水体陆源可溶性有机碳的重要组成部分之一[28]。
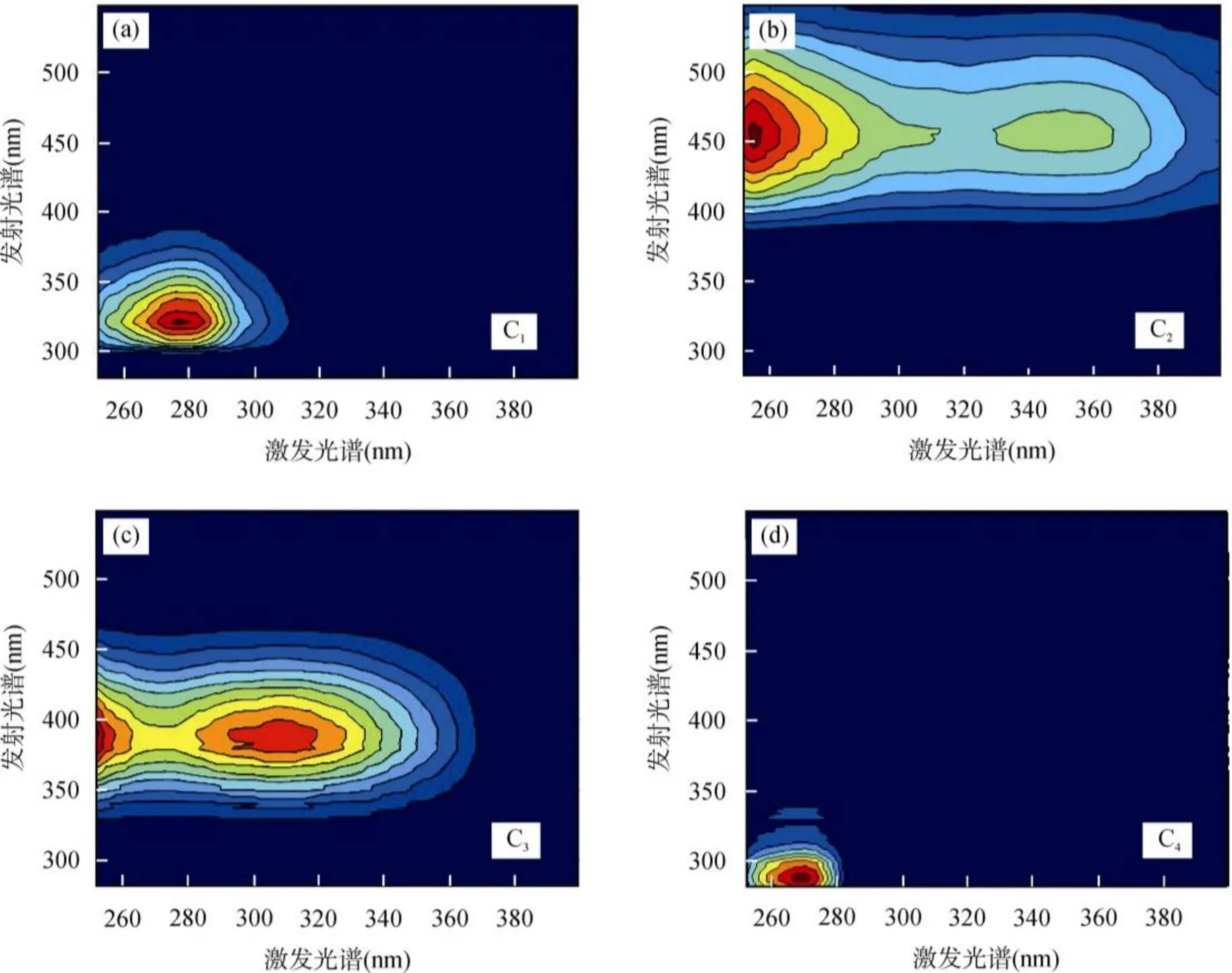
图4 PARAFAC鉴别出的长江口4个荧光有机质荧光组分
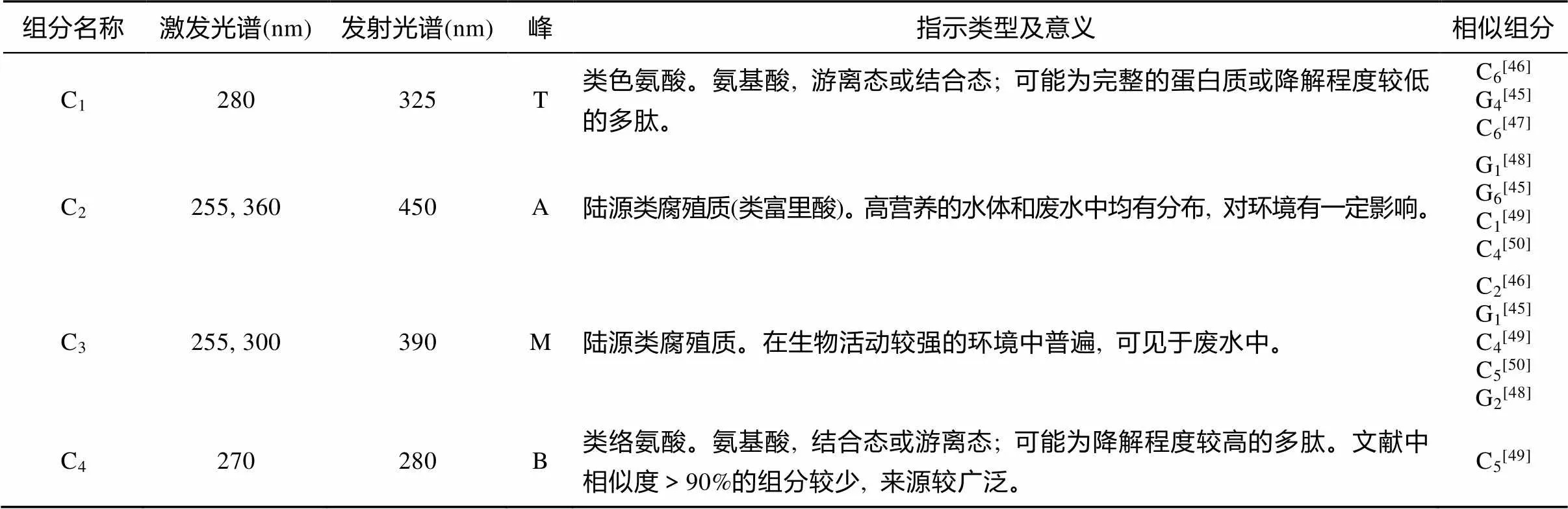
表1 PARAFAC鉴别出的长江口4个荧光有机质荧光组分及其特征
注: T-类蛋白质(色氨酸)峰; A-类腐殖质峰; M-类腐殖质峰; B-类蛋白质峰(络氨酸)。
由图5a可见, 由河口, 经最大浑浊带至外海, 表层水体荧光有机质荧光组分呈现规律性变化。代表原地生产力的荧光组分C1绝对含量表现为先稳定-快速上升-快速下降-再稳定的过程。快速上升和快速下降过程主要与河口最大浑浊带的水动力过程有关。河流入海处由于强的水动力条件, 虽然富含营养盐, 但不利于藻类等水生生物繁育, 原地生产力基本稳定[53-56]。远离河口又未至最大浑浊带区域内水动力减弱(站位5、7、8和9), 河流带来丰富的营养物质, 促使初级生产力快速提升, 在物理-生物化学作用下释放大量的可溶性有机质[57]。至最大浑浊带, 由于光的限制降低了初级生产力, 使得补给速率小于移除速率[58-60], 其浓度出现断崖式下降。到YE-17站位以东水体环境再次处于平衡, 生产力渐稳定。这种由于水动力条件改变引起的生产力动态过程较好的在荧光组分C1上得到了体现, 同时也体现在可溶性有机碳的碳同位素组成上。与站位1、2和4相比, 站位5、7和8虽然盐度均接近于0, 但由于藻类贡献增加, 可溶性有机碳显著富集13C(图6), 这是由于与陆源有机质相比, 海洋藻类生源有机质往往富集13C所致[3,61-63]。代表陆源类腐殖质生源的C2和C3组分则在河口与最大浑浊带的缓冲区稍有富集, 然后呈现急剧下降趋势, 至外海达到一个相对稳定的含量水平, 这也证实了海水稀释的调控作用。荧光组分C4沿整个断面并未发生显著变化, 可能来自于难降解的海洋自生源[48-49], 这一点在荧光组分相对强度中得到了更好的证实(图5b)。与绝对含量不同, 各组分相对含量沿断面至外海, 典型地表现为表征陆源类腐殖质生源的C2和C3组分相对含量减少, 而表征海洋藻类生产力的C1组分及其难降解组分的C4, 尤其以C4组分显著富集为特征, C1组分只是略有富集。这说明在由陆到海的过程中, C4组分和表征海洋藻类生产力的C1组分在有色溶解有机物中占的比例越来越多, 而陆源信号则呈现出逐渐降低的趋势,13C值也同样呈现出富13C的海源信号(图6)。
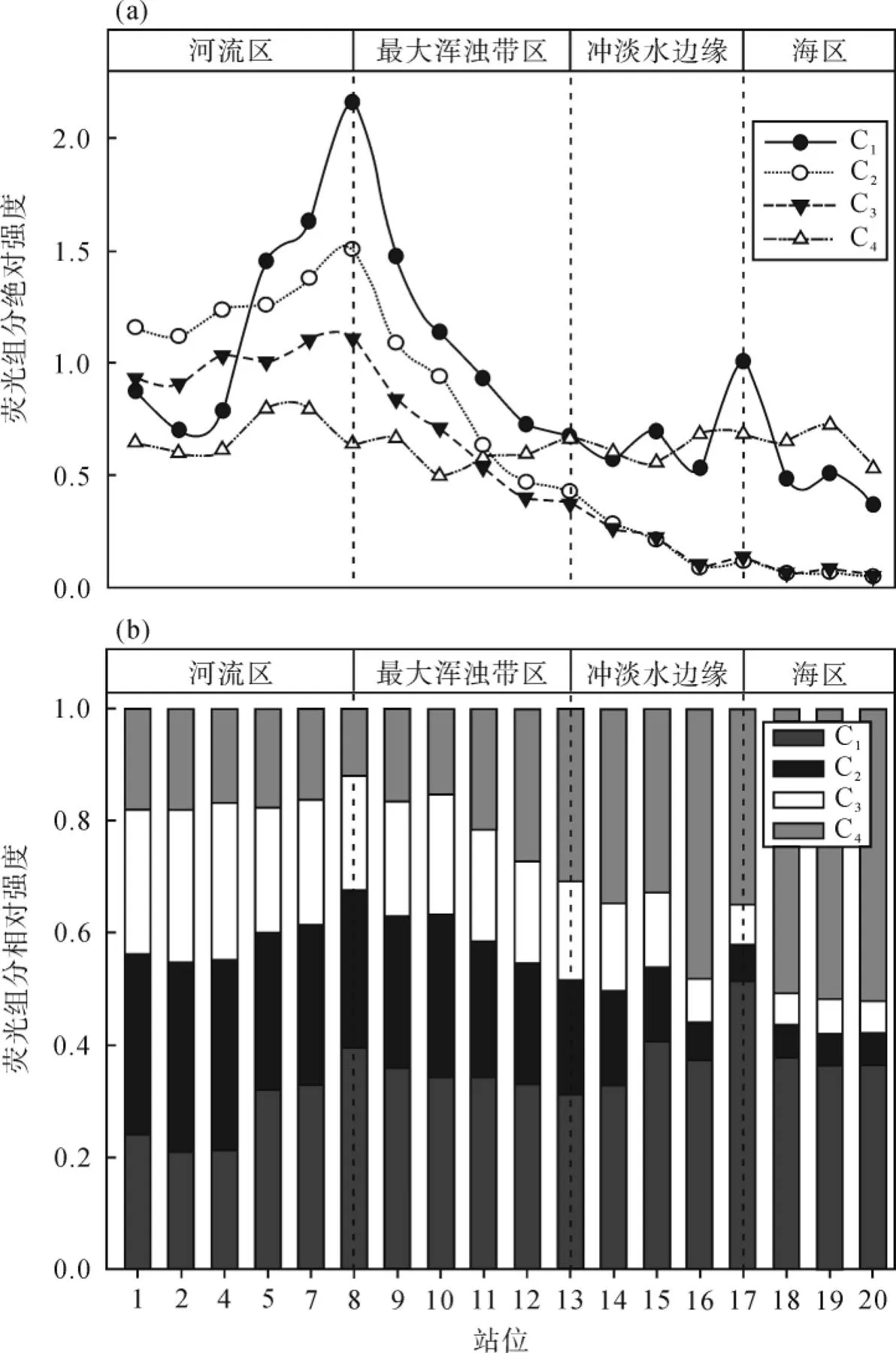
图5 荧光组分绝对强度(a)和相对强度(b)站位分布图
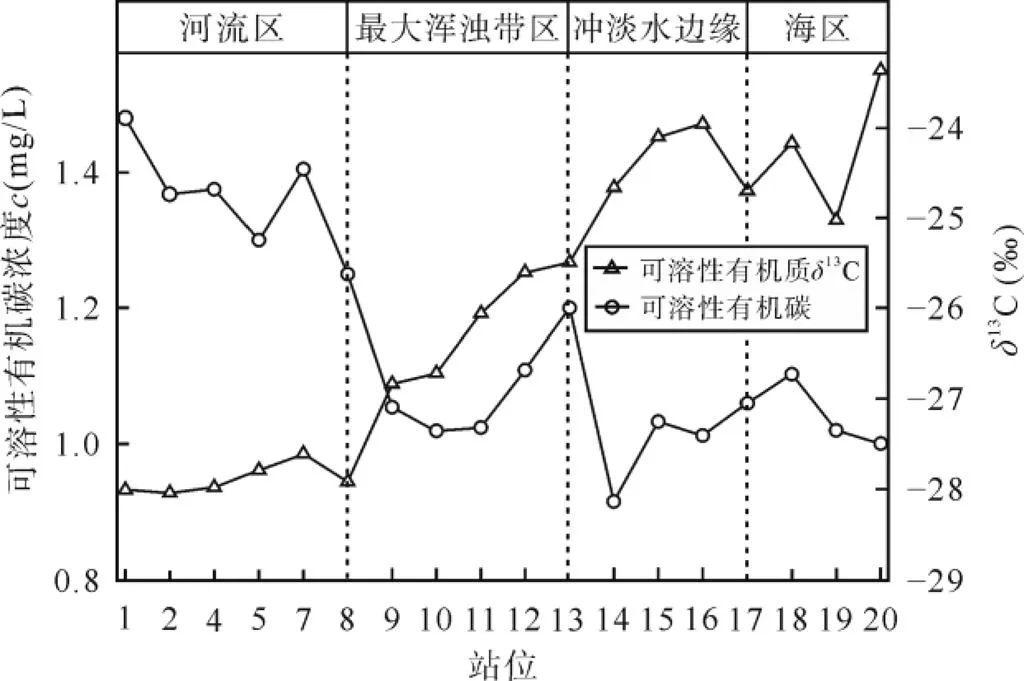
图6 固相萃取所得可溶性有机质δ13C和可溶性有机碳浓度随站位分布图
通过光谱斜率275-295和350-400的比值获得的斜率比S通常用来区分有色溶解有机物的来源。研究表明, 陆源有色溶解有机物平均相对分子质量较大, 所以S值较低, 而海源有色溶解有机物拥有较低的平均相对分子质量,S值较高[29]。Stedmon.[64]研究揭示, 在保守混合情况下, 斜率比S与盐度存在指数关系。由图7所示,S在长江口的分布从近岸到远岸, 沿着保守混合趋势逐渐增大(图7), 说明近岸陆源输入对于S的值具有调控作用, 远岸陆源输入势力减弱, 微生物降解能力增强, 陆源带来的腐殖化程度较高的有机质减少, 引起S值增大。值得一提的是, 河口至最大浑浊带区域S值存在脱离于保守混合线的显著增高过程, 而后回落至水舌边缘再次快速升高, 与荧光组分C1的动态过程相一致, 再次证实了藻类生产力沿断面的动态过程。相应地, 可溶性有机质碳同位素值由陆到海总体呈富13C趋势(图6), 说明海洋自生源产生的可溶性有机碳越来越占主导地位。
2.3 水体可溶有机质在长江口的混合行为
普遍认为, 在不考虑光降解、溶解态与颗粒态相互转化、其他影响可溶性有机质性质和浓度变化的情况下, 河流和海水两端元混合后水体可溶性有机碳与盐度呈线性关系, 属于保守性行为[5]。本研究中1站位盐度为0.12, 可以作为河流端元, 19站位盐度为33.63, 是此次采样站位获得的最高盐度, 作为海水端元值, 根据每个站位的盐度值计算出咸、淡水的混合比例[4], 可以生成可溶性有机碳保守混合理论线(图8)。实际样品可溶性有机碳浓度若高于该线, 表示存在可溶性有机碳的添加过程, 反之, 若低于该线, 则反映可溶性有机碳的移除过程。由图8可见, 在最大浑浊带核心区(9、10和11), 可溶性有机碳浓度明显低于理论线, 可能指示在两端元的混合过程中, 部分可溶性有机碳被选择性移除。相对而言, 其他区域水体可溶性有机碳保守性比较强。虽然可溶性有机碳与盐度的关系, 可以大致说明可溶性有机碳的行为保守与否, 但是这种关系只能说明可溶性有机碳量的变化, 无法从源上区分可溶性有机碳的变化。因此, 本研究依据同位素质量守恒的原理, 选用Raymond.[65]提出的双端元保守混合模型, 通过碳同位素值的变化来辨别可溶性有机碳的来源。13C保守混合值的计算公式如下。
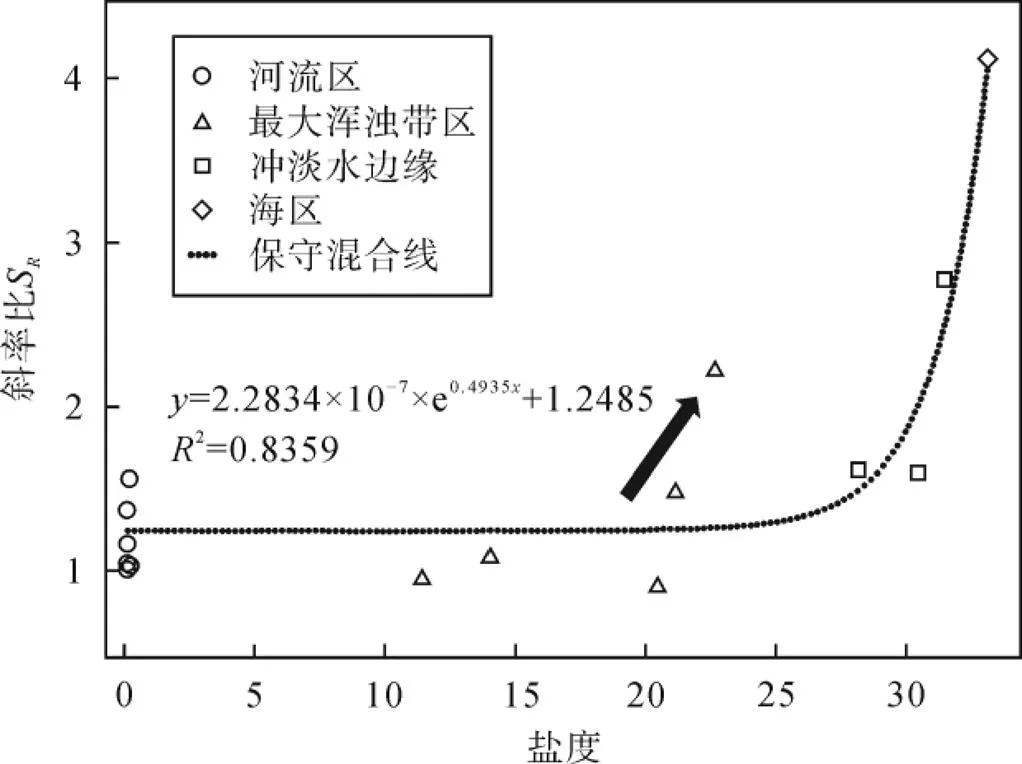
图7 斜率比SR与盐度的关系
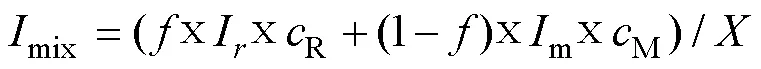
式中,代表河流混合比例; (1−)代表海水混合比例;R代表河流可溶性有机碳浓度(以1站位可溶性有机碳浓度代替);M代表海水可溶性有机碳浓度(以19站位可溶性有机碳浓度代替);mix代表河水和海水不同比例混合后碳同位素的计算结果,r代表河流末端成员同位素组成;m代表海洋末端成员同位素组成;代表保守混合时可溶性有机碳的理论值。
由图8可见, 虽然在河流区盐度变化微弱, 但是由于光-微生物的降解作用[11], 可溶性有机碳的浓度有所降低, 并在河流区和最大浑浊带的分界处, 由于咸淡水的混合稀释作用, 出现断崖式的降低趋势。同时, 由于水动力条件控制的生源分布情况, 初级生产力的贡献使得13C在5、7和8站位富集(上文已讨论)。及至最大浑浊带, 随着盐度的增加,13C值逐渐升高, 海源可溶性有机碳逐渐占据主导地位。值得注意的是, 在最大浑浊带实际碳同位素值与理论曲线吻合度较高, 说明在最大浑浊带区, 可溶性有机碳浓度的下降以物理过程为主, 由海水稀释和可溶性有机碳絮凝沉降过程共同支配。
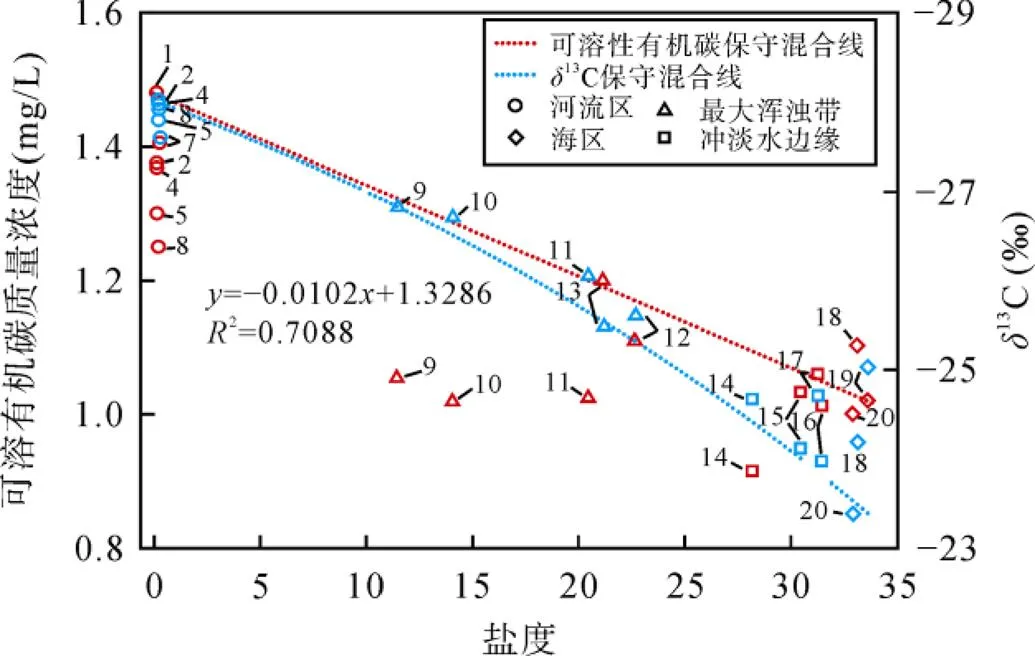
图8 可溶性有机碳浓度和固相萃取有机质δ13C随盐度分布图
3 结 论
(1) 水动力条件是控制长江口-东海陆架系统可溶性有机碳分布的主要因素之一。在河口之外的海域, 可溶性有机碳浓度随着采样站位的离岸距离呈现明显降低的趋势, 而碳同位素值表现为富13C趋势, 指示陆源可溶性有机碳相对贡献减少, 海源可溶性有机碳贡献增加,S值从陆到海逐渐升高, 反映可溶性有机质生源由陆源向海源藻类的演变。
(2) 在最大浑浊带区, 河流-海水两端元横向混合剧烈, 可溶性有机碳浓度明显低于理论值, 说明最大浑浊带对可溶性有机碳有去除作用。从荧光组分的分布特征来看, 陆源类腐殖质组分C2、C3和类蛋白质组分C1在该区域均有减小的现象, 并与盐度呈现较好的保守关系, 说明陆源有机质的减少以海水稀释的物理过程为主, 并得到碳同位素数据的支持。
(3) 长江口水体可溶性有机质性质主要受控于水体盐度、有机质来源及其所经历的降解程度, 河口区、最大浑浊带、冲淡水边缘带和海域等4个区域水体内可溶性有机质性质存在陆源和海源的差异, 并在最大浑浊带的过滤作用下, 可溶性有机碳浓度出现明显的降低趋势, 说明水动力条件是控制长江口-东海陆架系统可溶性有机质组成和空间分布的重要控制因素。
本次YES航次得到了同济大学海洋地质国家重点实验室的经费支持, 在此表示感谢。同济大学的李超博士和南方科技大学的李朋辉博士分别在采样过程中以及后期三维荧光光谱数据处理中提供了帮助和指导, 在此一并诚谢!匿名专家和胡建芳研究员为此文的发表提出了非常宝贵的意见, 在此表示感谢!
[1] Hedges J I. Global biogeochemical cycles: Progress and problems[J]. Mar Chem, 1992, 39(1): 67-93.
[2] Bade D L, Carpenter S R, Cole J J, Pace M L, Kritzberg E, Van de Bogert M C, Cory R M, McKnight D M. Sources and fates of dissolved organic carbon in lakes as determined by whole-lake carbon isotope additions[J]. Biogeochemistry, 2007, 84(2): 115-129.
[3] Hedges J I. What happens to terrestrial organic matter in the ocean? [J]. Org Geochem, 1997, 27(5/6): 195-212.
[4] Liss P S. Conservative and non-conservative behavior of dissolved constituents during estuarine mixing[M]//Burton J D, Liss P S. Estuarine Chemistry. London: Academic Press, 1976: 93-130.
[5] Wen L, Shiller A, Santschi P H, Gill G. Trace element behavior in Gulf of Mexico estuaries[M]//Bianchi T S, Pennock J R, Twilley R R. Biogeochemistry of Gulf of Mexico Estuaries. New York: Wiley, 1999: 303-346.
[6] 王江涛, 于志刚, 张经. 鸭绿江口溶解有机碳的研究[J]. 中国海洋大学学报(自然科学版), 1998, 40(3): 471-475.
Wang Jiang-tao, Yu Zhi-gang, Zhang Jing. Study on dissolved organic carbon in the Estuary of the Yalujiang River[J]. Period Ocean Univ China (Nat Sci Ed), 1998, 40(3): 471-475 (in Chinese with English abstract).
[7] Benner R, Opsahl S. Molecular indicators of the sources and transformations of dissolved organic matter in the Mississippi river plume[J]. Org Geochem, 2001, 32(4): 597-611.
[8] Abril G, Nogueira M, Etcheber H, Cabecadas G, Lemaire E, Brogueira M J. Behaviour of organic carbon in nine contrastingeuropean estuaries[J]. Estuarine Coastal Shelf Sci, 2002, 54(2): 241-262.
[9] 张向上. 黄河口有机碳的时空分布及影响因素研究[D]. 青岛: 中国海洋大学, 2004.
Zhang Xiang-shang. Temporal and spatial distribution of organic carbon and its influence aspects In Huanghe Estuary[D]. Qingdao: Ocean University of China, 2004 (in Chinese with English abstract).
[10] Yang F, Huang Q H, Li J H, Zhu X M. Chracterization of chromophoric dissolved organic matter in the Yangtze Estuary by absoption and fluorescence spectroscopy[J]. J Environ Sci Sustain Soc, 2007, 1(1): 55-60.
[11] Medeiros P M, Seidel M, Ward N D, Carpenter E J, Gomes H R, Niggemann J, Krusche A V, Yager P L, Dittmar T. Fate of the Amazon River dissolved organic matter in the tropical Atlantic Ocean[J]. Global Biogeochem Cycle, 2015, 29(5): 677-690.
[12] Álvarez-Salgado X A, Miller A E J. Dissolved organic carbon in a large macrotidal estuary (the Humber, UK): Behaviour during estuarine mixing[J]. Mar Pollut Bull, 1999, 37(3/7): 216-224.
[13] Cauwet G. Carbon inputs and biogeochemical processes at the halocline in a stratified estuary: Krka River, Yugoslavia[J]. Mar Chem, 1991, 32(2/4): 269-283.
[14] Callahan J, Dai M H, Chen R F, Li X L, Lu Z M, Huang W. Distribution of dissolved organic matter in the Pearl River Estuary, China[J]. Mar Chem, 2004, 89(1/4): 211-224.
[15] Zhang J, Liu S M, Ren J L, Wu Y, Zhang G L. Nutrient gradients from the eutrophic Changjiang (Yangtze river) Estuary to the oligotrophic Kuroshio waters and re-evaluation of budgets for the East China Sea Shelf[J]. Prog Oceanogr, 2007, 74(4): 449-478.
[16] 沈焕庭, 贺松林, 潘定安, 李九发. 长江河口最大浑浊带研究[J]. 地理学报, 1992, 47(5): 472-479. Shen Huan-ting, He Song-lin, Pan Ding-an, Li Jiu-fa. A study of turbidity maximum in the Changjiang Estuary[J]. Geogr J, 1992, 47(5): 472-479 (in Chinese with English abstract).
[17] Ogawa H, Usui T, Koike I. Distribution of dissolved organic carbon in the East China Sea[J]. Deep Sea Res Pt II Topic Stud Oceanogr, 2003, 50(2): 353-366.
[18] 朱伟健, 沈芳, 洪官林. 长江口及邻近海域有色溶解有机物(CDOM)的光学特性[J]. 环境科学, 2010, 31(10): 2292- 2298.
Zhu Wei-jian, Shen Fang, Hong Guan-lin. Optical characteristics of colored dissolved organic material (CDOM) in Yangtze Estuary[J]. Environ Sci, 2010, 31(10): 2292-2298 (in Chinese with English abstract).
[19] 范冠南, 毛志华, 陈鹏, 王天愚, 张琳. 长江口及其邻近海域CDOM光谱吸收特性分析[J]. 海洋学研究, 2013, 31(1): 53-58.
Fan Guan-nan, Mao Zhi-hua, Chen Peng, Wang Tian-yu, Zhang lin. Optical characteristics of colored dissolved organic matter (CDOM) in Changjiang River Estuary[J]. J Mar Sci, 2013, 31(1): 53-58 (in Chinese with English abstract).
[20] 吕丽莎, 赵卫红, 苗辉. 三维荧光结合平行因子分析在东海溶解有机物研究中的应用[J]. 光谱学与光谱分析, 2013, 33(3): 653-658.
Lü Li-sha, Zhao Wei-hong, Miao hui. Application of excitation- emission matrix spectrum combined with parallel factor analysis in dissolved organic matter in East China Sea[J]. Spect Spect Anal, 2013, 33(3): 653-658 (in Chinese with English abstract).
[21] Sun Q Y, Wang C, Wang P F, Hou J, Ao Y H. Absorption and fluorescence characteristics of chromophoric dissolved organic matter in the Yangtze Estuary[J]. Environ Sci Pollut Res Int, 2014, 21(5): 3460-3473.
[22] Li P H, Chen L, Zhang W, Huang Q H. Spatiotemporal distribution, sources, and photobleaching imprint of dissolved organic matter in the Yangtze Estuary and its adjacent sea using fluorescence and parallel factor analysis[J]. Plos One, 2015, 10(6): e0130852.
[23] Guo W D, Stedmon C A, Han Y C, Wu F, Yu X X, Hu M H. The conservative and non-conservative behavior of chromophoric dissolved organic matter in Chinese estuarine waters[J]. Mar Chem, 2007, 107(3): 357-366.
[24] 徐亚宏, 姚鹏, 苏荣国, 赵彬. 长江口盐度梯度下有色溶解有机物的分布、来源与季节变化[J]. 海洋学报, 2017, 39(6): 21-32.
Xu Ya-hong, Yao Peng, Su Rong-guo, Zhao Bin. Distribution, sources, and seasonal variation of colored dissolved organic matter along salinity gradients in the Changjiang Estuary[J]. Acta Oceanol Sinica, 2017, 39(6): 21-32 (in Chinese with English abstract).
[25] Guo W D, Yang L Y, Zhai W D, Chen W Z, Osburn C L, Huang X, Li Y. Runoff‐mediated seasonal oscillation in the dynamics of dissolved organic matter in different branches of a large bifurcated estuary—The Changjiang Estuary[J]. J Geophys Res Biogeosci, 2014, 119(5): 776-793.
[26] Dittmar T, Koch B P, Hertkorn N, Kattner G. A simple and efficient method for the solid‐phase extraction of dissolved organic matter (SPE-DOM) from seawater[J]. Limnol Oceanogr Method, 2008, 6(6): 230-235.
[27] Dong Q Q, Li P H, Huang Q H, Abdelhafez A A, Chen L. Occurrence, polarity and bioavailability of dissolved organic matter in the Huangpu River, China[J]. J Environ Sci, 2014, 26(9): 1843-1850.
[28] Twardowski M S, Boss E, Sullivan J M, Donaghay P L. Modeling the spectral shape of absorption by chromophoric dissolved organic matter[J]. Mar Chem, 2004, 89(1/4): 69-88.
[29] Helms J R, Stubbins A, Ritchie J D, Minor E C. Absorption spectral slopes and slope ratios as indicators of molecular weight, source, and photobleaching of chromophoric dissolved organic matter[J]. Limnol Oceanogr, 2008, 53(3): 955-969.
[30] Bai Y, Su R G, Shi X Y. Assessing the dynamics of chromophoric dissolved organic matter in the southern Yellow Sea by excitation-emission matrix fluorescence and parallel factor analysis (EEM-PARAFAC) [J]. Continent Shelf Res, 2014, 88: 103-116.
[31] Stedmon C A, Markager S, Bro R. Tracing dissolved organic matter in aquatic environments using a new approach to fluorescence spectroscopy[J]. Mar Chem, 2003, 82(3/4): 239-254.
[32] 黄昌春, 李云梅, 王桥, 施坤, 金鑫, 王彦飞. 基于三维荧光和平行因子分析法的太湖水体CDOM组分光学特征[J]. 湖泊科学, 2010, 22(3): 375-382.
Huang Chang-chun, Li Yun-mei, Wang Qiao, Shi Kun, Jin Xin, Wang Yan-fei. Components optical property of CDOM in Lake Taihu based on three-dimensional excitation emission matrix fluorescence[J]. J Lake Sci, 2010, 22(3): 375-382 (in Chinese with English abstract).
[33] 郑琰明, 康建成, 钟巍, 周尚哲, 王芳, 徐韧, 孙瑞文, 吴涛. 2004年夏初、秋末长江口外海区冲淡水及羽状锋的盐度特征[J]. 海洋与湖沼, 2009, 40(3): 275-282.
Zheng Yan-ming, Kang Jian-cheng, Zhong Wei, Zhou Shang-zhe, Wang Fang, Xu Ren, Sun Rui-wen, Wu Tao. Salinity distribution of diluted water and plume front of early summer & later autumn in 2004 off Changjiang (Yangtze) Estuary[J]. Oceanol Limnol Sinica, 2009, 40(3): 275-282 (in Chinese with English abstract).
[34] 王凯敏, 熊学军, 郭炳火, 华锋, 江志辉. 2006-2007年长江冲淡水的扩展形态及季节变化[J]. 海岸工程, 2012, 31(1): 46-54.
Wang Kai-min, Xiong Xue-jun, Guo Bing-huo, Hua Feng, Jiang Zhi-hui. The extension form and seasonal variation of the Changjiang diluted water during 2006-2007[J]. Coast Eng, 2012, 31(1): 46-54 (in Chinese with English abstract).
[35] Hong H S, Wu J Y, Shang S L, Hu C M. Absorption and fluorescence of chromophoric dissolved organic matter in the Pearl River Estuary, South China[J]. Mar Chem, 2005, 97(1/2): 78-89.
[36] Vecchio R D, Blough N V. Spatial and seasonal distribution of chromophoric dissolved organic matter and dissolved organic carbon in the Middle Atlantic Bight[J]. Mar Chem, 2004, 89(1/4): 169-187.
[37] Rochelle-Newall E J, Fisher T R. Chromophoric dissolved organic matter and dissolved organic carbon in Chesapeake Bay[J]. Mar Chem, 2002, 77(1): 23-41.
[38] 潘慧慧, 姚鹏, 赵彬, 孟佳, 李栋, 王金鹏. 基于水淘选分级的长江口最大浑浊带附近颗粒有机碳的来源、分布和保存[J]. 海洋学报, 2015, 37(4): 1-15.
Pan Hui-hui, Yao Peng, Zhao Bin, Meng Jia, Li Dong, Wang Jin-peng. Sources, distribution and preservation of size-fractionated particulate organic carbon in the turbidity maximum zone of the Changjiang Estuary based on water elutriation[J]. Acta Oceanol Sinia, 2015, 37(4): 1-15 (in Chinese with English abstract).
[39] Markager S, Vincent W F. Spectral light attenuation and the absorption of UV and blue light in natural waters[J]. Limnol Oceanogr, 2000, 45(3): 642-650.
[40] Yang L Y, Guo W D, Hong H S, Wang G Z. Non-conservative behaviors of chromophoric dissolved organic matter in a turbid estuary: Roles of multiple biogeochemical processes[J]. Estuarine Coastal Shelf Sci, 2013, 133(4): 285-292.
[41] Bodineau L, Thoumelin G, Béghin V, Wartel M. Particulate organic matter composition in the Estuarine Turbidity Maxima (ETM) of the Seine River estuary[J]. Hydrobiologia, 1998, 373: 281-295.
[42] Wang Y, Zhang D, Shen Z Y, Feng C H, Chen J. Revealing sources and distribution changes of dissolved organic matter (DOM) in pore water of sediment from the Yangtze estuary[J]. Plos One, 2013, 8(10): e76633.
[43] Kieber R J, Whitehead R F, Reid S N, Willey J D, Seaton P J. Chromophoric dissolved organic matter (CDOM) in rainwater, southeastern North Carolina, USA[J]. J Atmos Chem, 2006, 54(1): 21-41.
[44] Mayer L M, Schick L L, Skorko K, Boss E. Photodissolution of particulate organic matter from sediments[J]. Limnol Oceanogr, 2006, 51(2): 1064-1071.
[45] Helms J R, Mao J D, Stubbins A, Schmidt-Rohr K, Spencer R G M, Hernes P J, Mopper K. Loss of optical and molecular indicators of terrigenous dissolved organic matter during long-term photobleaching[J]. Aquat Sci, 2014, 76(3): 353-373.
[46] Yu H R, Liang H, Qu F S, Han Z S, Shao S L, Chang H Q, Li G B. Impact of dataset diversity on accuracy and sensitivity of parallel factor analysis model of dissolved organic matter fluorescence excitation-emission matrix[J]. Sci Rep, 2015, 5: 10207.
[47] Kothawala D N, Stedmon C A, Müller R A, Weyhenmeyer G A, Köhler S J, Tranvik L J. Controls of dissolved organic matter quality: Evidence from a large-scale boreal lake survey[J]. Global Chang Biol, 2014, 20(4): 1101-1114.
[48] Osburn C L, Stedmon C A. Linking the chemical and optical properties of dissolved organic matter in the Baltic-North Sea transition zone to differentiate three allochthonous inputs[J]. Mar Chem, 2011, 126(1/4): 281-294.
[49] Murphy K R, Hambly A, Singh S, Henderson R K, Baker A, Stuetz R, Khan S J. Organic matter fluorescence in municipal water recycling schemes: Toward a unified PARAFAC model[J]. Environ Sci Technol, 2011, 45(7): 2909-2916.
[50] Jørgensen L, Stedmon C A, Kragh T, Markager S, Middelboe M, Søndergaard M. Global trends in the fluorescence characteristics and distribution of marine dissolved organic matter[J]. Mar Chem, 2011, 126(1/4): 139-148.
[51] Nimptsch J, Woelfl S, Osorio S, Valenzuela J, Ebersbach P, von Tuempling W, Palma R, Encina F, Figueroa D, Kamjunke N, Graeber D. Tracing dissolved organic matter (DOM) from land-based aquaculture systems in North Patagonian streams[J]. Sci Total Environ, 2015, 537: 129-138.
[52] Marose S, Lindemann C, Scheper T. Two-dimensional fluorescence spectroscopy: A new tool for on-line bioprocess monitoring[J]. Biotechnol Prog, 2010, 14(1): 63-74.
[53] Stedmon C A, Markager S. Resolving the variability in dissolved organic matter fluorescence in a temperate estuary and its catchment using PARAFAC analysis[J]. Limnol Oceanogr, 2005, 50(2): 686-697.
[54] 顾新根, 袁骐, 沈焕庭, 周月琴. 长江口最大浑浊带浮游植物的生态研究[J]. 中国水产科学, 1995, 2(1): 16-27.
Gu Xin-gen, Yuan Qi, Shen Huan-ting, Zhou Yue-qin. The ecological study on phytoplankton in maximum turbid zone of Changjiang Estuary[J]. J Fish Sci China, 1995, 2(1): 16-27(in Chinese with English abstract).
[55] Ha K, Cho E A, Kim H W, Joo G J. Microcystis bloom formation in the lower Nakdong River, South Korea: Importance of hydrodynamics and nutrient loading[J]. Mar Freshwater Res, 1999, 50(1): 89-94.
[56] Mitrovic S M, Chessman B C, Davie A, Avery E L, Ryan N. Development of blooms ofandspp. (Bacillariophyceae) in a shallow river and estimation of effective suppression flows[J]. Hydrobiologia, 2008, 596(1): 173-185.
[57] 蔡卓平, 段璐洋, 肖群, 段舜山. 风浪扰动促进中肋骨条藻和球形棕囊藻增殖的模拟研究[J]. 海洋环境科学, 2011, 30(4): 473-476.
Cai Zhuo-ping, Duan Lu-yang, Xiao Qun, Duan Shun-shan. Simulation study on promoted proliferation of Skeletonema costatum and Phaeocystis globose disturbed by wave[J]. Mar Environ Sci, 2011, 30(4): 473-476(in Chinese with English abstract).
[58] Biddanda B, Benner R. Carbon, nitrogen, and carbohydrate fluxes during the production of particulate and dissolved organic matter by marine phytoplankton[J]. Limnol Oceanogr, 1997, 42(3): 506-518.
[59] 沈志良. 长江口海区理化环境对初级生产力的影响[J]. 海洋湖沼通报, 1993, 15(1): 47-51.
Shen Zhi-liang. The effects of the physic-chemical environment on the primary productivity in the Yangtze River Estuary[J]. Transact Oceanol Limnol, 1993, 15(1): 47-51(in Chinese with English abstract).
[60] Wienke S M, Cloern J E. The phytoplankton component of seston in San Francisco Bay[J]. Netherland J Sea Res, 1987, 21(1): 25-33.
[61] 黄小平, 黄良民. 河口最大浑浊带浮游植物生态动力过程研究进展[J]. 生态学报, 2002, 22(9): 1527-1533.
Huang Xiao-ping, Huang Liang-min. Progress in researches on dynamical processes of phytoplankton ecology in maximum turbidity zone of estuary[J]. Acta Ecol Sinica, 2002, 22(9): 1527-1533(in Chinese with English abstract).
[62] Fry B, Sherr E B.13C measurements as indicators of carbon flow in marine and freshwater ecosystems[M]. Rundel P W, Ehleringer J R, Nagy K A. Stable Isotopes in Ecological Research. Berlin: Springer, 1984: 196-229.
[63] Lamb A L, Wilson G P, Leng M J. A review of coastal palaeoclimate and relative sea-level reconstructions using13C and C/N ratios in organic material[J]. Earth Sci Rev, 2006, 75(1/4): 29-57.
[64] Stedmon C A, Markager S. Behaviour of the optical properties of coloured dissolved organic matter under conservative mixing[J]. Estuarine Coastal Shelf Sci, 2003, 57(5/6): 973- 979.
[65] Raymond P A, Bauer J E. Use of14C and13C natural abundances for evaluating riverine, estuarine, and coastal DOC and POC sources and cycling: A review and synthesis[J]. Org Geochem, 2001, 32(4): 469-485.
Spatial distribution and controlling factors of dissolved organic matter composition in the Yangtze Estuary in summer
WANG An-yue1, ZHANG Kai1, HE Ding1, FAN Dai-du2and SUN Yong-ge1*
1. Organic Geochemistry Unit, School of Earth Sciences, Zhejiang University, Hangzhou 310027, China; 2. State Key Laboratory of Marine Geology, Tongji University, Shanghai 200092, China
In this study, the composition, source, spatial distribution, and mixing behavior of dissolved organic matter (DOM) in the Yangtze Estuary in summer were systematically determined using the measured absorption spectra of chromophoric dissolved organic matter (CDOM), Excitation-Emission-Matrix spectra (EEMs) of fluorescence dissolved organic matter (FDOM) and stable carbon isotope compositions. The results show that the dissolved organic carbon (DOC) concentration decreases gradually from land to sea. The absorption coefficient(355), which indicates the concentration of CDOM, is negatively correlated with salinity, indicating that the distribution of CDOM is primarily controlled by dilution. EEMs and parallel factor analysis (PARAFAC) were used to identify the two fluorescent components C2and C3representing terrestrial organic matter and two protein-like fluorescent components C1and C4representing in-situ productivity. From nearshore to offshore, the proportion of C1, which represents the productivity of marine algae, increased in fluorescent organic matter, whereas the land-source signal gradually decreased. Correspondingly, the DOM in offshore waters exhibited steep spectral slope S275-295and S350-400ratios and heavy carbon isotopes. Based on the river-ocean two-terminal mixing model of salinity vs DOC concentration and salinity.13C value, we determined that the DOC removal process occurs in the maximum turbidity zone of the Yangtze Estuary, which is characterized by a lack of non-conservative mixing behavior dominated by physical dilution. The results reveal that hydrodynamic conditions are the key factors controlling the composition and spatial distribution of DOM in the Yangtze Estuary-East China Sea shelf system.
dissolved organic matter; carbon isotope; mixing behavior; EEMs-PARAFAC; Yangtze Estuary
P593; P66
A
0379-1726(2021)03-0317-12
10.19700/j.0379-1726.2021.03.009
2019-10-11;
2019-11-30;
2019-12-02
国家自然科学基金(41973070, 41773098)
王安月(1994-), 女, 硕士研究生, 地球化学专业。E-mail: 1104681767@qq.com
Corresponding author): SUN Yong-ge, E-mail: ygsun@zju.edu.cn; Tel: +86-571-87951336

