溶血磷脂酸受体1-3在牦牛不同时期卵巢中表达定位
张燕燕,王靖雷,潘阳阳,马文斌,高丽青,张 辉,李心蕊,余四九,徐庚全
(甘肃农业大学动物医学院/甘肃省牛羊胚胎工程技术研究中心,甘肃兰州 730070)
溶血磷脂酸(lysophosphatidic acid,LPA)的化学名称为1-脂酰甘油-3-磷酸酯,是一种最简单的小分子甘油磷脂,同时也是最有效的水溶性脂质信号分子之一。到目前为止,已经表明LPA既可以作为磷脂合成的中间体在细胞内合成,也可以在细胞外作为细胞间信号分子合成[1]。已在各种生物体液中检测到LPA的存在,如人和牛血清和血浆、人唾液、腹水、卵泡液、大鼠精浆、牛子宫内膜和卵巢黄体细胞[2],以及人卵巢和宫颈癌细胞。LPA是脂源性G-蛋白藕联受体(G-protein-coupled receptor,GPCR)的激动剂,能促进细胞增殖和分化以及提高细胞与细胞间的相互作用[3],参与细胞骨架的重新分布以及肿瘤形成和侵袭等多种病理生理过程。
LPA生物学作用至少由6种高亲和力跨膜G蛋白偶联受体LPAR1-LPAR6诱导其活性[4],可能通过核过氧化物酶体增殖物激活受体G[1]。这些膜受体由不同的基因编码,在人类和小鼠中分为LPAR1-6和Lpar1-6[5]。LPAR在人、牛、羊、猪和啮齿动物等物种之间显示出高度的同源性。LPA在人体血清中的浓度10 mmol/L~15 mmol/L[6],远远超过激活LPAR1-5所需的表观纳米分子Kd值[5],提示LPARs在生理功能中的重要性。还有研究发现,LPAR在子宫内膜中的表达受类固醇激素的调节,包括孕酮(progesterone,P4)和雌二醇(estradiol,E2)[7-8]。对卵巢摘除小鼠的研究表明,P4促进了LPAR3的表达,而雌激素则抵消了P4的影响[8]。作者推测P4和E2共同调节LPAR3的表达,有助于早孕子宫内膜的容受性。在牛的卵丘细胞中也发现了类似的LPAR1-4转录本丰度,而在卵母细胞中,LPAR2的表达高于其他3个LPARs[9]。在绵羊中,Liszewska E等[10]发现LPAR1-3转录本在妊娠早期胚胎的滋养外胚层提取物中表达。此外,Van Meeteren L A等[11]在小鼠移植后的第6.5天到第10.5天胚胎发育过程中发现4个LPAR的mRNA表达。LPAR通过在器官和组织中的不同分布以及与不同的异三聚体G蛋白的结合,能够激活不同的下游信号通路,从而引起基因调控和LPA诱导的细胞功能的改变[7]。上述研究表明,LPAR在许多哺乳动物生殖生理过程中发挥着重要的作用,但在牦牛上还未见报道。
牦牛(Bosgrunniens)主要栖息地具有高寒、缺氧、高辐射和植物生长季节短的环境特征[12],是高原畜牧业的主要畜种,也是我国高寒牧区的主要经济来源。但是因其生长发育缓慢,繁殖性能低,是制约当前牦牛业发展的重要原因。因此,探究LPA受体在雌性牦牛生殖中的作用,在提高牦牛生产效率和经济效益,促进牦牛产业发展具有重要意义。本试验以牦牛不同发情时期卵巢为材料,利用RT-qPCR、蛋白质免疫印迹(Western blot)、免疫组织化学(Immunohistochemistry,IHC)等方法检测牦牛生殖系统中LPAR1、LPAR2、LPAR3的表达及定位,可为进一步研究牦牛生殖生理提供理论依据。
1 材料与方法
1.1 材料
1.1.1 试剂 DAB显色液、显/定影液、BeyoEcLPLus液,Beyotime公司产品; Tranzol试剂,北京全式金生物技术有限公司产品;TaqPCR Master Mix、Go ScriptTMReverse Transcription System、Wizard©SVd Gel and PCR Clean-Up System,美国Promega公司产品;TB Green©Premix ExTaqTM Ⅱ,宝生物工程(大连)有限公司产品;4×蛋白上样缓冲液、Western blot所用试剂,索莱宝(北京)有限公司产品、HistostainTM-Plus Kits、Goat Anti-Rab-bit IgG/HRP antibody,Rabbit Anti-LPA1-3 Polyclonal Antibody,北京Bioss公司产品。
1.1.2 主要仪器 PCR仪(eppendorf),德国艾本德公司;实时荧光定量PCR仪(LightCycler©96 SW 1.1),瑞士Loch1公司产品;阳离子防脱片,北京中杉金桥生物技术有限公司产品;显微镜(DP71),日本Olympus公司产品。
1.1.3 样品 2019年11月采自青海省西宁市百德屠宰场,选年龄相近,处于不同繁殖时期(卵泡期,黄体期和妊娠期)的健康成年雌性牦牛(Bosgrunniens)各3头。
1.2 方法
1.2.1 样品采集 牦牛处死后,采集卵泡期(卵巢上见成熟卵泡)、黄体期(见新鲜黄体)同侧,以及妊娠期(见胚胎存在)妊娠侧的卵巢,将采集到的样品修剪后用9 g/L的生理盐水冲洗干净,分成2份,1份液氮保存后送回实验室,于-80 ℃条件储存备用。另1份样品修剪至约1 cm3大小后,于40 mg/mL多聚甲醛溶液中带回实验室,常温保存备用。
1.2.2 RT-qPCR检测LPAR1-3基因的表达
1.2.2.1 牦牛不同时期卵巢总RNA提取 参照Trizol试剂盒其说明书将牦牛不同时期卵巢(卵泡期、黄体期、妊娠期)低温研磨后提取总RNA,利用分光光度计测定RNA浓度和OD260/OD280值,两步法反转录(Go ScriptT M Reverse Tran-scription Syatem,Promega)合成cDNA,置-20℃保存备用。
1.2.2.2LPAR1-3基因相对表达量检测 根据GenBank公布的普通牛LPAR1、LPAR2、LPAR3基因编码区,在NCBI Primer-Blast中设计,试验选择β-actin(肌动蛋白)为内参基因,本试验所涉及引物均由生工生物工程(上海)有限公司合成,具体引物信息见表1。

表1 目的基因和内参基因引物序列
利用实时荧光定量PCR检测LPAR1、LPAR2、LPAR3基因在牦牛不同时期卵巢中的表达情况。PCR总反应体系20 μL:TB Green©Premix ExTaqTMⅡ 10μL,无菌去离子水6.4 μL,cDNA(500 ng/μL) 2 μL,上、下游引物(10 μmol/L)各0.8 μL。反应条件:95 ℃预变性30 s;95℃ 5s,60 ℃ 30 s,72 ℃ 10 s,共40个循环。LightCycler/LightCy-cler480 System(Roche Diagnostics,德国),每组重复4次(n=4)。根据实时荧光定量熔解曲线判断引物特异性,根据每个样品的Cq值,经2-ΔΔCq计算LPAR1、LPAR2、LPAR3基因在牦牛不同时期卵巢中的相对表达量。
1.2.3 Western blot检测LPAR1-3蛋白的表达
1.2.3.1 制备牦牛组织蛋白质样品 将牦牛不同时期卵巢组织样品低温研磨碎后,称取一定量加入蛋白裂解液(按裂解液(radio immunoprecipita-tion assa,RIPA)∶蛋白酶抑制剂(phenylmethanesul-fonyl fluoride,PMSF)= 100∶1配制)冰上反应,待组织充分裂解后 4 ℃、12 000 r/min离心5 min,吸出上清液,置-80 ℃保存备用。
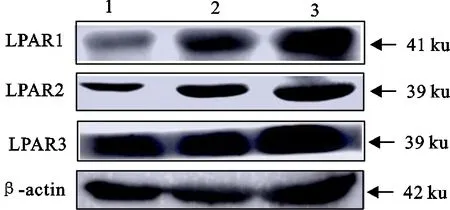
1.2.3.2 Western blot 将蛋白样品与4×蛋白上样缓冲液按3∶1混合,100 ℃ 10 min金属浴变性后-20 ℃保存用于后续试验。SDS-PAGE凝胶电泳,LPAR1、LPAR3配制80 g/L分离胶和50 g/L浓缩胶,LPAR2配制100 g/L和50 g/L浓缩胶,变性蛋白经电泳分离后,根据LPAR蛋白大小(LPAR1:41 ku,LPAR2:39 ku,LPAR3:39 ku)切胶,转至PVDF膜(polyvinylidene fluoride)上,LPAR1在4 ℃的冰箱用50 g/L脱脂奶粉封闭7 h;LPAR2在常温用50 g/L脱脂奶粉封闭2 h;LPAR3在4 ℃的冰箱用50 g/L脱脂奶粉封闭过夜(12 h);一抗Rabbit Anti-LPA1 Polyclonal Antibody (1∶600稀释)中4 ℃孵育过夜;一抗Rabbit Anti-LPA2 Polyclonal Antibody (1∶1 000稀释)中4 ℃孵育过夜;一抗Rabbit Anti-LPA3 Polyclonal Antibody (1∶1 200稀释)中4 ℃孵育过夜,PBST(磷酸盐缓冲液(PBS)+Tween 20)浸洗30 min后,二抗Goat Anti-Rabbit IgG/HRP antibody (1∶1 000稀释)中室温孵育40 min;PBST浸洗膜3次,每次20 min。在膜上滴加电化学发光液(elec-tro-chemi- luminescence,ECL),GEAI600成像系统扫描目的条带,利用Image J分析灰度值,计算蛋白相对表达量(目的灰度数值/内参灰度数值)。
1.2.4 免疫组化法对LPA受体蛋白分布进行定位 选取用固定后的卵巢组织块,上行酒精脱水,石蜡包埋,切片,下行脱蜡后进行抗原修复,在柠檬酸盐缓冲液中热诱导,高火煮沸后转中火10 min,室温自然冷却。参照Histostai TM-Plus Kits试剂盒说明,滴加30 mL/L H2O2阻断内源性过氧化物酶活性,37 ℃作用10 min;将组织周围擦干后滴加封闭液(A液)减少非特异性背景,室温湿盒孵育15 min;滴加一抗Rabbit Anti-LPA1-3 Polyclonal Antibody (1∶500稀释),添加对照组(PBS代替一抗),4 ℃湿盒孵育过夜;滴加二抗(B液),37 ℃湿盒孵育10 min;滴加C液,37 ℃温箱湿盒孵育15 min;加二氨基联苯胺显色液(diaminob-enzidine,DAB)显色,苏木精复染90 s、脱水、透明、树脂封片,室温晾干后Olympus(DP71)拍照系统拍照。

2 结果
2.1 LPAR1-3基因检测结果
通过RT-qPCR检测LPAR1、LPAR2、LPAR3在不同时期卵巢中的表达结果分析发现,LPAR1-3基因在不同时期卵巢中均有表达(图1),在不同时期卵巢中,LPAR1基因在卵泡期卵巢中的表达量显著高于黄体期和妊娠期(P<0.05),黄体期和妊娠期表达量相似(图1A);LPAR2在卵泡期卵巢中的表达量最高,显著高于黄体期(P<0.05),妊娠期的表达量最低(图1B);LPAR3在黄体期卵巢中表达量最高,显著高于卵泡期(P<0.05),妊娠期的表达量最低(图1C),在同一时期卵巢中:LPAR1在卵泡期、黄体期、妊娠期的表达量均显著高于LPAR2和LPAR3(P<0.05);其中,LPAR3在卵泡期表达量最低(图1D),LPAR2在黄体期和妊娠期的表达量均最低(图1E和图1F)。结果说明LPAR1-3在不同繁殖时期牦牛卵巢中的表达存在差异。
2.2 LPAR1-3蛋白检测结果
通过Western blot检测LPAR1、LPAR2、LPAR3蛋白在不同时期卵巢中的表达结果分析发现,LPAR1-3蛋白在不同时期卵巢中均有表达(图2),在不同时期卵巢中, LPAR1、LPAR2、LPAR3蛋白的表达量均在妊娠期最高,均显著高于黄体期(P<0.05),并且在卵泡期表达量均最低(图3A、B、C)。在同一时期卵巢中,LPAR3蛋白在卵泡期、黄体期、妊娠期的表达量均显著高于LPAR1和LPAR2(P<0.05),LPAR2的表达量最低(图D3、E、F)。结果说明LPAR1-3蛋白在不同繁殖时期牦牛卵巢中的表达存在差异,且在各个时期中LPAR3表达量最高。

内参基因:β-actin;n=4。A.LPAR1;B.LPAR2;C.LPAR3;D.卵泡期;E.黄体期;F.妊娠期;不同字母代表差异显著(P<0.05)
1.卵泡期;2.黄体期;3.妊娠期
2.3 LPAR1-3蛋白定位检测结果
免疫组织化学染色结果中呈棕褐色的为阳性表达,与之对应的是阴性对照(图4)。结果显示,LPAR1、LPAR2、LPAR3蛋白在牦牛不同时期卵巢上均有表达,LPAR1-3在卵泡期卵巢上的表达主要分布在卵泡颗粒层(SG)、卵泡膜(TF)、生殖上皮(GE)、卵泡液(FF);LPAR1-3在黄体期卵巢上的表达主要在黄体细胞(CL)、生殖上皮(GE);LPAR1-3在妊娠期期卵巢上的表达主要在卵泡颗粒层(SG)、卵泡膜(TF)、黄体细胞(CL)、生殖上皮(GE)、卵泡液(FF)。
3 讨论
本研究结果显示,不同时期卵巢中LPAR1、LPAR2、LPAR3的mRNA和蛋白丰度不存在相关性。转录和翻译远不是线性的、简单的关系。据报道,调节蛋白通过在与SD序列相邻的区域与其自身的mRNA结合来抑制某些顺反子的翻译[13]。同时,SD序列还决定翻译效率,具有较少SD序列的转录本翻译效率较低,翻译效率会显著改变部分基因mRNA与蛋白质的相关性[14]。同时研究人员在不同的机制中发现,sRNA会影响mRNA的翻译效率和稳定性,有些促进核糖体与靶mRNA结合,有些则阻止翻译[15]、影响蛋白质的稳定性或翻译水平进而导致mRNA和蛋白量无相关性[16]。此外,Liszewska E等[10]发现在绵羊滋养外胚层中LPAR1和LPAR3的mRNA丰度在第14天达到高峰,而这两种LPAR的蛋白水平在妊娠第17天达到最高,先前报道的绵羊胚胎滋养外胚层分泌的主要产物即干扰素,在蛋白表达高峰和转录物之间有相似的时间间隔。胚胎干扰素mRNA在第14天最丰富,而干扰素蛋白在第16~第18天达到最高水平,几乎检测不到RNA。说明干扰素可能在一定程度上影响mRNA和蛋白量的相关性[17]。综上所述,转录和翻译涉及顺式作用机制和反式作用机制的不同机制产生了大量的系统,这些系统可以促进或抑制从一定数量的mRNA分子合成蛋白质。此外,不同时期卵巢中LPAR的mRNA和蛋白表达可能受到某种因子的调控作用。

内参蛋白:β-actin;n=4。A.LPAR1;B.LPAR2;C.LPAR3;D.卵泡期;E.黄体期;F.妊娠期;不同字母代表差异显著(P<0.05)
卵巢是雌性动物的主要生殖器官,不仅产生卵子和排卵,还可以产生性激素(包括雌激素、孕激素和少量的雄性激素)以及分泌一些多肽激素和生长因子,在生殖器官上占有主导作用。本研究结果显示LPAR1-3在牦牛的不同时期的卵巢上均有表达。主要分布在卵巢生殖上皮、颗粒细胞、卵泡液、卵泡膜和黄体细胞。Chen S U等[18]发现LPAR1-3受体在人颗粒黄体细胞中表达,并且有文献报道在牛卵巢中的黄体[2]和卵泡颗粒细胞[19]中检测到4种LPAR的表达。此外,在从接受体外受精的妇女的卵泡液中也发现了LPA[20],与本试验结果一致。在牛体中,颗粒细胞是E2的主要来源和靶点[21-23],膜来源的雄烯二酮(A4)在类固醇脱氢酶的作用下转化为E2[22]。此外,LPA也可刺激E2的产生,E2是通过调节类固醇的产生和促性腺激素受体的表达来促进卵泡发育[22]。本试验结果显示,LPAR1-3在卵泡颗粒层和卵泡膜表达,可能与LPAR1-3参与卵巢上皮前体颗粒细胞增殖和分化有关,提示LPAR1-3可能通过调节卵泡发育和卵泡闭锁过程影响牦牛生育能力。有研究表明,补充LPA的体外成熟培养液可以提高卵母细胞的成熟率[23]。此外,在LPA存在下,猪和牛卵母细胞的成熟率也有不同程度的提高[24]。本试验结果显示,LPAR1-3在卵巢的卵泡液中表达,可能与参与卵母细胞成熟和功能的调控作用有关。有报道称,LPA通过增加3b-羟基类固醇脱氢酶/5D-4D异构酶在牛黄体类固醇生成细胞中的表达来刺激P4的合成[2],P4是一种天然孕激素,促进子宫内膜分泌,以利受精卵的植入,并降低子宫内膜的兴奋性,保证妊娠的安全进行。本研究发现,LPAR1-3在卵泡液中均表达,推测LPAR1-3可能参与牦牛胚胎植入和妊娠的维持。
卵泡的正常生长、发育和成熟是提高繁殖力的关键。有研究发现,LPA可通过LPA受体诱导白介素细胞8(interleukin-8,IL-8)和白介素细胞6(interleukin-6,IL-6)的表达[18]。IL-8和IL-6已被发现在排卵前卵泡中升高,并与排卵有关。IL-8和IL-6可能具有白细胞对中性粒细胞和单核细胞的趋化活性,这可能通过蛋白水解因子的释放导致卵泡破裂时的组织降解[25]。此外,IL-8参与卵泡发育、排卵、类固醇生成和黄体功能。本试验结果显示,卵泡期LPAR1-3均表达,且LPAR3显著高于LPAR1、LPAR2,因此,卵泡期卵巢中LPAR1-3的存在可能在牦牛卵泡的生长发育以及排卵中起一定的作用。
黄体是一种在卵巢中暂时形成的内分泌腺,在发情周期结束时经历退化。黄体由成熟卵泡形成,生长迅速,血管化迅速。牛黄体由大小黄体细胞、内皮细胞、成纤维细胞和免疫细胞组成。在未怀孕的奶牛中,黄体在排卵后17 d~18 d左右经历黄体溶解并失去功能[26]。黄体生成高峰和排卵后,黄体颗粒细胞和卵泡膜细胞形成黄体新生血管[27]。新生血管可能促进类固醇激素的生物合成和运输。有报道称,LPAR1参与了LPA诱导的IL-8蛋白在血管生成中内皮细胞的迁移、通透性、管形成和增殖的过程。而LPAR2参与了LPA诱导的IL-6蛋白在功能上增强了内皮细胞的通透性[18]。综上所述,LPAR1、LPAR2可能在LPA的诱导下参与牦牛黄体新生血管的形成。
妊娠期卵巢会稍微有所增大,同时停止排卵,一侧卵巢可以看到有妊娠黄体的形成,妊娠黄体是用来合成雌激素和孕激素的。黄体在妊娠期间的主要功能是合成P4,它在调节受精后胚泡的植入中起主要作用。本试验结果显示,LPAR1-3在妊娠期卵巢均表达,可能与LPAR1-3参与调节受精后胚泡的植入有关。在摘除卵巢的小鼠中P4也促进了LPAR3的表达,而雌激素则抵消了P4的影响[8],作者推测P4和E2共同调节LPAR3的表达,有助于早孕子宫内膜的容受性。此外,Ye X等[28]发现LPAR3在小鼠子宫中的表达与正确的胚胎植入有关。本试验结果显示,LPAR3在妊娠期表达量显著高于LPAR1和LPAR2,LPAR3可能通过P4促进子宫内膜分泌,并降低子宫内膜的兴奋性,保证妊娠的安全进行,提示LPAR3可能在牦牛的胚胎的植入和妊娠的维持具有一定的作用。

