JSRV Env通过Akt/mTOR信号通路调控绵羊绒毛膜滋养层细胞增殖
段续接,杨 惠,刘淑英
(内蒙古农业大学兽医学院/内蒙古自治区基础兽医学重点实验室,内蒙古呼和浩特 010018)
外源性绵羊肺腺瘤病毒(Exogenous jaagsiekte sheep retrovirus,exJSRV)属于β逆转录病毒,结构和基因序列与其他逆转录病毒相似[1]。病毒的囊膜蛋白Env由env编码,包含表面蛋白(surface protein unit,SU)和跨膜蛋白(transmembrane protein domain,TM) 2个结构域,其中SU与细胞表面的特异性受体结合,TM在病毒感染细胞时与细胞膜发生融合[2]。大量研究表明,JSRV-env为致癌基因,其编码的囊膜蛋白(Env)主要影响影响细胞的增殖[3]。
JSRV Env可以在多种体外细胞系中诱导细胞转化[4]。作者所在实验室孙晓林等[5]通过用pcDNA4/myc-his/exJSRV-env重组表达质粒诱导小鼠成纤维细胞系NIH3T3转化;Thomas E A利用pRCASBP(A)-J-env成功诱导禽胚胎成纤维细胞细胞系DF-1转化[6]。Miller A D等利用pSX2.JSRV-env成功诱导了大鼠成纤维细胞系208F转化[7]。Johnson C等利用pLXSN-env-HA成功诱导了犬上皮细胞系MDCK的转化[8]。研究表明,JSRV Env通常激活Ras-Raf-MEK-MAPK、RON和PI3K/Akt/mTOR这3条信号通路介导细胞转化。Maeda N等[9]利用pCMV3GP转染NIH3T3细胞证实了JSRV通过Ras-Raf-MEK-MAPK通路对NIH3T3成纤维细胞的转化。Varela M等[10]证明了JSRV Env可以与RON酪氨酸激酶结合,且JSRV Env与透明质酸酶-2 (hyaluronidase-2,HYAL-2)的相互作用导致RON二聚体活化。PI3K/Akt/mTOR信号通路可被生长因子、激素、蛋白激酶的受体或非受体过表达所激活,参与细胞增殖、致癌基因的转化和癌症的发生发展过程。并且Akt可以在OPA的肿瘤细胞和JSRV Env转化的细胞中被激活[5]。作者所在实验室前期研究表明,通过利用pcDNA4/myc-his/exJSRV-env重组表达质粒诱导转化NIH3T3细胞,检测到转化细胞中Akt/mTOR信号通路被激活,磷酸化的Akt和mTOR水平显著高于未转染组,并显著抑制了细胞自噬[11]。但目前仍需完善JSRV Env诱导细胞增殖及转化的具体信息,以加深研究者对于JSRV Env致瘤分子机制的理解。
本研究通过已构建好的JSRV Env慢病毒载体诱导绵羊绒毛膜滋养层细胞(sheep trophoblast cells,STCs)转化,检测Akt/mTOR 信号通路的激活情况,并探究细胞增殖伴随慢病毒转染时间延长而发生的具体变化,以期为癌基因激活细胞增殖相关信号通路提供基础研究资料。
1 材料与方法
1.1 材料
1.1.1 主要材料与试剂 DMEM high glucose、胰酶-2.5 mg/mL EDTA、FBS、青霉素-链霉素、无钙镁的磷酸盐缓冲液,美国GIBCO公司产品;SDS-PAGE凝胶制备试剂盒,北京索莱宝公司产品;全蛋白提取试剂盒,生工生物工程(上海)股份有限公司;BCA试剂盒,碧云天生物技术(上海)有限公司;山羊抗兔Akt,山羊抗兔 p-Akt,山羊抗兔mTOR,山羊抗兔p-mTOR,美国Cell Signaling Technology公司产品;HRP标记的山羊抗兔IgG、HRP标记的山羊抗鼠IgG,博奥森公司产品;一抗稀释液、二抗稀释液、ECL发光显色试剂盒,碧云天生物技术有限公司产品;PVDF膜,美国Millipore公司产品;TBST洗涤剂,北京Cwbiotech公司产品;脱脂奶粉,美国BD公司产品;雷帕霉素,美国MCE公司产品;MTT噻唑蓝,索莱宝公司产品。
1.1.2 仪器设备 -80 ℃超低温冰箱,青岛海尔公司产品;高压灭菌锅,日本TOMY公司产品;分析天平,德国Sartorius公司产品;微量移液器,Eppendorf,德国);Maxi MixⅡ涡旋混匀震荡器(Thermo,美国);低温高速离心机(Eppendorf,德国);迷你离心机(Scilogex,美国);电热鼓风干燥箱,一恒(上海)公司产品;超净工作台,安泰苏州有限公司产品;二氧化碳细胞培养箱,美国Thermo公司产品;多功能酶标仪,美国Biotek公司产品;DYY-6C型电泳仪电源、DYCZ-24DN标准垂直电泳仪、迷你垂直板电泳转印系统,北京六一生物科技有限公司产品;蛋白凝胶成像系统,上海Tanon公司产品。
1.2 方法
1.2.1 绵羊绒毛膜滋养层细胞解冻复苏与体外培养 解冻复苏绵羊绒毛膜滋养层细胞,使用含100 mL/L血清的完全培养基,于37 ℃、体积分数为5%的CO2细胞培养箱中培养,待细胞在瓶内增殖至细胞生长面70%~80%左右时传代,待传到解冻复苏后的第3代、细胞体外增殖稳定后用于后续试验,要求细胞状态较佳、存活率90%以上、细胞边缘清晰。
1.2.2 JSRV过表达慢病毒及空病毒载体转染STCs 绵羊绒毛膜滋养层细胞接种于6孔培养板中,每孔约 2×105个细胞,37℃、体积分数为5%的CO2培养箱中,采用无血清培养基中培养细胞,加入5 μg的JSRV Env慢病毒,同时加入终浓度为 8 μg/mL的Polybrene增强转染效果,24 h后更换含100 mL/L血清的完全培养基继续培养。转染72 h后观察细胞状态,用激光共聚焦显微镜观察是否转染成功。
1.2.3 细胞蛋白提取及蛋白免疫印迹试验 按照蛋白质提取试剂盒说明书,提取细胞总蛋白,BCA法测定细胞浓度,酶标仪测定562 nm波长的吸光度值,样品中的蛋白浓度根据标准蛋白曲线计算。蛋白中加入上样缓冲液变性后置于-20 ℃冷藏备用。Western blot检测目的蛋白表达量,聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白后,采用湿转印法将蛋白质转移到PVDF滤膜上,放入封闭液中封闭,室温下置于摇床上中速封闭2 h,PVDF滤膜浸泡在10% TBST溶液中,置于摇床上10 min×5次洗膜。分别孵育一抗为山羊抗兔Akt,山羊抗兔 p-Akt,山羊抗兔mTOR,山羊抗兔p-mTOR 置于4 ℃过夜。10% TBST 10 min×5次洗膜后,HRP标记的山羊抗兔IgG为二抗在室温下摇床中速孵育90 min。10% TBST 10 min×5次洗膜后将ECL显色液均匀敷在膜上,用凝胶成像分析系统拍照观察。利用Image J软件分析每个条带的灰度值,使用GraphPad Prism 8(GraphPad Sofware,USA)进行统计并生成统计图片。
1.2.4 MTT比色法检测细胞增殖情况 将空白组(STCs),对照组(空病毒载体转染STCs),试验组(JSRV Env慢病毒转染STCs)的细胞消化后铺在96孔板中,每组细胞做5个重复孔,每孔计数2 000个细胞,每孔加含100 mL/L血清的完全培养基200 μL,培养24 h后换液。分别培养24、48、72 h后,加入5 mg/mL的MTT每孔20 μL,置于37℃、体积分数为5%的CO2培养箱培养4 h后吸出上清液,每孔加入二甲基亚砜(DMSO)150 μL,振荡溶解10 min,用酶联免疫测定仪选择波长为490 nm,空白孔调零,测定各孔吸光值,取其平均吸光值,以细胞生长变化率表示,以时间为横坐标,吸光度为纵坐标,绘制细胞增殖曲线图,使用GraphPad Prism 8进行统计,P<0.05具有统计学意义,并生成统计图片。
1.2.5 JSRV Env过表达慢病毒转染STCs并加入雷帕霉素 JSRV Env慢病毒转染24 h后,添加50 μmol/L雷帕霉素作用12、48、72 h。Western blot检测mTOR表达情况。MTT比色法检测细胞增殖情况。
2 结果
2.1 JSRV Env慢病毒感染STCs细胞
利用激光共聚焦显微镜观察空白组(STCs)、对照组(空病毒载体转染STCs)、试验组(JSRV Env慢病毒转染STCs)的荧光表达情况。JSRV Env慢病毒转染STCs 72 h后,在激光共聚焦显微镜下可观察到大量的红色荧光信号说明Env蛋白大量表达,占比约为80%,证明JSRV Env慢病毒转染成功(图1)。
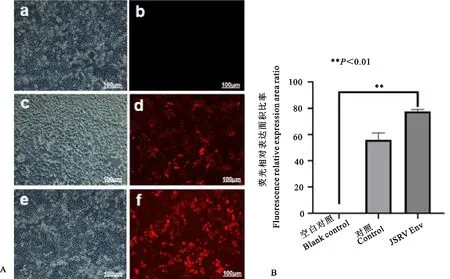
A.激光共聚焦显微镜观察结果;B.JSRV Env慢病毒转染STCs 72 h相对荧光蛋白表达率分析结果;a.明场下STCs未转染组;b.荧光场下STCs未转染组;c.明场下慢病毒空载体转染STCs;d.荧光场下慢病毒空载体转染STCs;e.明场下JSRV Env过表达慢病毒转染STCs;f.荧光场下JSRV Env慢病毒转染STCs。
2.2 Western blot检测STCs细胞中Akt/mTOR信号通路蛋白表达量
与蛋白预染Marker相比较,在60 ku处及289 ku表达明显蛋白条带。空白组,对照组,试验组中均有Akt、mTOR的表达,试验组中有p-Akt、p-mTOR的大量表达。经过灰度分析处理,p-Akt、p-mTOR在JSRV Env慢病毒感染组的表达水平显著高于未转染组的磷酸化水平(P<0.05)(图2)。说明了在JSRV Env慢病毒作用下成功激活Akt/mTOR信号通路。

图2 STCs中Akt、mTOR蛋白免疫印迹鉴定
2.3 Western blot检测加入雷帕霉素后的mTOR表达量
为探究雷帕霉素对mTOR的抑制作用 ,利用Western blot检测试验组(JSRV Env慢病毒转染组)加入雷帕霉素24、48、72 h后mTOR表达量。
结果显示,与24 h和48 h相比,雷帕霉素作用72 h后mTOR表达量显著减少(P<0.05),24 h和48 h之间无显著差异(P>0.05)。说明了雷帕霉素抑制了mTOR的表达(图3)。
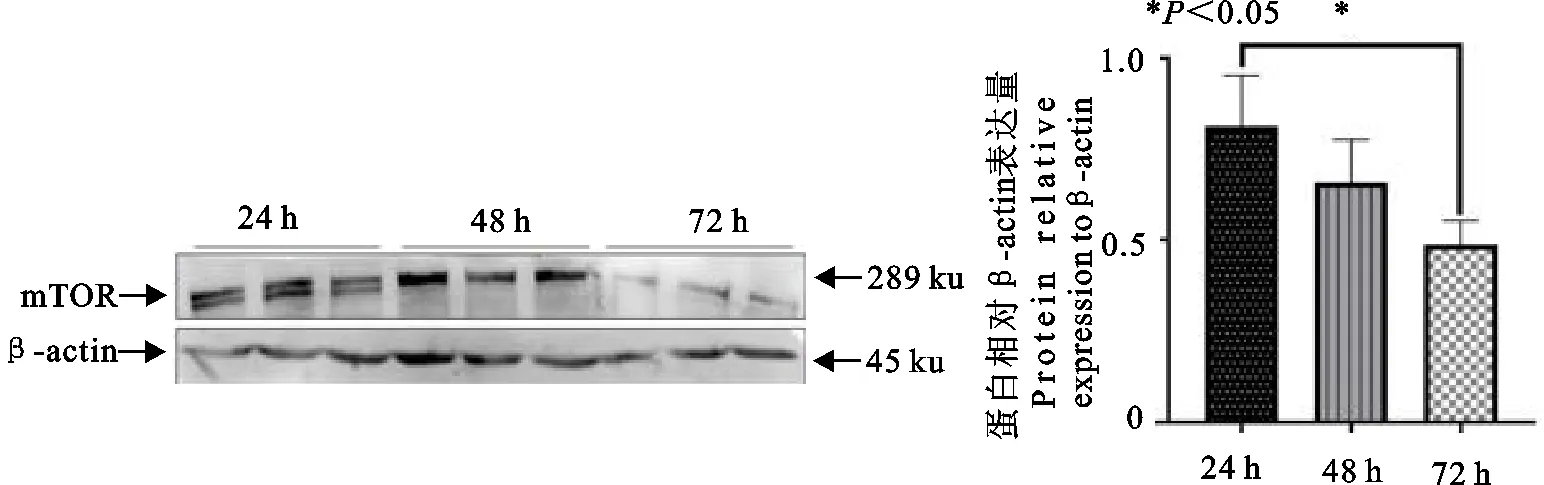
图3 雷帕霉素抑制mTOR蛋白免疫印迹及分析
2.4 MTT测定细胞增殖
为探究JSRV Env慢病毒对STCs增殖的影响,利用MTT比色法测定空白组(STCs),对照组(空病毒载体转染STCs),试验组(JSRV Env慢病毒转染STCs),雷帕霉素抑制组24、48、72 h的光吸收值。结果显示,试验组在各个时间段的光吸收值均大于空白组及对照组,在72 h光吸收值差异显著(P<0.05),空白组和对照组之间无显著差异(P>0.05);雷帕霉素抑制组在各个时间段的光吸收值显著(P<0.05)低于其他3组(图4)。以上结果表明,JSRV Env转化STCs后促进了细胞增殖,mTOR抑制剂雷帕霉素抑制了细胞增殖。
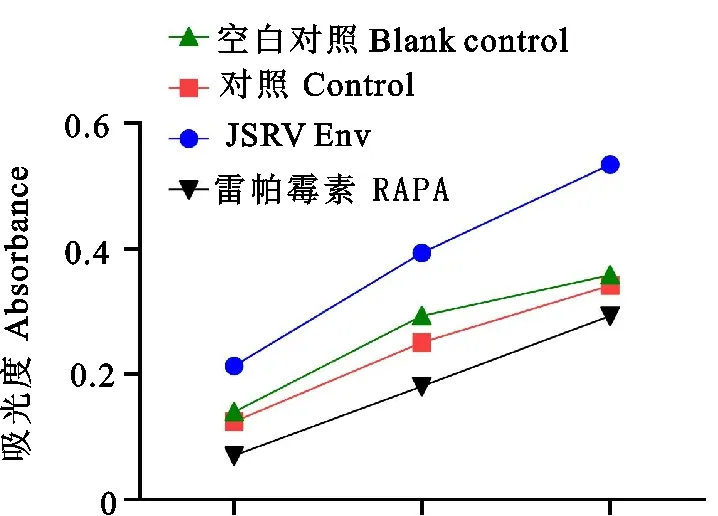
图4 MTT法测定JSRV Env慢病毒感染STCs细胞增殖
3 讨论
本研究利用JSRV Env慢病毒载体诱导STCs转化,探究Akt/mTOR信号通路的激活和对细胞周期的影响。JSRV Env体外诱导试验通常采用真核表达质粒转染的方式,本试验通过慢病毒将外源基因整合到宿主染色体中,进行高效稳定的转导。其长末端重复序列(Long terminal repeats,LTR)具有启动子和增强子等调控元件,可以提高病毒基因的表达能力,并且极大地还原了JSRV-env在体内作用的条件[12]。该方法对探究JSRV Env影响细胞增殖有重要意义。
JSRV Env通常可引起上皮细胞发生转化,在绵羊体内主要感染肺泡Ⅱ型上皮细胞和克拉拉细胞,本试验中采用绵羊源分泌型上皮细胞——绵羊绒毛膜滋养层细胞进行研究,使JSRV Env转化细胞的方式与绵羊肺腺瘤病的恶性转化细胞机制更为接近。Env主要通过受体依赖机制激活Akt/mTOR信号通路,即JSRV Env与细胞膜表面的受体Hyal 2结合,激活了磷脂酰肌醇3-激酶(phosphatidylinositol 3′-kinase-serine,PI3K)及下游的Akt和mTOR。已有研究表明JSRV Env转化细胞途径依赖于该机制的还有人支气管上皮细胞BEAS-2B[13]、大鼠回肠上皮细胞IEC-18[7]和大鼠肾上皮细胞RK3E[9]等。
本实验室前期的试验结果验证了MAPK信号转导通路中的JNK信号通路、P38信号通路、ERK信号通路在OPA病肺中激活,通过通路关联交叉参与细胞凋亡、自噬、增殖等生理过程影响细胞周期[5]。本试验验证了JSRV Env转化细胞中激活Akt/mTOR 信号转导通路,并且与细胞周期密切相关,Akt/mTOR途径对JSRV转化细胞非常重要。作者所在实验室转录组测序分析结果也揭示该信号通路在OPA中激活[14]。利用JSRV-env体外过表达也成功验证Akt/mTOR信号通路激活[11]。本课题组孙晓林等[5]利用pcDNA4/myc-his/exJSRV-env成功验证了Akt/mTOR信号通路在NIH3T3细胞中被激活。Maeda N等[9]利用pCMV3GP转染大鼠肾上皮细胞系RK3E和小鼠成纤维细胞系NIH3T3,证实了JSRV-env过表达激活Akt/mTOR信号通路,且对RK3E细胞调控作用更明显。Liu 利用Jenv-FLAG (JSRV Env)成功转化了大鼠成纤维细胞系208F,验证了Akt/mTOR信号通路激活[15]。作者所在实验室杜方原利用pcDNA4/myc-his/exJSRV-env重组表达质粒诱导NIH3T3细胞转化利用CCK-8法检测到细胞增殖活力增强[16]。以上结果均与本试验结果一致。
本试验结果表明JSRV Env转化STCs后激活了Akt/mTOR信号通路,促进了细胞增殖。而在加入mTOR抑制剂雷帕霉素后,抑制了细胞增殖。即JSRV Env通过Akt/mTOR信号通路转化细胞调控细胞的增殖,弥补了前人研究的空白。
基于以上研究明确Akt/mTOR 信号通路在JSRV Env转化中的重要性,其具体转化机制有待后续更深入的研究。
JSRV Env转化STCs后,通过激活Akt/mTOR 信号通路促进了细胞增殖。本研究结果进一步完善了细胞增殖的基础研究资料。
——雷帕霉素

