TGEV-RBD基因在昆虫杆状病毒中的表达及鉴定
伊立超,李乐天,郝嘉翼,时小双,张 爽,徐 鹏,任世斌,高 旭*,李 昌*
(1.延边大学农学院,吉林延吉 133000;2.军事科学院军事医学研究院军事兽医研究所/中国医学科学院人兽共患病毒病防控关键技术研究创新单元,吉林长春 130122)
猪传染性胃肠炎(Transmissible gastroenteritis,TGE)是猪的一种高度接触性肠道传染病,1946年在美国第一次报道发生该病,1960年以来,中国开始报道猪传染性胃肠炎,该病是目前导致仔猪发病甚至死亡的重要原因,严重影响中国猪养殖业的发展[1-2]。多数病死猪表现严重的脱水和体重下降情况,同时发现小肠和胃部有卡他性炎症[3]。猪传染性胃肠炎病毒(Transmissible gastro enteritis virus,TGEV)是TGE的病原,为冠状病毒科(Coronaviridae)冠状病毒属(Coronavirus)成员,属于Ⅰ型冠状病毒。病毒粒子多为球状或椭球形,直径为80 nm~200 nm[4-5]。研究表明,猪传染性胃肠炎病毒基因组重组率非常高,类似于分节段的RNA病毒[6-7],病毒表面的纤突蛋白(Spike,S)介导细胞附着和膜融合[8]。TGEV的结构蛋白中,S蛋白能诱导产生中和抗体并对机体能提供免疫保护作用,而且有宿主细胞受体的识别位点,决定了对宿主细胞的感染性和血凝性等作用,是当前猪传染性胃肠炎病毒基因工程疫苗的重要研究方向,有很大的研究潜力[9]。而猪传染性胃肠炎病毒S1蛋白中有一个重要片段,氨基酸残基位置在523-666位,该片段为受体结合域(receptor-binding domain,RBD)[10-11],是决定病毒和受体相作用的关键因素,因此也决定着病毒的宿主来源和亲嗜性[12]。
国内目前用来预防猪传染性胃肠炎(TGE)的疫苗有灭活疫苗和弱毒活疫苗,但免疫效果较差。而且近年来猪传染性胃肠炎病毒突变株的流行,使得原来的疫苗效果甚微。为此,本试验针对猪传染性胃肠炎病毒的纤突蛋白(Spike,S)中的受体结合域(RBD),应用杆状病毒表达系统进行TGEV-RBD基因表达,为猪传染性胃肠炎诊断和亚单位疫苗研制提供新的思路。
1 材料与方法
1.1 材料
1.1.1 主要试剂 标准 Marker、Trans1-T1感受态细胞,宝生物工程(大连)有限公司产品;FastBacTM双载体、EcoRⅠ、XbaⅠ、DH10 Bac感受态细胞,Thermo Scientific公司产品;Anti-strep tag抗体,Abcam公司产品;抗TGEV多克隆抗体,中国医学科学院人兽共患病毒病防控关键技术研究创新单元实验室制备;小鼠抗β-actin抗体,中杉金桥公司产品;HRP标记Goat Anti-Mouse IgG、FITC标记Goat Anti-Mouse IgG,碧云天生物技术公司产品。
1.1.2 主要仪器 生化培养箱(SPX-250B-Z),上海博远实业有限公司医疗设备厂产品;超级洁净工作台(DL-CJ-2N),北京东联哈尔仪器制造有限公司产品;智城恒温培养振荡器(ZWY-2102C),上海智城分析仪器制造有限公司产品。
1.2 方法
1.2.1 目的基因设计与合成 参考GenBank登录的猪传染性胃肠炎病毒全基因组序列(ID:ABC72414.1),选取其受体结合域(Receptor binding domain,RBD)基因序列,上、下游分别添加EcoRⅠ和XbaⅠ酶切位点,设计完成后,根据杆状病毒表达系统,进行密码子优化,然后由南京金斯瑞公司合成。
1.2.2 重组质粒的鉴定 将合成的TGEV-RBD亚克隆至杆状病毒双表达载体的PH启动子下游,命名为pFBD-TGR,用EcoRⅠ、XbaⅠ进行双酶切鉴定。
1.2.3 重组杆粒的制备 将鉴定正确的质粒pFBD-TGR转化到DH10BacTM感受态细胞中,并涂布于三抗琼脂平板(含有四环素、卡钠霉素、庆大霉素、IPTG/X-Gal)上,37 ℃培养箱倒置培养48 h。挑取较大的中央无灰色的白色菌落到三抗(成分同上)培养基中,37 ℃振荡培养过夜,进行菌液PCR鉴定,上游引物为PHF:5′-TTCATACCGTCCCACCAT-3′,下游引物为M13通用引物反向引物,鉴定正确后,碱裂解法提取杆粒,命名为Bacmid-TGR。
1.2.4 重组杆状病毒的拯救 在培养皿中接种sf9细胞,27 ℃培养8 h~12 h,更换2 mL完全培养基(含15 mL/L胎牛血清Grace's培养基),使用无抗无血清Grace's培养基分别与重组杆粒Bacmid-TGR(4 μg)与CellfectinTMⅡ Reagent(4 μL)混匀,静置20 min均匀加入培养皿中,置于27 ℃培养箱,4 h~5 h后更换完全培养基,27 ℃培养6 d~7 d,离心收取上清即为第1代重组杆状病毒rBV-TGR,继续传3代。
1.2.5 间接免疫荧光鉴定TGEV-RBD蛋白的表达 在6孔板中接种sf9细胞,待细胞长满70%左右,每孔接种20 μL第3代重组杆状病毒rBV-TGR。27 ℃静置培养2 d后,培养基吸出备用。用细胞固定液固定0.5 h,2 mL/L Trion X-100室温反应10 min,PBS清洗3次。50 g/L脱脂乳封闭1 h,1 000倍稀释的Anti-strep tag室温孵育2 h,PBS清洗3次。2 000倍稀释FITC-标记的Goat Anti-Mouse IgG,室温避光孵育1 h,PBS清洗3次。用荧光显微镜观察。
1.2.6 Western blot检测TGEV-RBD蛋白的表达 取1.2.4中吸出的培养基,3 000 r/min离心5 min,制成蛋白样品。凝胶电泳后,用转膜仪转印蛋白至NC膜上,分别用1∶1 000稀释Anti-strep tag和1∶100稀释的抗猪传染性胃肠炎病毒多克隆抗体为一抗,1∶5 000稀释的HRP标记Goat Anti-Mouse IgG为二抗,进行Western blot鉴定。
1.2.7 TGEV-RBD蛋白的表达优化 确定蛋白为可溶性表达之后,按照接毒量1 MOI、5 MOI、8 MOI、10 MOI和表达时间72 h、96 h进行表达条件的优化,提高TGR蛋白的表达效率。接毒后按照以上时间每次收集1 mL细胞培养液,然后将细胞培养液1 000 r/min离心5min后收集上清液,进行Western blot鉴定,然后将Western blot条带经内参修正后进行灰度分析。
2 结果
2.1 TGEV-RBD基因测序结果分析
本研究所选取的目的基因序列来自于中国流行株(NCBI ID:ABC72414.1),将其与几种比较典型毒株的TGEV-RBD序列进行基因进化分析(图1),同源性分析显示,该氨基酸序列与其他分离株的同源性介于96.5%~100%,表明受体结合域(RBD)基因氨基酸序列具有较高的保守性。
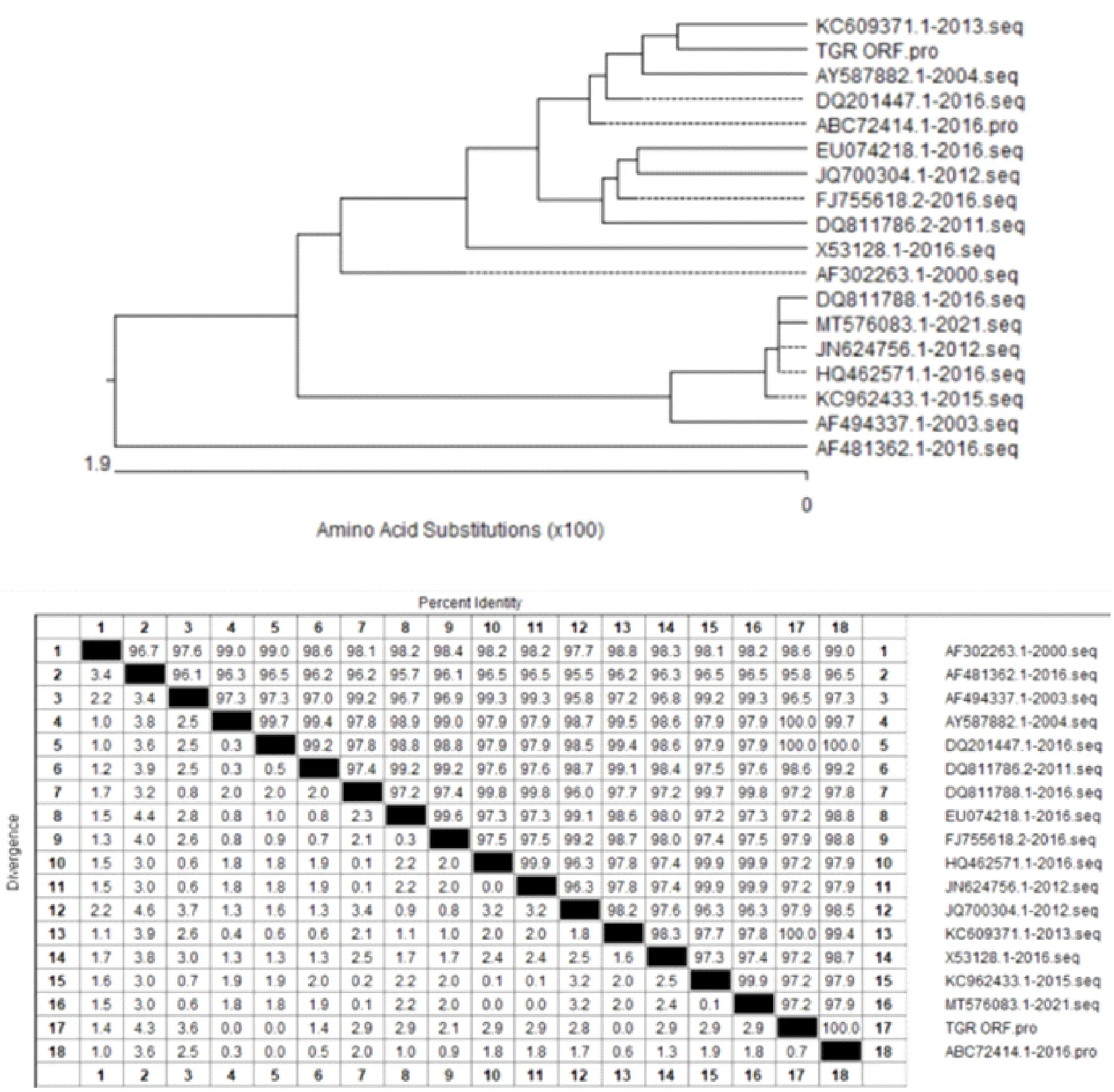
图1 TGEV-RBD基因分析
2.2 目的基因设计与合成
以TGEV流行株(NCBI ID:ABC72414.1)S蛋白为基础,利用信号肽预测工具,保留氨基酸残基1-16位置作为信号肽,523-666位置为受体结合域(RBD)(图2A),同时,N端添加kozak起始序列、Twin-Strep标签,两端分别添加酶切位点EcoRⅠ和XbaⅠ(图2B)。

图2 TGEV-RBD基因结构示意图
2.3 重组质粒鉴定
用EcoRⅠ、XbaⅠ双酶切重组质粒pFBD-TGR,结果显示,可得到1条700 bp左右的目的基因条带,表明质粒构建成功(图3),DNA测序鉴定结果同时表明,目的序列与原序列完全一致。
2.4 重组杆粒的鉴定
利用上述引物对菌液直接进行PCR鉴定,结果显示,应用引物PHF和M13通用引物扩增可见大小约为1 000 bp的单一条带(图4),表明重组Bacmid-TGR构建成功。
2.5 重组杆状病毒的获得
用重组Bacmid-TGR转染sf9细胞6 d~7 d产生第1代重组杆状病毒,此时细胞均有细胞变圆、变大、漂浮,贴壁细胞数目减少,细胞核明显增大(图5B),出现典型CPE(图5C),而正常细胞无变化(图5A),表明获得了重组杆状病毒。
2.6 间接免疫荧光鉴定TGEV-RBD蛋白的表达
利用Anti-strep tag抗体对重组杆状病毒感染的sf9细胞进行IFA鉴定,结果表明,未转染的sf9细胞未出现荧光(图6A),而转染rBV-TGR的sf9细胞出现绿色荧光(图6B),表明TGEV-RBD基因在杆状病毒中成功表达。
2.7 重组蛋白TGEV-RBD的蛋白印迹检测
将重组Bacmid-TGR转染至sf9细胞,置27 ℃恒温培养箱,培养5 d~7 d后,大量细胞出现病变后,收取上清,并将20 μL上清接种至将近铺满sf9细胞的6孔板内,重复传至第3代,待细胞出现大量病变且有漂浮时将细胞培养液离心取上清,凝胶电泳后,用Anti-strep tag和抗TGEV多克隆抗体分别作为一抗进行蛋白印迹检测,有大小为28 ku目的蛋白条带产生,表明TGEV-RBD蛋白成功表达(图7)。

M.DNA 标准DL 5 000;1.重组质粒; 2.重组质粒双酶切
2.8 TGEV-RBD蛋白表达的条件优化
将72 h、96 h按照接毒量1 MOI、5 MOI、8MOI、10 MOI收获的细胞培养液3 000 r/min离心5 min后收集上清液,进行Western blot鉴定(图8),将96 h的条带用Image J进行灰度分析,用内参进行修正后,用GraphPad Prism 6.02作图分析,T检验显示除1、2组外,其他均满足P<0.01,表明10 MOI、96 h的表达量为最高(图9)。

M.蛋白分子质量标准;1.Strep tag抗体鉴定重组蛋白pFBD-TGR; 2.空白对照; 3.抗TGEV多克隆抗体鉴定重组蛋白pFBD-TGR
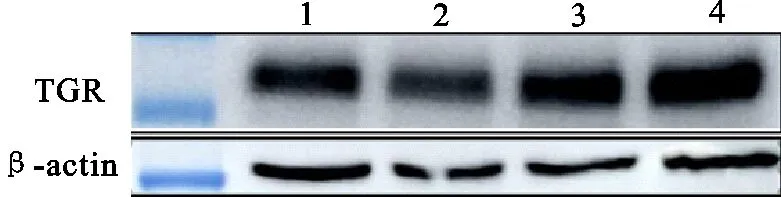
1~4.接毒量1 MOI、5 MOI、8 MOI、10 MOI

1~4.接毒量1 MOI、5 MOI、8 MOI、10 MOI

M.DNA 标准DL 2 000;1.菌液PCR; 2.空白对照

A.正常的sf9细胞; B.重组杆粒Bacmid-TGR转染120 h的sf9细胞病变;C.P3代重组杆状病毒感染48h的sf9细胞病变

A.正常sf9细胞; B.重组杆粒Bacmid-TGR转染120 h的sf9细胞
3 讨论
纤突蛋白(Spike,S)能诱导产生中和抗体并能对机体提供免疫保护作用,而且有宿主细胞受体的识别位点,决定了对宿主细胞的感染性和血凝性等作用[9]。
王艳春[13]利用杆状病毒表达系统成功表达TGEV S基因的抗原A蛋白,并成功制备出单克隆抗体。杜颖卉等[14]构建了TGEV S基因的重组乳酸菌,小鼠口服后,血清IgG与粪便sIgA均有显著性提高。宋林林[15]构建了TGEV S基因真核表达载体并成功表达。受体结合域(RBD)蛋白是TGEV S蛋白的截短表达,能够阻断病毒感染细胞,诱导抗体产生,是刺激宿主免疫反应、中和抗体产生的主要抗原成分。宿主细胞和病毒的结合与TGEV-RBD蛋白密切相关[12],受体结合域(RBD)的受体结合基序与细胞受体相互作用,介导病毒与宿主细胞的黏附。针对S蛋白受体结合域(RBD)的特异性中和单克隆抗体可以有效地阻断病毒入侵,它被认为是一个关键的治疗靶点[16]。查阅资料,暂未发现表达TGEV受体结合区(TGEV-RBD)的表达研究。
真核表达系统相比于原核表达系统,对翻译后的蛋白的加工修饰作用,使其更接近天然蛋白质。杆状病毒表达系统是成熟且高效的真核表达系统,表达外源蛋白的生物学活性、免疫原性、功能特性等均与天然蛋白几乎相同[17],而且杆状病毒不感染脊椎动物,表达的产物具有高度的生物安全性[18]。
本试验将TGEV-RBD基因成功克隆至杆状病毒表达载体,构建了pFBD-TGR质粒,并获得穿梭质粒Bacmid-TGR,将穿梭质粒转染sf9细胞,获得重组杆状病毒rBV-TGR,并表达了TGEV-RBD蛋白,所表达蛋白的相对分子质量约28 ku;间接免疫荧光和Western blot均表明,TGEV-RBD蛋白具有良好的抗原性,为进一步研究TGEV-RBD蛋白的生物学功能、研发诊断试剂、制备亚单位疫苗奠定了基础,也为利用昆虫杆状病毒表达系统进行其他冠状病毒结构蛋白的表达提供了借鉴和参考。

