HO-1在急性骨筋膜室综合征中的表达及临床意义的研究
郑铁军,黄钊,凌赫,苏伟*
(1.广西医科大学第一附属医院创伤骨科手外科,广西 南宁 530021;2.广西医科大学广西生物医药协同创新中心,广西 南宁 530021)
0 前言
急性骨筋膜室综合征( acute compartment syndrome,ACS)是临床上常见的急症之一[1]。ACS是创伤或其他导致出血、水肿或影响肢体的灌注疾病的并发症。四肢骨折或挤压伤是ACS最常见的原因[2]。骨折、挤压伤或肢体缺血后由于血液和液体的积聚,肢体发生进行性肿胀。ACS 是由于闭合的筋膜室内压(intracompartmental,ICP)升高,引起微循环障碍继而引起肌肉、神经损伤[3]。由于肌肉筋膜和其他结缔组织是非弹性的,这种增加的肿胀会导致ICP的增加,并传递到薄壁静脉,导致静脉高压和进行性组织缺血。随着细胞死亡的开始,细胞膜溶解释放出渗透活性的细胞内容物进入间质,导致液体进一步堆积,室内压力进一步增加。微动脉灌注也可能受损,导致微血管塌陷。组织血流阻断,最后会发生恶性循环的结局[缺血-水肿-缺血][4]。组织的新陈代谢需求得不到满足,导致活性氧(Reactiveoxygen species,ROS)和其他炎症介质的增加,不仅会使组织的损伤得以加重[5,6],而且还会干扰肌肉组织的再生和修复。ACS的唯一有效治疗方法是立即手术筋膜切开术,松解皮肤和肌肉筋膜,降低筋膜间压力。
到目前为止,血红素加氧酶(heme oxygenase,HO)已有两种亚型HO-1和HO-2在哺乳动物中被报道,第三种HO-3是由Hayashi和他的同事提出的,而在植物中发现了四种亚型(HO-1,HO-2,HO-3和HO-4)[7]。在不同的HO亚型中,HO-1因其表达水平在不同的病理生理条件下被诱导而被认为是最受关注的研究对象。HO-1催化血红素降解为一氧化碳(CO)、亚铁和胆绿素,然后被胆绿素还原酶迅速还原为胆红素。研究表明,HO-l是能有保护作用,抵抗氧化性损伤的内源性物质[8]。HO-l的转录受多种应激源的触发,包括血红素、缺氧、氧化应激和紫外线照射[9]。HO-l在触发后产生,会发挥抑制炎症反应、减少氧化反应、以及抗细胞凋亡等效能使得机体受到保护作用[10,11]。在反应后的生成物中,其中胆红素可以起到使过氧化反应变弱的作用,而在CO存在的情况下,可以激活鸟苷酸环化酶,有环磷酸鸟苷生成[12]。如果组织器官发生缺血性损伤,例如肢体发生缺血-再灌注损伤(ischemia reperfusion injury,IRI)后,HO-1 会生成增多[13],这样就会相继引起CO生成增多,最终肢体的缺血性损伤会得以减弱[14],CO在几种体外和体内炎症模型中被认为是一种有效的抗炎剂[15]。一般认为,外源性的CO的可发挥保护作用,可以使后肢肌肉的缺血性损伤得以减弱,这在大鼠[16]和小鼠[17]上得以体现。更有表明,这种理论可能适用于在缺血性肌肉中HO-1产生的内源性CO[9]。
Ewing和他的同事通过观察心脏对高温的反应增加了HO-1的表达,首次证明了HO-1在维持心脏内稳态方面的主要作用[15]。此外,许多HO-1转基因小鼠模型的研究表明,由于HO-1的表达,IRI后心肌梗死面积减少[18]。此外,在心力衰竭模型中,表达的HO-1促进新生血管并改善细胞凋亡[19]。肾脏会遇到不同的毒素,既有外源性的,也有内源性的。游离血红素是诱导氧化应激并最终导致HO-1表达的主要分子。已经观察到HO-1的表达发生在肾间质、近端小管、肾单核巨噬细胞和肾小球等不同的亚结构中,作为对损伤的反应[20]。HO-1的表达与动物IRI后肾功能的恢复有关[21]。
然而迄今为止,HO-1在骨骼肌损伤,尤其是急性骨筋膜室综合征中的相关研究较少。本研究通过二代高通量测序比较发生骨筋膜室综合征和未发生骨筋膜室综合征的基因表达差异,运用生物信息学方法分析HO-1mRNA 在骨筋膜室综合征中的表达及临床意义。然后通过RT-qPCR技术验证HO-1mRNA的差异表达,利用GO富集分析和蛋白质-蛋白质相互作用(PPI)网络分析探索急性骨筋膜室综合征发生后,HO-1具体相关作用方向,初步探讨 HO-1参与急性骨筋膜室综合征的潜在分子机制。
1 材料和方法
1.1 试剂和仪器
提RNA试剂盒、cDNA 逆转录试剂盒和实时荧光定量PCR(RT-qPCR)来自生工生物工程(上海)有限公司;美国Thermo Fisher公司的NanoDrop微量核酸蛋白分析仪;美国Thermo Fisher公司的7500实时荧光定量PCR仪。
1.2 建立动物模型
1.2.1 急性骨筋膜室综合征动物模型
包括:结扎部分和监测部分。结扎部分包括:棉线和血管钳。棉线用于扎住大鼠的大腿根部,血管钳有助于结扎打结时固定;监测部分包括:头皮针(8#),一次性输液器,生理盐水(100 mL/瓶),一次性压力传感器(PX2600YZB/USA 3717-2015),心电监护仪(如:迈瑞 115-021306-00/PHILIPS)。头皮针与生理盐水通过一次性输液器连接在一起,然后与压力换能器通过三通管相连,压力换能器与心电监护仪相连,通过心电监护仪读取ICP和舒张压(diastolic blood pressure,DBP),即可计算△ p(△ p=DBP-ICP)。
1.2.2 急性骨筋膜室综合征模型建立过程
a.400-500gSD大鼠,实验前12h动物禁食,不禁水;
b.实验时,大鼠称重,腹腔内注射水合氯醛麻醉,水合氯醛浓度10%,用量30-50mg/kg实验期间水合氯醛维持麻醉状态;
c.在大腿根部用软尺测量膝关节周长C1,用棉线靠近根部扎住大腿来阻断下肢血流,用血管钳协助固定打结,使结扎后的大腿根部周长为C2=C1×1/2;
d.△p具体测量步骤如下。
给大鼠下肢剃毛,常规消毒后,取大鼠踝关节上方1cm部位作为穿刺点,行斜45°穿刺、按照垂直测压方法测压,直至水柱平衡并通过三通管暂时关闭水柱;
用垂直水柱测压装置与压力换能器通过三通管相连,压力换能器通过心电监护仪电缆线与心电监护仪相连,将压力换能器放置于被测肢体同一水平并调零;
打开三通管将垂直水柱与压力换能器相通,通过心电监护仪读取ICP;
使用留置针行颈动脉穿刺,留置输液软管在颈动脉内,用同样的方法监测DBP;
计算△p 。
先观察12h,若其间△P<30mmhg,持续时间>2h,则视为模型建立成功,可确诊ACS的发生,若12h后仍达不到△P <30mmhg,则在第一次结扎的相同位置进行第二次结扎,使结扎后的大腿根部周长为C3=C1×1/2;然后继续监测直至△P <30mmhg,持续时间>2h。
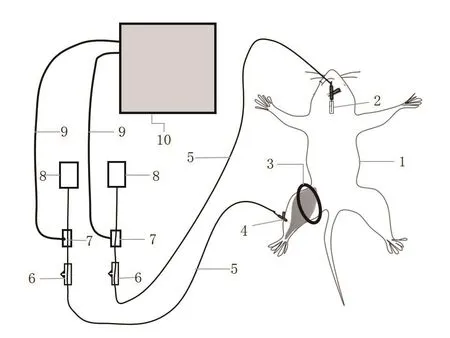
图1 动物模型的结构示意图
1.3 实验分组
实验分为2组:实验组和对照组,实验组给予造模处理,对照组不做任何处理。
1.4 测序分析
实验组和对照组各2只大鼠,当实验组大鼠△P <30mmhg,持续时间>2h,诊断ACS的发生,造模成功。取大鼠小腿的趾长屈肌,做二代高通量测序。总RNA是使用miRNeasy Mini Kit (德国)提取的。cDNA文库构建和测序是使用Illumina HiSeq2000测序仪在上海生物技术公司(中国上海)进行。由此产生原始测序片段被映射到Sscrofa11.1的参考基因组上。转录本的表达以FPKM(Fragments Per Kilobase of exon model per Million mapped reads)来量化。使用EdgeR鉴定了基因的差异表达水平[22]。使用q-Value BioConductor软件包,通过控制FDR(False Discovery Rate),对基因的差异表达的P值进行调整。p值为≤0.05且倍数变化≥2的基因被定义为差异表达基因(differentially expressed genes,DEGs)。使用ClusterProfilerR软件包对DEGs进行GO功能富集分析和KEGG途径富集分析。如果p值≤为0.05时,这些条目被认为是显著丰富的。
1.5 蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络分析
使用STRING在线工具(https://string-db.org/cgi/input.pl))构建置信分数>0.4的DEGsPPI网络[23,24]。然后,我们将HO-1基因和其相关基因的数据导入Cytoscape(版本3.6.0,http://chianti.ucsd.edu/cytoscape-3.6.0/)来分析它们及其编码蛋白的相互作用关系,并进行可视化处理。
1.6 RT-qPCR法测定
实验组和对照组各5只大鼠,当实验组大鼠△P<30mmhg,持续时间>2h,诊断ACS的发生,造模成功。检测HO-1的基因表达水平,根据生工生物工程试剂盒说明书提取大鼠小腿的趾长屈肌总RNA并测定浓度,通过使用cDNA转录试剂盒反转获得cDNA。参照qPCR试剂盒的操作说明进行qPCR产物扩增,使用2-∆∆Ct法实现相对基因表达水平的分析,并将基因表达水平标准化为β-actin,计算HO-1mRNA表达量。qPCR反应程序(三步法):预热期:95℃ (30s);循环期:95℃ (5s),60℃ (34s),共循环 40次;溶解期:95℃ (15 s),60℃ (60 s),95℃(15s)。引物购自生工生物工程股份有限公司,具体如下:β-actin 上 游 : 5’-CGTAAAGACCTCTATGCCAACA-3’,下 游:5’-AGCCACCAATCCACACAGAG-3’;HO-1上 游:5’-TTTCACCTTCCCGAGCATC-3’, 下 游 :5’-TCTTAGCCTCTTCTGTCACCCT-3’
1.7 统计学分析
使用SPSS 26.0软件对数据进行统计分析,使用秩和检验比较RT-qPCR中实验组和对照组的HO-1mRNA表达差异从而得出P值,如果P<0.05,则认为差异有统计学意义。
2 结果
2.1 差异表达基因(DEGs)的鉴定与功能富集分析
基于实验组和对照组的测序数据,我们获得了1915个DEGs。和对照组相比,实验组中780个上调基因,1135个下调基因(详见附件1)。在图2中,热图和火山图显示这些基因是有明显差异表达的(图2A,2B)。图2C和2D中显示了GO富集和KEGG富集分析结果。在实验组中,差异基因HO-1表达上调(图2E),表2(详见附件2)显示HO-1富集的GO条目:过氧化氢的反应、缺氧的反应、活性氧的反应、细胞金属离子的反应、细胞氧化应激的反应、防御反应、细胞脂质代谢过程。其中显示201个DEGs富集在防御反应,51个DEGs富集在氧化应激反应。这些结果提示急性骨筋膜室综合征中HO-1表达升高可能与防御反应和氧化应激生物过程有关。

图2

表1 HO-1相关的GO条目
2.2 蛋白质-蛋白质相互作用(PPI)网络分析
为了进一步研究在急性骨筋膜室综合征中HO-1参与的机制,根据STRING数据库中的数据,建立了一个PPI网络。我们从中筛选出HO-1与其相关基因进行分析,使用Cytoscape进行可视化处理,总共有59个节点和58个关系对(图3)。结果发现这些基因大多在防御反应和氧化应激GO条目中富集。这又一次说明,在急性骨筋膜室综合征中HO-1参与的机制可能与防御反应和氧化应激方面有关。
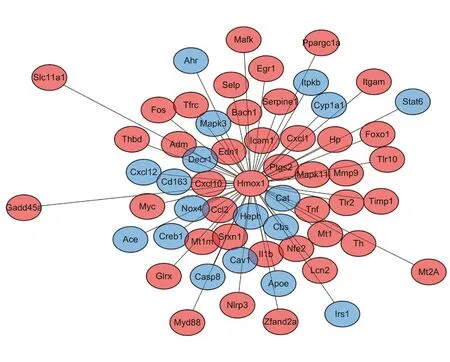
图3 HO-1(Hmox1)与相关基因的PPI网络
2.3 RT-qPCR技术在基因表达分析中的验证
从测序结果中,我们发现HO-1是DEGs之一,我们利用RT-qPCR技术验证HO-1mRNA 在实验组和对照组中的表达差异。与对照组相比,HO-1mRNA在实验组中的表达确实显著上调(P<0.01,图4)。根据测序和RT-qPCR数据得到的转录水平是一致的,从而证实了测序信息是可靠的,以上结果初步表明 HO-1可作为诊断急性骨筋膜室综合征的潜在分子标志物。

图4 HO-1mRNA的相对表达倍数
3 讨论
ACS被认为是一种骨科急症,参与抢救的外科医生应提高警惕,严格掌握筋膜切开术的适应证。面对患者的病史,应特别注意损伤机制,创伤病因分类是治疗的关键。如果延误诊断和治疗,可能会导致肢体和生命危险的结局。因此,有必要进一步探索ACS的发生、发展机制及寻找可靠的诊断分子标志物。由于高通量测序技术的出现,生物信息学领域得以快速发展。多年来,它一直是生物医学研究中不可或缺的一部分,大量的基因组学信息正在丰富积累,生物医学研究的“大数据”时代已经到来[25,26]。然而,HO-1在ACS的发病机制中尚不完全清楚。为了深入了解HO-1在肌肉组织发病过程中相关作用方向,我们进行了测序分析。我们知道ACS的发生、发展与筋膜室内压升高、缺血缺氧密切相关。本研究通过测序发现,ACS的肌肉组织中HO-1mRNA显著上调,PCR证实了HO-1在转录水平高表达作为潜在诊断标志物这一结果,这使我们的研究更具说服力。
根据测序结果中GO富集条目可知,ACS中HO-1表达升高可能与防御反应和氧化应激等生物过程有关。在防御反应方面,具有保护作用的酶HO-1会广泛参加机体组织的抗炎症反应,并在早期发生效应[27]。在缺血缺氧条件下,它可以调控下级通路,使受损伤的脏器得以被保护。另外,发现了骨骼肌HO-1的新作用,是它稳定了缺氧诱导因子 -1α(Hypoxia-Inducible Factor-1α,HIF-1α)并促进了有效的葡萄糖利用,从而限制了缺血引起的组织坏死[9]。研究表明,HO-1可以保护骨骼肌免受损伤,而缺乏HO-1则会增加骨骼肌缺血时的细胞凋亡。HO-1可能被认为是限制肌肉损伤强度的一个因素[28]。外源性HO-1表达促进大鼠和小鼠后肢缺血模型中血流的恢复。肌肉生长可以通过HO-1介导的机制促进后肢缺血的血管生成。丝氨酸/苏氨酸激酶(Akt1)介导的肌肉生长通过增强邻近内皮细胞和巨噬细胞中HO-1的表达来促进缺血性病变中的血流恢复[8]。骨骼肌的特点是耗氧量高,因此具有抗氧化特性的酶在这种组织中被证明是有保护作用的[29]。在氧化应激方面,在HO-1活性强烈增强和血红素大量供应的条件下,释放大量的活性铁,铁离子通过与过氧化氢发生Fenton反应促进了氧自由基的产生,其中羟自由基最具有破坏性,其不仅能够在体内与其邻近的分子发生急速反应,同时还能够促进与细胞的脂质成分发生过氧化生成大量脂质自由基,同时有大量ROS产生,导致细胞内稳态紊乱[30],这就是铁依赖性的脂质过氧化死亡即铁死亡。一方面,Adedoyin等[31]认为:Erastin可以引起肾小管上皮细胞发生铁离子依赖的脂质过氧化反应造成的组织细胞死亡,在这个过程中,HO-1可以抑制铁死亡反应。Sun等证实,在Erastin处理的肝癌细胞中诱导HO-1对铁死亡有保护作用[32];而另一方面,Kwon等[33]认为在Erastin引起的成纤维肉瘤细胞发生铁死亡过程中,HO-1抑制剂却能够减轻这种死亡程度,这侧面说明了HO-1促进了铁死亡反应,原因是HO-1产生的铁会导致细胞内铁过载。在铁死亡过程中HO-1表达的这些不同的结果可能表明:HO-1在铁死亡中的作用与所处环境和细胞类型相关。重要的是,不加控制的HO-1过度表达会导致严重的细胞毒性作用。因此,HO-1对骨骼肌细胞的效应可能与HO-1的表达量有关:轻中度表达表现为保护作用,高度表达导致坏死。通过控制该蛋白的表达来创造一个有益的阈值似乎是获得治疗效果的关键。另外,ROS是机体缺血性损伤中重要的引起因素[34]。ROS堆积过量,与不饱和脂肪酸作用从而引起过氧化反应。因此,降低ROS的量可以成为治疗缺血性损伤的手段。这为后续的深入研究奠定了基础。
综上所述,HO-1mRNA在ACS中高表达,且与ACS 发生有一定相关性。因此,临床上通过检测肌肉组织中HO-1mRNA的表达,或许能够作为一种早期辅助诊断ACS患者的新型分子标志物。本研究亦有不足之处,尽管通过测序发现了HO-1在ACS中潜在作用及价值,但PCR仅能提供基因在转录水平的验证,这可能与蛋白水平的表达不完全一致。此外,HO-1在铁死亡中的作用与所处环境和细胞类型相关,HO-1对骨骼肌细胞的效应可能与HO-1的表达程度有关,HO-1在ACS中导致骨骼肌坏死具体作用机制仍不明确,可能与铁依赖性的脂质过氧化死亡,即铁死亡有关,这一发现为进一步探讨HO-1介导铁死亡的分子机制提供了理论基础。需要扎实的基础研究来探索其参与ACS发生、发展的分子机制及相关信号通路。

