基于血流储备分数的血运重建策略对不同部位冠状动脉病变预后的影响
李全 杨帮国 叶益聪 赵昔良 曾勇
左前降支(left anterior descending,LAD)提供左心室心肌近一半的血液供给,与其他部位病变相比,左前降支近段(proximal left anterior descending,pLAD)病变对冠心病患者的预后影响较大,所以这个部位的血运重建策略一直都是各类临床研究关注的重点[1-2]。经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)是血运重建治疗的主要方式之一。有研究显示,近段病变、LAD等因素是相关治疗策略临床预后的危险因素[3];而PROTECT研究[1]显示pLAD病变与其他部位病变PCI术后的临床预后无明显差异。上述研究结论不一致,说明不恰当的血运重建策略与不良的临床预后相关[4]。众多研究显示血流储备分数(fractional f low reserve,FFR)能够指导稳定性冠心病及急性冠状动脉综合征PCI治疗策略,有效降低不良事件发生率[5-6]。DEFER研究[7]5年随访结果显示,FFR指导下行PCI的患者,无论其FFR值为多少,预后不如FFR≥0.75药物治疗的患者。由于样本量有限,该研究没有对不同靶病变治疗的预后进行比较。基础研究显示,无明显动脉粥样硬化的三支主要的冠状动脉血管基础FFR值是不一致的[8]。而目前的临床实践中推荐使用统一的界值指导PCI,故需要进一步探讨其特定部位的应用价值。然而,基于FFR的血运重建策略在不同靶病变中对预后影响的研究较少,目前尚不清楚是否会受到不同靶病变部位的影响而出现不同的临床结局。本研究旨在探讨基于FFR的血运重建策略对pLAD病变和非pLAD病变患者预后的影响。
1 对象与方法
1. 1 研究对象
本研究是单中心的回顾性观察性研究。纳入自2013年1月至2017年3月在首都医科大学附属北京安贞医院接受FFR测量的所有冠心病患者946例。纳入标准:(1)至少有一支冠状动脉主要分支进行FFR检测的冠心病患者;(2)所有行FFR检测的血管均满足“FFR>0.80的冠状动脉病变行药物治疗;FFR≤0.80的冠状动脉病变行PCI”的条件[9]。其中有328例患者被排除,排除标准:(1)仅非原发病变行FFR测量(如支架内再狭窄);(2)手术策略选择行冠状动脉旁路移植术的患者;(3)FFR>0.80行PCI或FFR≤0.80行药物治疗的患者;(4)仅PCI后行FFR检测的冠心病患者;(5)病程小于1周的急性心肌梗死患者;(6)非FFR测量血管行PCI的患者;(7)资料缺失。
根据CASS(Coronary Artery Surgery Study)分类,pLAD被定义为处于左主干末端至第一对角支或第一间隔支(以更靠近段者为准)之间的血管[10]。纳入本研究的618例患者根据病变是否累及pLAD被分为两组:pLAD组定义为存在至少有1处病变累及pLAD的患者,共289例;非pLAD组定义为pLAD无病变且至少有1处病变累及非pLAD的患者,共329例。两组患者的冠状动脉病变的血运重建策略均基于FFR,若FFR>0.80行药物治疗,若FFR≤0.80行PCI。618例患者中pLAD-PCI组134例,pLAD-药物组155例,非pLAD-PCI组101例,非pLAD-药物组228例。本研究完全符合赫尔辛基宣言当中陈述的原则,并经北京安贞医院伦理委员会审核批准。
1. 2 FFR测量及PCI操作
所有计划接受PCI的病变术前均予以FFR测量:经肘正中静脉注射腺苷三磷酸140~180 μg/(kg · min),实现微循环最大充血状态,应用圣犹达公司的Radi Analtzer Xpress 数据分析仪和Pressure WireTM压力导丝进行FFR测量。术者依据FFR测量结果选择相应的血运重建策略。所有PCI流程均按照标准流程进行。
1. 3 药物治疗
所有患者均于PCI术前接受了双联抗血小板治疗:阿司匹林(100 mg、每日1次)联合氯吡格雷(75 mg、每日1次)或替格瑞洛(90 mg、每日2次)3 d以上,或术前负荷剂量的阿司匹林(300 mg)联合氯吡格雷(≥300 mg)或替格瑞洛(180 mg)。PCI术后患者继续服用氯吡格雷(75 mg、每日1次)或替格瑞洛(90 mg、每日2次)至少1年,并长期服用阿司匹林(100 mg、每日1次)。其中冠心病二级预防药物种类及剂量在医师指导下进行调整。
1. 4 随访方式及终点事件
患者的随访通过再住院及院外电话访问的形式进行。主要终点是主要不良心血管事件(major adverse cardiovascular event,MACE)的发生率,包括全因死亡、心肌梗死、非计划血运重建和卒中。次要终点是指主要终点中的单一事件。心肌梗死的诊断参照第4版全球心肌梗死通用定义[11]。
1. 5 统计学分析
数据的录入使用Epidata 3.1软件。应用SPSS 22.0(SPSS, Chicago,Illinois)软件进行统计分析。使用Graphpad Prism 6.02软件(Graphpad Software,La Jolla, California)进行制图。连续变量以均数±标准差或中位数及四分位数间距表示,组间比较采用Student t检验或Mann Whitney U检验。计数资料采用频数和率(%)表示,组间比较采用χ2检验、连续性校正或Fisher精确概率法检验。采用Kaplan-Meier法绘制生存曲线,其中统计学分析采用Log-rank检验。采用Cox回归分析对原始及校准后的不良事件风险进行比较,并将P<0.2的单因素纳入多因素模型进行分析。采用双侧检验,以P<0.05为差异有统计学意义。
2 结果
2. 1 患者的一般资料
共纳入618例患者,中位随访时间为21.0(17.0,29.0)个月,随访率为95.6%。其中pLAD组患者289例,随访率为97.2%;非pLAD组患者329例,随访率为94.2%。与非pLAD组相比,pLAD组患者年龄更大、左心室射血分数更高以及陈旧性心肌梗死患病率更低,差异均有统计学意义(均P<0.05),见表1。

表1 两组患者的一般资料比较
2. 2 靶血管的造影解剖学及PCI特征
与非pLAD组相比,pLAD组近段病变数、置入支架数、置入支架总长度从及左主干病变数更多,差异均有统计学意义(均P<0.05),见表2。
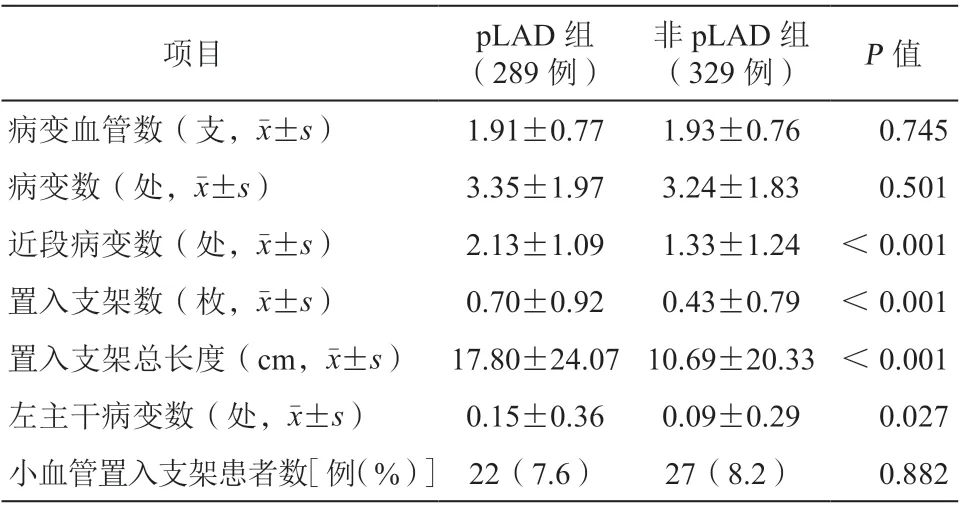
表2 两组患者靶血管的造影解剖学及PCI特征比较
2. 3 主要终点事件的Cox模型分析
随访期间,有40例患者发生了43例次MACE(3例全因死亡,5例心肌梗死,31例非计划血运重建,4例卒中)。采用单因素Cox回归模型对MACE的影响因素进行分析,结果显示:pLAD组、PCI、接受FFR测量血管数、病变血管数、病变数、近段病变数、置入支架数、置入支架总长度和小血管置入支架患者数均与MACE的发生率增加相关。经多元Cox比例风险回归模型计算,通过基于条件参数估计的后退法调整后,结果显示:pLAD组(HR 2.480,95%CI 1.26~4.87,P=0.008)和置入支架数(HR 1.546,95%CI 1.08~2.21,P=0.017)是MACE的独立预测因素,见表3。

表3 主要终点事件的Cox模型分析
2. 4 次要终点事件的单因素Cox分析
次要终点的分析中发现,相较于非pLAD组,pLAD组患者的非计划血运重建率更高(HR 2.949,95%CI 1.36~6.41,P=0.006),提示两组患者主要终点事件的差异主要来源于非计划血运重建,见表4。

表4 pLAD组患者与不同临床终点事件的关系
2. 5 各组主要终点事件的Kaplan-Meier生存曲线
Kaplan-Meier曲线显示,pLAD组的MACE发生率高于非pLAD组,差异有统计学意义(图1A)。pLADPCI组、pLAD-药物组、非pLAD-PCI组和非pLAD-药物组两两比较显示,pLAD-PCI组MACE发生率分别高于pLAD-药物组、非pLAD-PCI组及非pLAD-药物组,差异均有统计学意义(均P<0.05);其他两组之间的比较差异均无统计学意义(均P>0.05,图1B)。

图1 四组患者主要终点事件的Kaplan-Meier生存曲线
3 讨论
本研究比较了冠心病患者不同靶病变基于FFR的不同血运重建策略对临床预后的影响。结果显示,与非pLAD病变相比,pLAD病变患者的MACE发生率更高。同时,PCI术中置入更多支架与更差的临床预后相关。
pLAD是冠状动脉树的关键部位,临床实践中pLAD病变应该比非pLAD病变对预后的影响更大[2]。然而,目前的研究结论并不一致[1,3],而且缺乏基于FFR血运重建策略治疗不同靶病变的相关临床预后的研究。本研究结果显示,基于FFR指导的血运重建策略,累及p LAD的病变与较高的MACE发生率独立相关。结果提示在pLAD组和非pLAD组中,选用统一的FFR界值对两组患者进行血运重建策略后的临床结局可能会不一致,这与既往一些研究结果类似[3]。另外,更多的置入支架数量与更差的临床预后独立相关。DEFER研究[7]显示,PCI的患者较非PCI患者(FFR>0.8)预后更差。本项研究同样证实在真实世界中,即使在FFR指导下完成PCI血运重建,不仅PCI本身对预后有影响,而且支架置入的数量对预后也有独立影响,提示FFR指导血运重建策略的获益可能与减少支架的置入相关。这一结果不仅是对以往研究结果的扩展,同时提示冠状动脉病变的复杂性,仅依赖血流动力学指导血运重建具有其内在的局限性[12],需要更多的辅助措施来优化血运重建策略。
D EFER研究[7]显示PCI患者较非PCI患者预后更差,但没有进一步分析不同靶病变与不同血运重建策略的影响。本项研究补充分析了不同靶病变部位基于FFR的不同血运重建策略与预后的关系,亚组分析结果显示,四亚组中pLAD-PCI组的预后最差,两两亚组比较的临床结局均不如其他三个亚组,差异有统计学意义。而在非pLAD亚组与其他亚组比较中,基于FFR的PCI的临床结局和非PCI的临床结局相媲美。这个研究结果提示对于非pLAD病变,基于FFR的血运重建策略能够改善患者的临床结果,而pLAD病变不能。原因可能是:(1)研究显示,正常的冠状动脉三支血管远段的基础FFR值并不一样,LAD低于右冠状动脉和左回旋支,而右冠状动脉和左回旋支之间不存在差异。而且,PCI后的FFR值LAD常常低于其他两支血管[13]。(2)FFR界值的制定来源于单支动脉病变的检测及治疗,可能不适用于多支血管病变情况[14]。(3)两组患者基线资料提示pLAD组冠心病患者的病变复杂,导致血运重建策略复杂,这也是MACE发生的可能原因。
本研究的局限性:首先,本研究为单中心的回顾性观察性研究,尽管纳入连续的全部行FFR检测的冠心病患者,但研究本身的固有混杂因素及偏移无法完全排除,尤其研究纳入样本时间跨度较大,介入手段和介入器械的变化对于终点事件的发生存在影响;其次,本项研究纳入了所有类型的冠心病患者,不限于稳定型心绞痛患者,虽然可能影响部分结果,但反映了真实临床实践中FFR的使用,具有实用价值;再次,由于研究样本量和终点事件偏少,因此研究结果仍需将来大样本前瞻性研究来验证。
利益冲突所有作者均声明不存在利益冲突

