茶渣蛋白抗氧化肽制备及其活性研究
王南南,王靖蕊,李 璐,李 雁,解新安,2,*
(1.华南农业大学食品学院,广东广州 510642;2.广东省功能食品活性物重点实验室,广东广州 510642)
茶渣是茶叶生产加工过程的副产物以及茶场的废弃物。其中,茶蛋白含量占茶渣干20%~30%,且氨基酸组成丰富[1],研究发现,茶蛋白具有较好的功能,如降血压、降血糖、防辐射等[2−4],因此,茶渣蛋白具有较高的潜在利用价值。目前,茶渣的利用主要为做吸附材料、肥料和掺配饲料等[5−8],关于茶蛋白的研究主要是停留在研究茶蛋白的提取工艺及功能性质[9−14],而较少能基于已验证得到的茶蛋白的功能性质如降血压、抗衰老、抗疲劳等,进一步开发制备相对应的功能性茶多肽,尤其是从茶蛋白肽的活性与分子量之间的关系进行研究者甚少,这使得茶蛋白资源没有得到良好的开发利用。
据研究,从蛋白质中提取的活性肽,与其母体蛋白相比,具有更高的活性[15]。酶解法在蛋白多肽的制备工艺中应用最广泛,该法对蛋白质营养价值破坏小,生产条件温和、反应过程高效且可控。目前已采用酶法制备出多种动植物活性肽,如抗氧化肽[16],血管紧张素转化酶抑制肽[17−19]、降血糖肽[20]等。
本试验以课题组自制的茶渣蛋白为原料,采用胰蛋白酶对茶渣蛋白进行水解,通过响应面优化试验对酶解工艺进行优化,并对酶解液进行分离纯化,同时建立温度、pH、金属离子、食品添加剂、盐溶液等不同条件下的耐受实验和体外模拟消化实验探究多肽的活性,为茶渣的精深加工提供理论基础。
1 材料与方法
1.1 材料与仪器
茶渣 购自广州市馒头岭茶厂;茶渣粗蛋白实验室自制[21],纯度为(52.5%±0.03%);胰蛋白酶(10.17×104±5.30×103U/g)、风味蛋白酶(9.59×103±0.23×102U/g) 诺维信生物技术有限公司;复合蛋白 酶(12.41×104±7.25×103U/g)、碱 性 蛋 白 酶(6.53×104±1.46×103U/g)、木瓜蛋白酶(2.28×104±0.65×103U/g)、胃蛋白酶(1.2×103±0.55×102U/g)广州光华科技有限公司;以上试剂均为分析纯。
HH-2 数显恒温水浴锅 常州澳华仪器有限公司;DL-5 高速离心机 上海安亭科学仪器厂;FDEC-80 冷冻干燥机、HL-2B 恒流泵、BSZ-100 自动部分收集器、PHS-3C 数显pH 计 上海精科仪器厂;OAPMP220 超滤装置 美国PALL 公司。
1.2 实验方法
1.2.1 抗氧化肽提取工艺 茶渣蛋白粉按比例(m/v)加蒸馏水溶解,调节pH,加入蛋白酶进行酶解,反应完成后沸水浴10 min 灭酶活,然后在4000 r/min 离心10 min,调节上清液pH 至7.0,经1 μm 滤膜除杂,收集滤液经10、5、3 kDa 滤膜分离(室温),然后收集滤液与截留液分别进行冷冻干燥
1.2.2 蛋白酶筛选 选取胰蛋白酶、碱性蛋白酶、木瓜蛋白酶、风味蛋白酶和复合蛋白酶,在厂家推荐的最适温度和最适pH 条件下进行酶解,其他条件为底物质量浓度2.5%,加酶量6000 U/g,每隔0.5 h 取一次样,分别测定水解度和还原力。
1.2.3 酶解单因素实验 以还原力及其水解度为指标,考察底物浓度(0.5%、1.0%、1.5%、2.0%、2.5%)、加 酶 量(1500、2000、2500、3000、3500 U/g)、pH(7.0、7.5、8.0、8.5、9.0)、温度(40、45、50、55、60 ℃)、酶解时间(0.5、1、1.5、2、2.5、3、3.5、4、4.5、5 h)对茶渣蛋白酶解工艺的影响。固定考察因素底物浓度2 %,加酶量为4000 U/g,pH 8.0,酶解时间3 h,反应温度50 ℃。
1.2.4 酶解工艺优化 在单因素实验的基础上,选取加酶量、pH、温度三个影响因素,以还原力为考察指标,进行优化试验,确定酶解法制备茶渣蛋白抗氧化肽的最佳酶解工艺。响应面试验因素水平表见表1。

表1 响应面试验因素与水平Table 1 Variables and levels used for central composite design
1.2.5 水解度的测定 通常采用pH- stat 法,反应快速、直观[22]。水解度计算如公式:
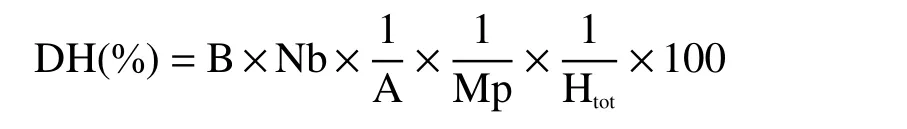
式中:B—碱液体积,L;Nb—碱液的浓度,mol·L−1;A—氨基的解离度,在本研究中,A 取1;Mp—底物中蛋白质总量,g;Htot—底物中蛋白质肽键总数,mol g−1蛋白质(对茶蛋白,htot=7.12)。
1.2.6 多肽抗氧化能力的测定 以还原力作为衡量多肽抗氧化能力的指标。操作步骤参照Shazly 等[23]的方法。
1.2.7 茶渣蛋白抗氧化肽的分离 按照1.2.4 得出的最佳酶解工艺对茶渣蛋白进行酶解,所得酶解液先经过1 μm 滤膜进行粗滤除杂,然后滤液依次通过截留分子量为10 、5 、3 kDa 的滤膜进行超滤。超滤条件:滤液(酶解液)浓度5%,pH7.0,压力 0.10 MPa,室温操作。按分子量分成四部分:分子量>10 kDa(简称为Tpep-1,下同)、5~10 kDa(Tpep-2)、3~5 kDa(Tpep-3)、<3 kDa(Tpep-4)。再经旋蒸浓缩,真空冻干。待测。
将上述所得样品溶于去离子水,配置成浓度为2 mg/L 的多肽浓缩液,参照文献进行抗氧化活性(还原力[23]、DPPH 自由基清除率[24−25]、对羟自由基清除率[26]、超氧阴离子清除率[25])的测定,筛选出活性较高的组分。
1.2.8 茶渣抗氧化肽的活性研究
1.2.8.1 温度对茶渣抗氧化活性的影响 以1.2.7 分离所得活性最高的组分,溶于100 mL 去离子水配制成1 mg/mL 的多肽溶液,并调节pH7.0,分别在30、40、50、60、70、80、90 ℃下放置5 h,每隔1 h 取样测定还原力。
1.2.8.2 酸、碱环境对茶渣抗氧化肽活性的影响 操作方法在刘文颖等[27]基础上稍作修改。准确称量1.2.7 步骤中所得活性最高的组分,加入100 mL 去离子水溶解,配成1 mg/mL 的多肽溶液,分别用盐酸和氢氧化钠溶液调节多肽溶液pH2.0、4.0、6.0、8.0、10.0,37 ℃保温2.5 h,每隔0.5 h 取样测还原力。
1.2.8.3 金属离子对茶渣抗氧化肽活性的影响 准确称取1.2.7 步骤中所得活性最高的组分,依次溶于金属离子浓度是0.1 mol/L 的Fe3+、Mg2+、Zn2+、Ca2+、Na+的溶液,室温静置2 d,取样测还原力。
1.2.8.4 食品添加剂对茶渣抗氧化肽活性的影响准确称取1.2.7 步骤中所得活性最高的组分,分别溶于质量浓度为2%的氯化钠、葡萄糖、蔗糖、可溶性淀粉、柠檬酸和苯甲酸溶液,室温静置2 d,取样测其还原力。
1.2.8.5 体外消化实验对茶渣抗氧化肽活性的影按照人体消化食物的顺序,先将样品置于胃蛋白酶环境中进行消化模拟,然后在置于胰蛋白酶环境下进行体外消化模拟试验。
第一步,样品胃消化过程时抗氧化活性研究(加入胃蛋白酶)[13,28]:取1.2.7 分离纯化后活性最强的组分,配置成2 mg/mL 的抗氧化肽溶液;接着盐酸调节肽液pH 至2.0,再加入样品含量5 %的胃蛋白酶,37 ℃水浴4 h,于第0、1、2、3、4 h 取样,水浴结束后100 ℃沸水浴灭酶5 min,待冷却至室温,测定还原力。
第二步,样品再经肠道消化过程的抗氧化活性研究(加入胰蛋白酶):取上述一定量经胃消化处理4 h 的消化液,用氢氧化钠调节pH 至8.0;加入按样品量5%的胰蛋白酶,37 ℃水浴继续消化4 h,分别于第5、6、7、8 h 取样,并在消化结束后置于100 ℃灭酶5 min,待冷却至室温,10000 r/min 离心15 min,取上清液测还原力[29]。
1.3 数据处理
数据分析采用Origin 9.2,Design-Expert 8.0.6和SPSS 19.0 等软件进行处理。所有试验均重复三次,取平均值。
2 结果与分析
2.1 蛋白酶筛选结果
从图1 中可以得出,五种蛋白酶对茶渣蛋白的水解度大小为胰蛋白酶>碱性蛋白酶>复合蛋白酶>木瓜蛋白酶>风味蛋白酶。从图2 可以看出,胰蛋白酶水解所得的产物还原力最高,在水解3 h 时还原力达0.250;而风味蛋白酶水解所得的产物还原力最低,水解3 h 后仅为0.112。结合图1 和图2,可以选择胰蛋白酶作为水解制备茶渣抗氧化肽的最适蛋白酶,其水解度和还原力均优于其他四种蛋白酶。王惠敏[30]筛选出胰蛋白酶作为酶解亚麻籽蛋白制备亚麻籽抗氧化肽的最适酶,且所得酶解产物的DPPH 自由基清除率最高;芦鑫等[31]在制备芝麻蛋白抗氧化肽时,同样选择胰蛋白酶作为最适蛋白酶,这均与本文的结论相似。说明胰蛋白酶适宜酶解植物蛋白,制备植物源抗氧化肽。
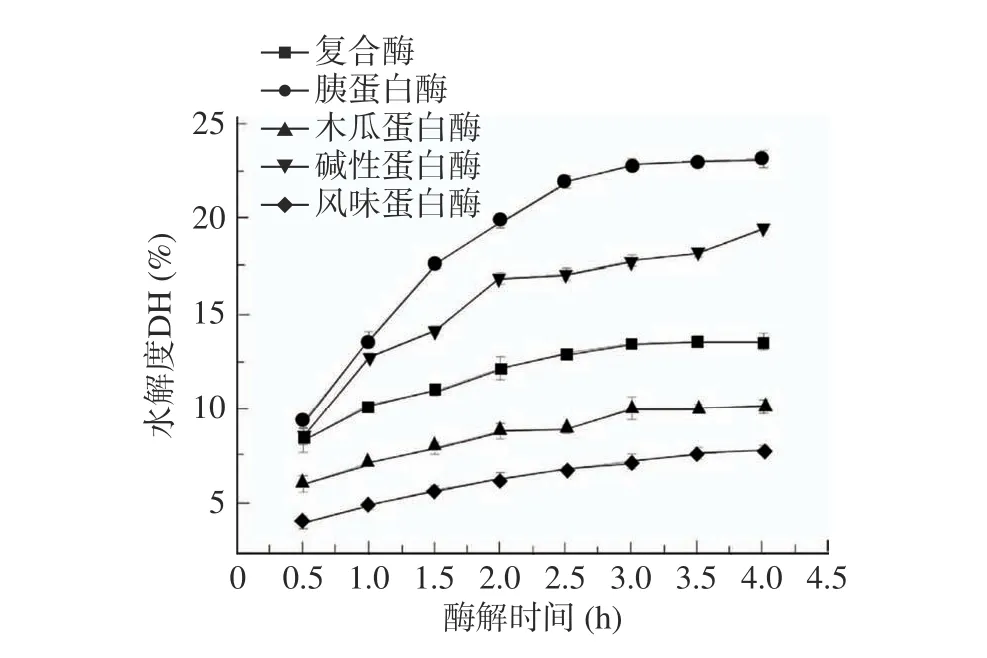
图1 不同蛋白酶处理对茶渣蛋白水解度的影响Fig.1 Effect of different enzymes on DH of tea residue proteins
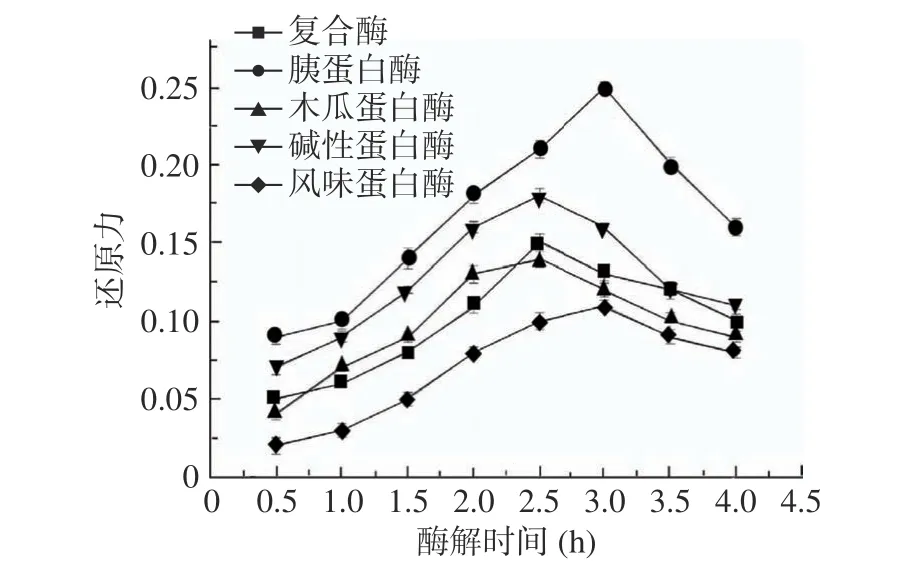
图2 不同蛋白酶处理对茶渣蛋白还原力的影响Fig.2 Effect of different enzymes on reducing power of tea residue proteins
2.2 单因素实验结果
2.2.1 底物浓度对酶解效果的影响 由图3 可知,当底物浓度小于2%,茶渣抗氧化肽的还原力和水解度均随底物浓度的增加而增加。这是因为刚开始底物浓度尚未饱和,酶与底物作用几率大,能产生较多的活性肽,且还原力最高可达0.260;当底物浓度大于2%,还原力和水解度开始降低。原因可能是,第一底物浓度已饱和,再增加底物浓度,酶解液粘度增大,部分酶被底物包裹,不利于酶与底物的接触[32];第二,随着底物浓度的不断增大,胰蛋白酶无法将底物充分酶解,进而酶解产物的还原力下降。因此,选择底物浓度2%较佳。

图3 底物质量浓度对酶解效果的影响Fig.3 Effect of substrate concentration on hydrolysis efficiency
2.2.2 加酶量对酶解效果的影响 由图4 可知,起先随着加酶量的增加,即1500~3000 U/g 阶段,还原力和水解度均呈上升趋势,且增长速度较快;加酶量为3000 U/g,还原力高达0.231;随后,继续添加蛋白酶从3000 U/g 到3500 U/g,茶渣抗氧化肽的还原力呈

图4 加酶量对酶解效果的影响Fig.4 Effect of enzyme dosage on hydrolysis efficiency
下降趋势,水解度变化趋于平缓。这是因为适量酶的添加有利于酶解反应的进行,生成抗氧化肽;过量的加酶量会造成茶渣蛋白的相对浓度降低,逐渐被酶饱和,所以3000~3500 U/g 阶段水解度增长减缓;同时酶解液中茶渣抗氧化肽可能会过度降解,进一步生成无活性的小分子,即表现为还原力的下降;综合考虑,选择加酶量为3000 U/g 较佳。
2.2.3 pH 对酶解效果的影响 结果如图5 所示。随着酶解pH 升高,水解度和还原力的变化趋势均为先增大后减小。pH 在7.0~8.0 之间,水解度不断增大,说明胰蛋白酶在此范围内可能拥有较好的活力,并在pH 8.0 时,水解度和还原力达到最大,分别为23.4%和 0.240;之后酶解pH 继续升高,而此时高碱性环境可能并不利于酶与底物蛋白的作用,影响了底物蛋白的解离状态[33]。因此,选择酶解pH 8.0 较佳。

图5 pH 对酶解效果的影响Fig.5 Effect of pH on hydrolysis efficiency
2.2.4 温度对酶解效果的影响 结果如图6 所示,温度从40 ℃上升到50 ℃的过程中,还原力和水解度不断变大,50 ℃时还原力最大为0.251,随后继续升温,水解度在55 ℃达到最大为23.7%,而此时茶渣蛋白和蛋白酶的特定空间结构正逐步遭到破坏[34],反应速度减慢,水解效率降低,表现为茶渣抗氧化肽的还原力显著减小。因此,选择酶解温度50 ℃较佳。

图6 温度对酶解效果的影响Fig.6 Effect of temperature on hydrolysis efficiency
2.2.5 时间对酶解效果的影响 结果如图7 所示,酶解前期,由于底物浓度较高加之胰蛋白酶活旺盛,水解度和还原力持续增大,并在3 h 时还原力到0.250;随着酶解的持续进行,茶渣抗氧化肽的还原力减小,这可能是抗氧化肽被水解成抗氧化活力较弱的片段[34];但4~5 h 还原力又出现小幅度上升,可能原因是新的蛋白活性基团暴露出来,使得整体的还原力又有所变化(且水解度仍在缓慢增长中)。综合考虑,选择酶解时间为3 h 较佳。
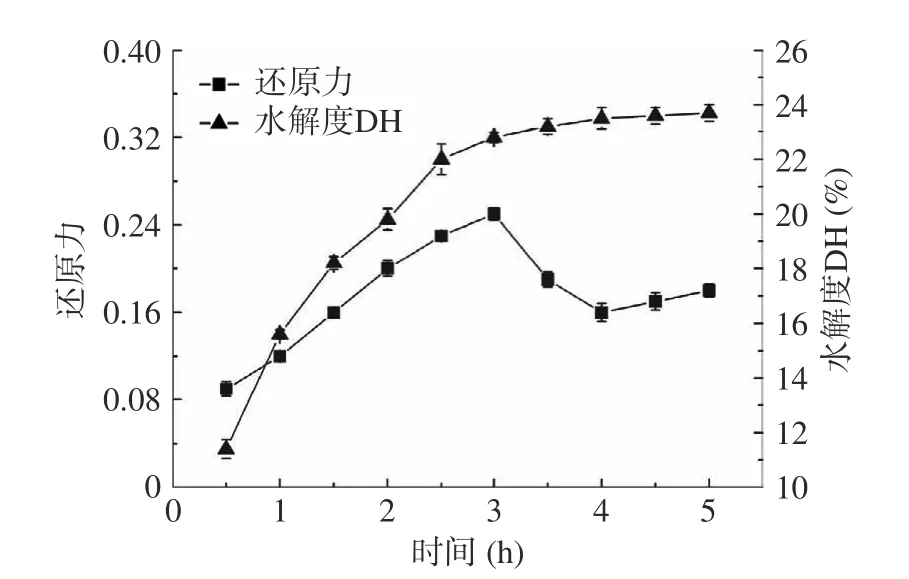
图7 时间对酶解效果的影响Fig.7 Effect of time on hydrolysis efficiency
2.3 响应面优化试验结果
根据单因素实验结果,以反应温度、pH 和加酶量为响应值,采用Box-Behnken 法进行酶解工艺优化。试验设计方案及结果见表2。

表2 Box-Behnken 实验设计及结果Table 2 Experimental design and results for Box-Behnken
对实验方案得出的17 组数据进行多元回归拟合,得到以茶渣蛋白多肽还原力为目标函数的多元二次响应面回归模型方程为:
Y=0.31+0.025A+2.500E−003B+0.015C+7.500E−003AB−7.500E−003AC−7.500E−003BC−0.068A2−0.023 B2−0.098 C2
对结果进行回归方差分析(表3),回归方差分析显著性检验表明此模型回归显著(P<0.0001),失拟项不显著(P=0.4740>0.1),与实际拟合较好。由Design-Expert 分析得出R2为0.9790,说明还原力变化有97.90%来源于温度、pH 和加酶量的的变化。一次项(A)和二次项(A2、C2)极其显著,说明pH 与加酶量对酶解效果的影响并非一元的简单线性关系。交互项AB 极其显著(P<0.01),BC 显著(P<0.05),说明各因素之间的交互作用很好。此外,各因素的F值能反映各实验因素对响应值的重要性,即F值越大,影响越大,即各因素对还原力的影响显著性大小顺序为:温度>加酶量>pH。综上所述,该模型拟合度较好,可用来进行酶解茶渣蛋白制备抗氧化肽工艺的优化。
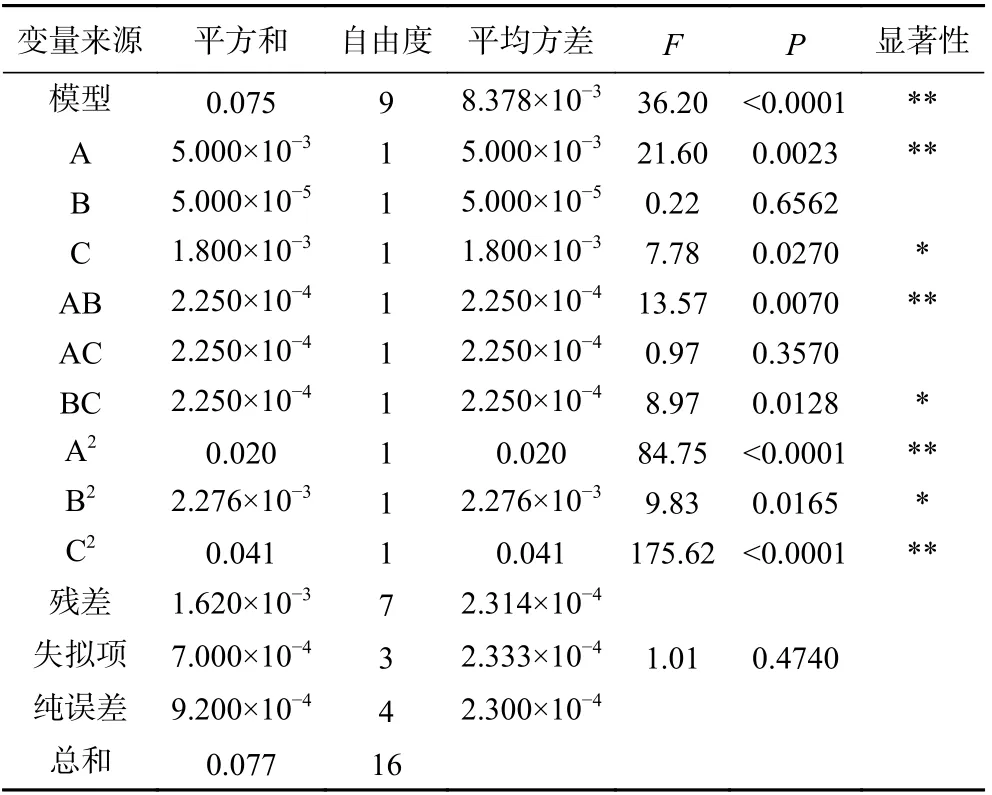
表3 回归方程方差分析表Table 3 Analysis of variance of regression model
从图8A 可以看到响应面坡度较陡,等高线图呈椭圆形,说明pH 和温度间的交互极显著,与表3 中AB 的P值相对应(P=0.007<0.01,极显著)。从图8B来看,响应面的坡度走势平缓,说明加酶量和温度间的交互作用不显著,与表3 中AC 的P值相对应(P=0.357>0.05,不显著)。从图8C 直观来看,响应面的坡度走势陡,说明加酶量和pH 间存在显著的交互作用,与表3 中BC 的P值相对应(P=0.0128<0.05,显著)。
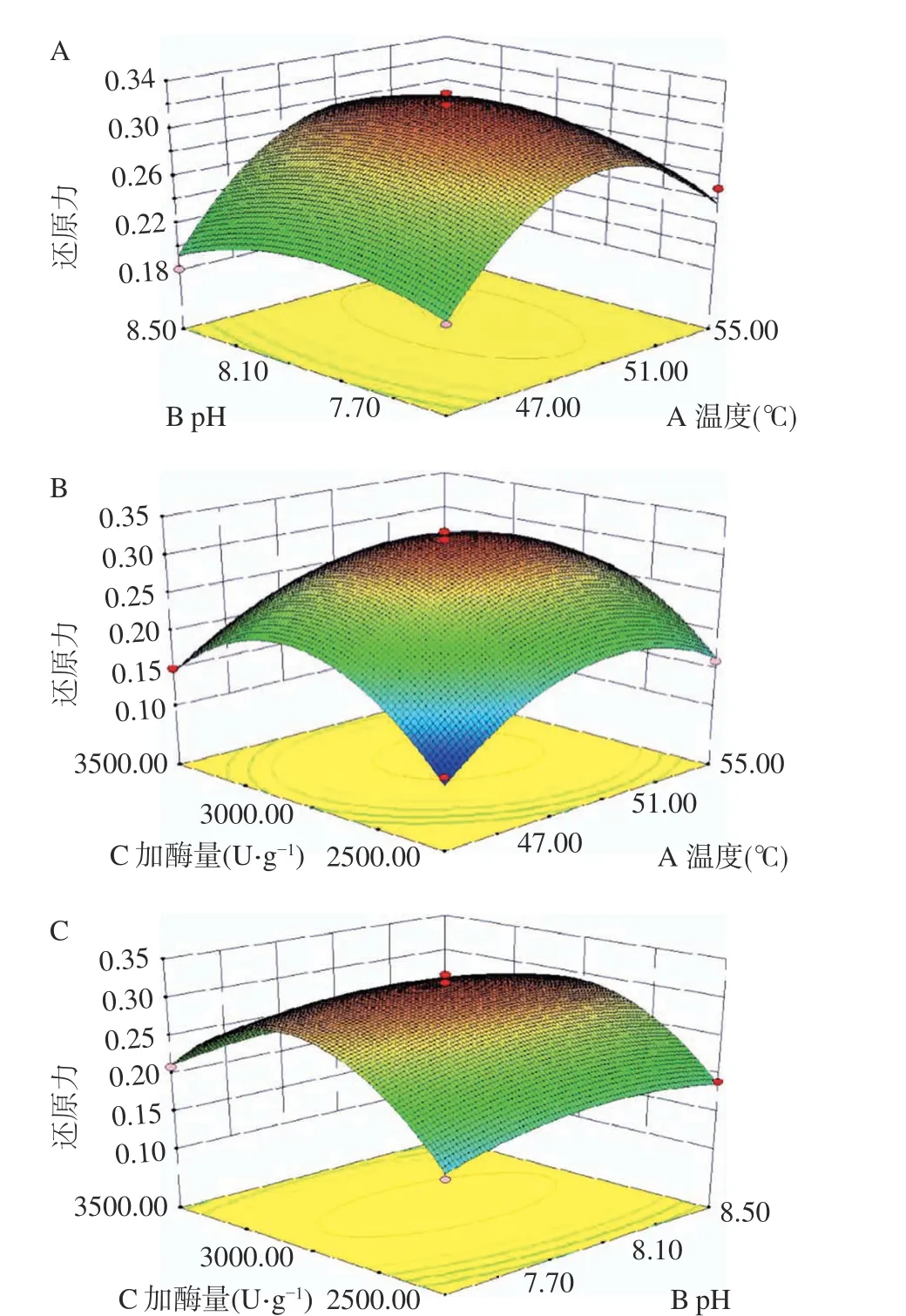
图8 各因素交互作用对还原力影响的响应面图Fig.8 Response surface plots showing the effect of interaction among various factors on reducing power
经分析得到酶解制备茶渣抗氧化肽的最佳工艺条件为:底物浓度2%、酶解时间3 h、温度50.92 ℃、pH8.04、加酶量3034 U/g,(考虑到实际操作,将对温度、pH 及加酶量的条件进行四舍五入取整,即温度51 ℃,pH8.0,加酶量3034 U/g)重复进行三次作为验证。得到茶渣抗氧化肽的还原力为0.316,与预测结果0.317 十分接近,表明回归模型可以较好地反应酶解制备茶渣抗氧化肽的工艺模型。
2.4 分子量对茶渣抗氧化活性的影响
本实验分别采用截留分子量段为10、5、3 kDa的超滤膜对茶渣抗氧化肽进行分离,得到>10 kDa(TPep-1)、5~10 kDa(TPep-2)、3~5 kDa(TPep-3)、<3 kDa(TPep-4)的四种组分,其抗氧化活性如表4所示。结果表明分子量< 3 kDa 的TPep-4,无论是还原力、DPPH 自由基清除率、·OH 清除率还是清除O2−的能力均优于分子量>3 kDa 的TPep-1 和TPep-2,说明小分子量范围的茶渣抗氧化肽具有更强的抗氧化活性[35]。其中,TPep-4 的DPPH 清除率为47.18%;对·OH 清除率为34.5%,与李永富[36]制备的同浓度的茶渣蛋白抗氧化肽相比,羟自由基清除率有较明显升高;对O2−清除率为56.70%;而与未经超滤的原液对比,TPep-4 的还原力由原来的0.316 提高到0.412,提高了30.38%。接下来对TPep-4 组分进行活性研究。
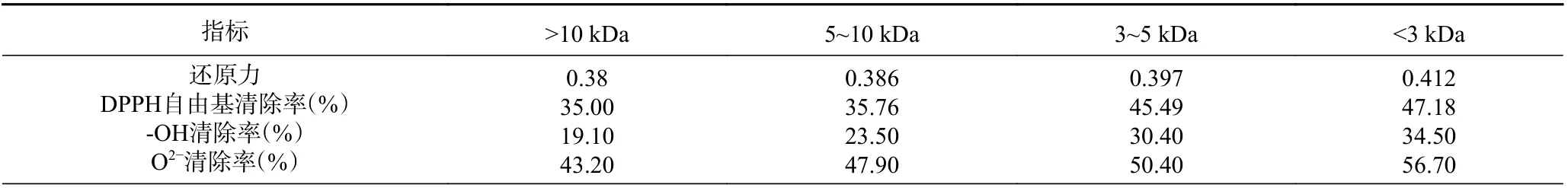
表4 不同分子量范围的茶渣抗氧化肽抗氧化活性Table 4 Antioxidant activity of tea residue antioxidant peptides with different molecular weight range
2.5 茶渣抗氧化肽的活性研究
2.5.1 温度对茶渣抗氧化肽活性的影响 如图9 所示,温度从30 ℃升温至90 ℃,随着时间的推移,Tpep-4 的还原力从初始的0.410 降低至0.360,减少了12.20%,仍保持着较高的抗氧化活性。其中,30~60 ℃时还原力随时间的波动不大;当温度范围在70~90 ℃时,还原力随着时间的延长,温度越高,降幅越大。这说明Tpep-4 在高温时仍有良好的抗氧化活性,但应避免长时间暴露在高温环境下。
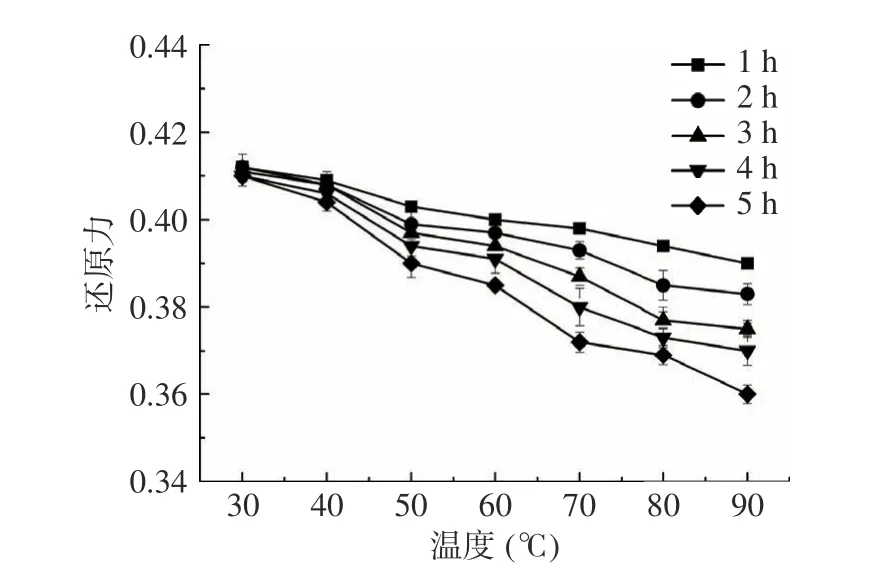
图9 温度对Tpep-4 组分的还原力影响Fig.9 The effect of temperature on the reducing power of Tpep-4
2.5.2 pH 对茶渣抗氧化肽活性的影响 强酸、强碱环境下,多肽易发生不可逆的变性,这是因为极端pH 将改变肽链中某些基团的解离程度,破坏维持多肽分子构象稳定性的氢键及某些带相反电荷基团因静电作用而形成的键(促进多肽分子的伸展),使其产生变性[37]。由图10 可知,pH 在2.0~10.0 间变化,Tpep-4 的还原力波动不大,并随着时间的推移始终保持在0.360 以上,即保持了良好的抗氧化活性。其中pH>8.0 时,Tpep-4 的还原力降幅相对大一些。且Tpep-4 在强碱(pH>8.0)的环境中越久,还原力越小。说明长时间处于强碱的环境中不利于茶渣抗氧化肽活性的稳定。
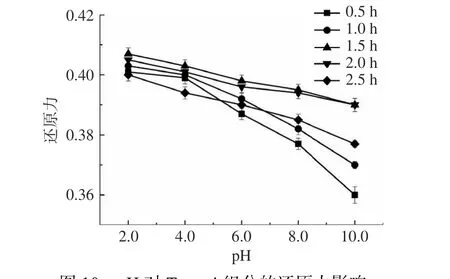
图10 pH 对Tpep-4 组分的还原力影响Fig.10 The effect of pH on the reducing power of Tpep-4
2.5.3 金属离子对茶渣抗氧化肽活性的影响 由图11可知,不同金属离子对Tpep-4 抗氧化活性的影响程度不同。其中,Zn2+的存在会削弱Tpep-4 的还原力,而Fe3+则对Tpep-4 的还原力起到一定的增强作用,Mg2+、Ca2+对还原力基本无影响。

图11 金属离子对Tpep-4 组分的还原力影响Fig.11 The effect of metal ions on the reducing power of Tpep-4
2.5.4 食品添加剂对茶渣抗氧化肽活性的影响 由图12 可知,6 种食品添加剂的分别加入均会造成Tpep-4 抗氧化活性的降低。其中柠檬酸对活性的削弱作用最明显,苯甲酸次之,氯化钠的影响最弱。而刘华勇[38]在热处理条件下加入蔗糖、葡萄糖等食品添加剂能加强辣木籽肽的抗氧化活性。说明不同处理条件对抗氧化肽的影响有所不同。
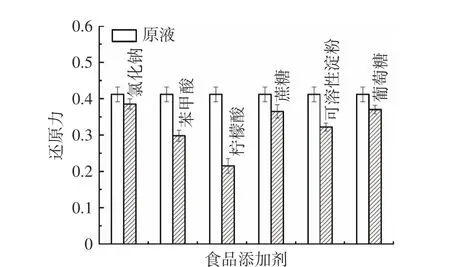
图12 食品添加剂对Tpep-4 组分的还原力影响Fig.12 The effect of food additives on the reducing power of Tpep-4
2.5.5 体外消化对茶渣抗氧化肽活性的影响 Tpep-4 经胃消化酶处理4 h 后,Tpep-4 还原力从原先的0.412 降至0.362(表5),这可能是因为在模拟胃液中的胃蛋白酶的作用下,Tpep-4 进一步进行酶解,生成了抗氧化活性较弱的片段。而后经肠道消化酶处理时,Tpep-4 还原力虽仍在下降,并在第8 h 降至0.327,但整体仍保持了良好的抗氧化活性。这说明茶渣抗氧化肽对消化具有一定的抵抗能力,有望后续进入血液循环并在生物体内发挥并维持良好的抗氧化活性。
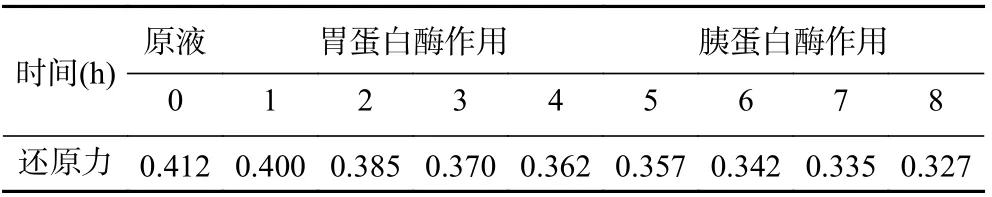
表5 茶渣抗氧化肽体外模拟消化实验结果Table 5 Results of in vitro simulated digestion of tea residue antioxidant peptides
3 结论
通过分析比较5 种不同酶制备的茶渣蛋白抗氧化肽的水解度和还原力,选取了胰蛋白酶进行后续的单因素试验和响应面优化试验。茶渣蛋白抗氧化肽的最优提取工艺是底物浓度2%、胰蛋白酶加酶量3034 U/g、pH 8.0、51 ℃、3 h,所得产物的还原力为0.316。
采用超滤法将酶解液分离成 >10 kDa(TPep-1)、5~10 kDa(TPep-2)、3~5 kDa(TPep-3)、<3 kDa(TPep-4)的四种组分,当茶渣蛋白抗氧化肽的分子量范围<3 kDa,还原力为提高到0.412,DPPH 清除率为47.18%,-OH 清除率为34.50%,O2−清除率为56.70%。
并且在不同温度和酸碱条件下,茶渣抗氧化肽始终保持较好的抗氧化活性;金属离子Zn2+、Fe3+对茶渣抗氧化肽的活性有较为明显的影响;食品添加剂对茶渣抗氧化肽的活性有削弱作用,其中柠檬酸钠的影响最大;茶渣抗氧化肽模拟体内消化试验显示,先后经过胃蛋白酶和胰蛋白酶的作用,茶渣抗氧化肽的还原力减少20.63 %,仍保持相对较好的抗氧化活性。本试验不仅使废弃的茶渣得到高质化利用,同时也减少了因茶渣废弃而导致的环境污染。

