骨密度检测在围绝经期妇女骨质疏松诊断中的意义
冯瑷琴 曹爱春
【摘要】目的:探究骨密度(BMD)检测在围绝经期妇女骨质疏松诊断中的价值。方法:选取围绝经期女性(40~55岁)486例,分为月经规律组(195例)、月经紊乱组(291例);另选取同期体检的非绝经期、围绝经期女性50例作为对照组,详细记录其身高、体质量指数(BMI)、病史、生化指标、激素水平等,使用超声骨密度仪检测桡骨远端BMD值,分析其桡骨远端BMD值变化及年龄、BMI、生化指标和内分泌指标与BMD的关系。结果:围绝经期月经紊乱组桡骨远端BMD低于对照组、月经规律组(P<0.05);486例围绝经女性中有253例(52.06%)出现骨量减少,骨质疏松症发生率为4.32%;BMD降低组BMI、维生素D3、血清钙、血清磷、E2水平均低于BMD正常组(P<0.05),年龄大于BMD正常组(P<0.05),LH、FSH水平高于BMD正常组(P<0.05)。结论:对围绝经期妇女进行BMD检测可尽早筛查出骨质疏松发生现象,骨质疏松的发生与年龄大、微量元素减少、雌激素水平降低有关。因此筛查出有骨质疏松发生风险的围绝经期妇女对预防相关骨折的发生有一定临床意义。
【关键词】骨密度;围绝经期妇女;骨质疏松;诊断
中图分类号:R445
文献标识码:A
文章编号:2096-5249(2021)02-0151-02
骨质疏松症为全身性骨代谢疾病,与年龄、维生素D缺乏、体质量指数(BMI)相关。骨质疏松症患者骨强度降低,骨密度(BMD)下降,使低能量创伤下骨折风险升高[ 1 ]。骨质疏松是骨折的重要危险因素,已成为引起中老年人死亡的第二大原因。研究表明[ 2 ],近年来我国骨质疏松发病率呈升高趋势,我国中老年骨量减少率约为38.5%,60岁以上女性骨质疏松患病率高达70%。女性由于怀孕、分娩、围绝经期导致骨量损耗,更易出现骨量降低,约50%骨质疏松女性出现骨折[3],对其生活质量产生严重影响。围绝经期女性体内性激素水平下降,骨组织微结构推广,骨代谢失衡,是骨量减少的高危人群。骨质疏松为可预防与治疗的疾病,但临床多数患者通常是在骨折发生时才被确诊为骨质疏松。因此,对围绝经期女性进行BMD降低的筛查有助于筛选出发生骨质疏松的高危人群,提前进行防治。本研究对围绝经期女性进行BMD检测,以探究BMD对骨质疏松的诊断价值,现报道如下。
1 对象与方法
1.1 研究对象
选取2018年1月至2020年11月门诊体检及住院患者的围绝经期女性486例,其中月经规律195例、月经紊乱291例。另选取同期体检的非绝经期、非围绝经期女性50例作为对照组。
纳入标准:(1)年龄40~55岁;(2)均未合并影响骨代谢、钙磷代谢的疾病,如糖尿病、甲亢、风湿性疾病、肿瘤等等;(3)均对本研究知情同意。排除标准:(1)近期服用影响骨代谢的药物;(2)已被确诊为骨质疏松症;(3)处于妊娠期或哺乳期。
1.2 方法
1.2.1 BMD检测:采用超声骨密度仪检测无骨折的非优势侧上肢桡骨远端(桡骨1/3处),将标准超声凝胶涂抹于受检者皮肤表面,确保探头与桡骨长轴平行,待凝胶与皮肤耦合后,检测超声传导速度(speed of sound,SOS)(m/S),由专业操作人员操作,系统测定误差低于0.3%。采用WHO推荐的T评分法评价BMD是否减少,围绝经期女性与同种族、同性别的健康成年人的SOS平均值比较(以人群标准差为单位表示),本研究纳入的女性均为汉族,研究对象的BMD值与同性别BMD峰值比较,T在-1.0?SD~-2.5?SD为骨量减少,T≤-2.5?SD为骨质疏松,T≥-1?SD为正常。
1.2.2 激素水平:于清晨空腹状态下采集3ml肘静脉血,分离血清,采用放射免疫分析法(RIA)检测促黄体生成激素(LH)、促卵泡激素(FSH)、雌二醇(E2)水平,采用高效液相色谱串联质谱(HPLCMS/MS)仪检测血清维生素D2、维生素D3。采用日立公司7180型生化分析仪检测血清钙、磷水平。
1.3 统计学处理

2 结果
2.1 BMD检测结果比较
围绝经期月经紊乱组处的上肢桡骨远端BMD低于对照组、月经规律组(P<0.05)。见表1。
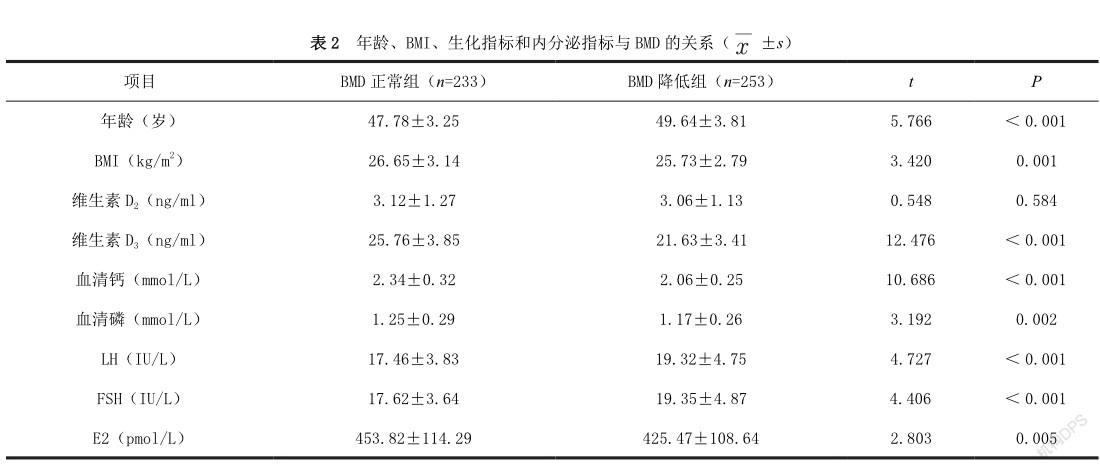
2.2 年龄、BMI、生化指标和内分泌指标与BMD的关系486例围绝经女性中有253例(52.06%)出现骨量减少,其中有21例(4.32%)为骨质疏松症。将其分为BMD正常组(n=233)与BMD降低组(n=253)。BMD降低组BMI、维生素D3、血清钙、血清磷、E2水平均低于BMD正常组(P<0.05),年龄大于BMD正常组(P<0.05),LH、FSH水平高于BMD正常组(P<0.05)。见表2。

3 讨论
围绝经期妇女会出现卵巢功能衰退,雌激素水平下降,并伴有神经心理症状[4]。围绝经期女性由于内分泌紊乱,性激素水平降低,易出现骨质疏松症。骨质疏松症主要表现为骨量减少,骨脆性增加,为中老年妇女常见疾病。既往报道显示[5],40岁以上女性大多处于低BMD状态,骨量减少率为38%,骨质疏松症发生率为4%。国外报道显示[6],印度40岁以上女性(平均年齡为46.54岁)低BMD发生率为40%,骨质疏松症发生率为4%。BMD是反映与评价骨量变化的重要指标,BMD测定敏感性高,无创伤。围绝经期以后的绝经状态与BMD恶化有关,骨质健康的下降始于围绝经期早期阶段。围绝经期妇女实施BMD检测有助于将尚处于潜在可治疗状态的病例筛查出来,是早期诊断骨质疏松症的重要方法。
本研究采用骨密度仪检测患者BMD,结果显示,围绝经期女性月经紊组的上肢桡骨远端BMD<正常组与月经规律组。月经紊乱提示雌激素代谢异常,临床研究表明[7],雌激素在骨代谢过程中发挥重要作用。本研究中BMD降低组妇女激素水平异常,主要表现为FSH、LH水平升高,E2水平均低于BMD正常组,LH、FSH水平高于BMD正常组。腺垂体分泌的FSH与LH可促进卵泡发育,围绝经期女性卵巢功能开始衰退,早期表现为雌激素分泌减少,无法抑制下丘脑与垂体,垂体FSH分泌量增加,而当月经周期紊乱,卵巢无排卵,则LH随之升高。FSH与LH处于高水平可抑制卵泡发育、卵子生长,而随着卵巢功能进一步衰退,会导致E2生成减少[8]。高水平的FSH与低水平的E2可加速骨丢失,是导致围绝经期女性发生骨质疏松症的根本原因。
本研究中BMD降低组BMI、维生素D3、血清钙、血清磷水平均低于BMD正常组。提示BMI、维生素D3、血清钙、磷水平与BMD具有一定相关。低BMD多发于中、低BMI患者中,较高的BMI有助于减少骨质疏松症的发生。原因可能在于,钙溶解于关节液内,机械负荷对软骨产生挤压作用,促进软骨吸收钙质,增加BMD而减少骨量丢失。此外,高BMI还可能与脂肪组织衍生雌激素,提高游离性激素水平有关。年龄是影响骨质疏松症发生的重要因素,研究表明,BMD与年龄呈负相关,年龄越大BMD越小。女性年龄越大,胃肠道对食物中钙质、磷质的吸收越差,使得发生骨质疏松风险升高。
综上所述,对围绝经期妇女进行BMD检测可尽早筛查出骨质疏松发生现象,骨质疏松的发生与年龄大、微量元素减少、雌激素水平降低有关。因此筛查出有骨质疏松发生风险的围绝经期妇女对预防相关骨折的发生有一定临床意义。但本研究选取的样本量较少,仅选取的我院接受体检的围绝经期女性,缺乏代表性,且影响骨质疏松症的因素较多,本研究并未将胎次、钙剂维生素的补充等纳入考察。因此后续仍需进一步扩大样本量,综合考量多种因素,探究影响骨质疏松症的因素,为提高其临床诊断准确性提供更有效的参考价值。
参考文献
[1] 刘国敏.更年期骨质疏松女性性激素与脂肪细胞因子、骨代谢生化指标的相关性分析[J].海南医学院学报,2018,24(2):220-223.
[2] 楊雪,汤玉萌,王春.中老年骨质疏松女性饮食行为及综合营养评价[J].中国食物与营养,2018,24(12):76-78.
[3] 刘语涵,李莉,梁德,江晓兵.围绝经期女性骨密度特点分析[J].中国骨质疏松杂志,2019,25(7):954-958.
[4] 吴杨乔,刘雁峰,李冰冰,梁嘉玲,徐秀丽,谢宝珍.围绝经期综合征情绪症状相关因素研究概况[J].中国妇幼保健,2019,34(8):1919-1922.
[5] 朱晓红,梁菊红,杨青娟,刘淑平.阿托伐他汀钙与低剂量雌激素联合治疗围绝经期女性骨质疏松的临床效果[J].贵州医药,2019,43(3):395-396.
[6] Chawla J, Sharma N, Arora D, et al. Bone densitometry status and its associated factors in peri and post menopausal females: A cross sectional study from a tertiary care centre in India[J]. Taiwan J Obstet Gynecol,2018,57(1):100-105.
[7] 吴逍恺,丁舒晨,夏俊杰.围绝经期妇女血清雌激素水平对骨质疏松疾病的预测价值[J].中国妇幼保健,2020,35(10):108-111.
[8] 唐晓红.300例围绝经期妇女骨量丢失减少现状调查及防范策略[J].黑龙江医学,2020,44(5):99-101.

