UbcH5B活性位点突变体对野生型E2传递泛素活性的影响
李 贞,李雨欣,赵 博
(上海交通大学 药学院,上海 200240)
0 引 言
蛋白质泛素化是一种重要的蛋白质翻译后修饰.在真核细胞中,泛素分子通过泛素活化酶(Ubiquitin activating enzyme,E1)、泛素结合酶(Ubiquitin conjugating enzyme,E2)和泛素连接酶(Ubiquitin ligase,E3)的级联反应,使底物带上泛素标签,此过程称为蛋白质的泛素化[1].蛋白质泛素化参与体内许多重要的生物学过程,如蛋白质降解、DNA损伤修复和信号转导等.
在人体细胞中,已发现的E2大约有40种,E2在蛋白质泛素化过程中发挥着重要的作用[2].E1启动泛素化过程,被E1活化的泛素分子与E1的活性Cys共价结合,形成硫酯结合物E1~Ub.E1~Ub与E2作用,将E1上共价结合的Ub传递到E2的活性Cys,从而形成硫酯结合物E2~Ub.E2~Ub与E3相互作用,将结合的Ub分子直接传递到底物或者先传递到E3的活性Cys,再传递到底物[3].E2都有一个保守的泛素结合域(Ubiquitin conjugating domain,UBC domain),UBC domain大约由150~200个氨基酸残基组成,包含一个可以结合从E1转移的Ub分子的催化活性Cys,以及与E1和E3结合的位点[4].E2活性Cys是E2发挥传递泛素功能的关键位点,若将其突变成Ala或者Val,E2与Ub将不能形成硫酯结合物E2~Ub[5].若将E2的活性Cys突变成Ser,则得到更加稳定的氧酯结合物E2-Ub[6].另外,除了活性Cys,E2上还有其他的位点对E2的活性有影响,有些E2(如UbcH5c)背面的保守Ser 22,若将其突变成Arg,则结合泛素的活性变弱[7].
除了在泛素传递中发挥桥接作用,E2对泛素链组装和泛素化调控也有重要的作用.如有些E2可以决定泛素链的连接类型,尤其是与RING家族E3合作传递泛素[8].有趣的是,E2的活性也受到调节.例如Ube2T靠近其催化活性位点的Lys可以在体内发生单泛素化,从而负调节范可尼贫血通路[9];UBE2S靠近催化中心的Lys发生自泛素化,抑制UBE2S活性Cys再次与Ub结合[10].但目前仍需要更深入研究E2活性调节,才能明确其真正分子机制和相关的生理作用.
另外,E2也参与一些疾病的进程,包括神经退行紊乱、免疫失调和癌症等[11].如E2-25K参与扩张的多聚谷氨酰胺蛋白的聚集形成,从而参与亨廷顿病[12].此外,Ube2T突变与范可尼贫血症有关[13],UBE2N和其合作的UBE2V1在恶性黑色瘤中高度表达,通过MEK/FRA1/SOX10信号通路促进黑色素瘤的生长[14].因此,靶向E2对于某些疾病治疗具有较大的发展前景.如使用靶向UBE2N的小分子抑制剂NSC697923,可以抑制黑色瘤的生长[14].因此,深入了解E2的泛素化活性调节不仅利于深入理解复杂的泛素化网络,而且促进靶向E2的疾病治疗.
为了更加深入了解E2泛素化活性调节,本文研究E2活性位点突变体对野生型E2传递泛素的影响.选择已报道与E1具有最高结合力的E2——UbcH5B[15],将其保守的催化活性位点Cys85突变成Ser,获得突变体UbcH5B-C85S.突变体UbcH5B-C85S可以结合从E1转移的Ub,形成比硫酯结合物E2~Ub更加稳定的氧酯结合物E2-Ub,并且结合的Ub较难以从突变体中解离,可能导致Ub分子不能传递到E3.在野生型E2参与的体外泛素转移反应中加入突变体UbcH5B-C85S,分别在E2和E3水平上分析突变体对野生型E2泛素转移的影响.
1 材料和方法
1.1 材料
PCR扩增野生型E2和突变体基因的引物由生工生物工程(上海) 股份有限公司合成,Taq DNA 聚合酶购自Toyobo公司,限制性内切酶NdeI、XhoI、NcoI、NotI、HindⅢ 和T4 DNA 连接酶购自NEB公司,pET28a和 pET28a-Flag载体由本实验室保存.E.coliXL1-Blue 及E.coliBL21(DE3)感受态细胞由本实验室制备.琼脂糖购自BIOWEST公司,质粒小提试剂盒和DNA凝胶回收试剂盒购自Omega公司.10 ~180 kDa彩色预染蛋白质marker购自Thermo Scientific,Western blot有关试剂购自生工生物工程(上海) 股份有限公司.Rabbit anti-HA antibody购自Abcam公司;Mouse-anti-Flag antibody购自Sigma-Aldrich公司;二抗Alexa Fluor 790偶联的anti-mouse-IgG购自Jackson Immuno-Research公司;Lysis buffer(50 mM Tris Base,500 mM NaCl,5mM 咪唑,pH 7.5);Wash buffer(50 mM Tris Base,500 mM NaCl,20 mM 咪唑,pH 7.5),Elution buffer(50 mM Tris Base,500 mM NaCl,250 mM咪唑,pH 7.5),透析缓冲液(25 mM Tris Base,150 mM NaCl,5 mM DTT,pH 7.5),泛素转移反应缓冲液TBS(20 mM Tris Base,150 mM NaCl,pH 7.5)等其余试剂由本实验室配制.
1.2 表达载体的构建
1.2.1 野生型UbcH5B、E2-25K和UbcH7表达载体的构建
使用含有UbcH5B、UbcH7和E2-25K基因的质粒及pET28a-Flag原核表达载体,分别利用酶切位点NcoI/HindⅢ、NcoI/NotI和NcoI/NotI 设计特异性引物(见表1),以含有UbcH5B、UbcH7和E2-25K基因的质粒为模板,PCR扩增得到野生型E2基因,经琼脂糖凝胶电泳分离后切胶回收.使用相应的限制性内切酶分别双酶切对应的目的基因和载体,酶消化后的载体经琼脂糖凝胶电泳分离后,与消化后的插入片段分别试剂盒回收.连接回收的目的片段和载体,然后将酶连产物电转化至E.coliXL1-Blue感受态细胞,将复苏的菌液涂布于LB/kan平板.37℃培养过夜,挑取3~5个新鲜的单克隆,小规模培养并提取质粒.双酶切鉴定重组质粒,并将阳性的重组质粒送至测序公司测序,最后比对序列.
1.2.2 突变体UbcH5B-C85S表达载体的构建
利用Overlap PCR 将UbcH5B的 Cys85突变成Ser.根据Overlap PCR原理,设计特异的上下游引物和包含突变位点的中间重叠引物(见表1).以包含UbcH5B基因的质粒为模板,分别扩增突变体的基因片段1和基因片段2,PCR扩增程序为94℃预热2 min,94℃变性30 s,60℃退火30 s,68℃延伸1 min,35个循环,最后68℃延伸10 min.将扩增得到的突变体的基因片段1和基因片段2进行重叠,按照上述PCR程序扩增 10个循环,然后加入上游引物和下游引物,再扩增 25个循环,得到突变体UbcH5B-C85S基因.使用NdeI和XhoI酶切UbcH5B-C85S 插入片段和pET28a载体,再根据1.2.1所述方法完成后续构建,最终测序鉴定是否实现定点突变.

表1 野生型UbcH5B、UbcH7和E2-25K及突变体UbcH5B-C85S表达载体构建使用的引物序列
1.3 蛋白表达和纯化
将成功构建的表达质粒pET28a-UbcH5B-Flag、pET28a-UbcH7-Flag、pET28a-E2-25K-Flag和pET28a-UbcH5B-C85S化学转化至E.coliBL21(DE3)感受态细胞, 涂布于LB/kan平板,37℃培养过夜,挑取1~2个新鲜的单克隆于LB/kan培养基中,培养至对数期,并转移至1 L LB/kan培养基,37℃培养.待培养菌液的OD600约为0.6,加入1 mM IPTG,16℃诱导表达过夜.次日离心收集菌液沉淀 (4℃,6 000 rpm,10 min),加入10 mL Lysis buffer充分重悬,冰上静置裂解30 min.高压破碎菌液后离心(4℃,12 000 r/min,30 min),收集上清.将含有可溶蛋白的上清液采用Ni-NTA 亲和层析柱纯化(重组蛋白的C末端融合His6标签).在上清液中加入1 mL Ni-NTA beads,4℃充分混合2 h. 将混合液加入干净的纯化柱中,静置30 min,加入10 mL Lysis buffer平衡,后加入10 mL Wash buffer 洗涤3次,最后用3 mL的Elution buffer洗脱目的蛋白.取5~10 μL蛋白洗脱液,加入5×SDS-PAGE上样缓冲液,95℃ 加热5 min,SDS-PAGE分离,考马斯亮蓝染色2 h,后脱色观察蛋白条带.蛋白洗脱液于4℃透析过夜,次日通过BCA法测定蛋白浓度,纯化的蛋白分装冻存于-80℃.
1.4 体外泛素转移分析
1.4.1 野生型E2与突变体的泛素反应活性检测
利用泛素转移反应(不含E3和底物)检测所表达的UbcH5B、UbcH7、E2-25K和UbcH5B-C85S与泛素的反应活性.50 μL反应体系中包括了20 μM HA-Ub、1 μM Ube1、10 μM E2、1 mM ATP和10 mM Mg2+.30℃ 反应2 h.加入还原(含有100 mM DTT)或者非还原(不含DTT)的5×SDS-PAGE上样缓冲液终止反应,样品于95℃煮沸5 min.取16 μL的样品于10% SDS-PAGE胶中进行分离,转膜结束后使用5%脱脂牛奶室温封闭1.5 h.使用含5% BSA的TBS,稀释anti-HA 抗体和anti-Flag抗体,4℃过夜孵育一抗.使用含5% BSA的TBS,稀释anti-Rabbit IgG抗体和anti-Mouse IgG抗体,在室温孵育二抗1 h.每次孵育抗体后使用TBS-T(0.1% Tween-20)洗膜4次,每次洗10 min.最终使用双色红外荧光成像仪扫膜分析.
1.4.2 E2水平分析突变体UbcH5B-C85S对野生型E2泛素反应的影响
为了探究UbcH5B-C85S 对E2水平的泛素转移反应的影响,在野生型UbcH5B、E2-25K、UbcH7与Ub反应体系中(20 μM HA-Ub、1 μM Ube1、10 μM E2、1 mM ATP和10 mM Mg2+),同时加入系列梯度浓度(0.5、1、5、10、20 μM)的UbcH5B-C85S,30℃反应1 h.加入5×非还原的SDS-PAGE上样缓冲液终止反应,然后SDS-PAGE分离和使用anti-Flag抗体进行Western blot分析.
1.4.3 E3水平分析突变体UbcH5B-C85S对野生型E2传递泛素的影响
为了探究UbcH5B-C85S是否影响野生型UbcH5B传递Ub到TRIM23,首先检测UbcH5B-C85S 是否参与TRIM23的自泛素化.在野生型UbcH5B与Ub反应体系中(2 μM HA-Ub、0.5 μM Ube1、2 μM UbcH5B、0.5 μΜ TRIM23、1 mM ATP和10 mM Mg2+),同时加入系列浓度梯度的野生型UbcH5B和UbcH5B-C85S,并使浓度总和为2 μM.另外,在UbcH5B的泛素转移反应中(2 μM HA-Ub、0.5 μM Ube1、2 μM UbcH5B、0.5 μΜ TRIM23, 1 mM ATP和10 mM Mg2+),加入UbcH5B-C85S(2 μM、4 μM、8 μM和16 μM),30℃反应10 min,加入5×还原的SDS-PAGE上样缓冲液终止反应,SDS-PAGE分离和使用anti-HA抗体进行Western blot分析.
2 结 果
2.1 野生型UbcH5B、E2-25K、UbcH7和突变体 UbcH5B-C85S的构建及表达
为了更加广泛地探究突变体UbcH5B-C85S对E2泛素化过程的影响,选取3个野生型E2——UbcH5B、E2-25K、UbcH7.分别将野生型UbcH5B、E2-25K、UbcH7基因构建到pET28a-Flag载体(C末端融合Flag和His6标签),UbcH5B-C85S构建到pET28a载体(C末端融合His6标签).PCR扩增UbcH5B、E2-25K、UbcH7基因(图1a),Overlap PCR定点突变得到突变体UbcH5B-C85S基因(图1b),这些插入片段和酶切后载体(图1c)均符合预期大小.通过双酶切(图1d)和测序鉴定重组质粒,最终确定成功构建野生型UbcH5B、E2-25K、UbcH7和突变体UbcH5B-C85S(图1e)的原核表达载体.

(a) PCR扩增E2-25K、UbcH7、UbcH5B基因;(b)重叠延伸PCR扩增UbcH5B-C85S基因;(c)使用限制性内切酶双酶切pET28a和pET28a-Flag载体(Ctrl 1:完整的pET28a质粒;Vector 1:酶切后的pET28a质粒;Ctrl 2:完整的pET28a-Flag质粒;Vector 2:酶切后的pET28a-Flag质粒);(d)双酶切鉴定重组质粒(Ctrl 1:完整的pET28a质粒;Ctrl 2:完整的pET28a-Flag质粒;P 1-4分别为双酶切后的重组质粒pET28a-UbcH5B-C85S、pET28a-E2-25K-Flag、pET28a-UbcH7-Flag和pET28a-UbcH5B-Flag);(e)UbcH5B-C85S与UbcH5B氨基酸序列比对.
将成功构建的UbcH5B、E2-25K、UbcH7和UbcH5B-C85S表达载体进行原核表达,并采用Ni-NTA亲和柱层析纯化.SDS-PAGE显示纯化后的UbcH5B、UbcH7、E2-25K和UbcH5B-C85S有明显的单一条带,其分子量与理论分子量接近,并且蛋白纯度超过90%(图2).这些结果证明成功表达UbcH5B、E2-25K、UbcH7和UbcH5B-C85S, 并且纯度较高.

图2 纯化后的野生型UbcH5B、E2-25K、UbcH7和突变体UbcH5B-C85S的SDS-PAGE分析结果
2.2 野生型E2和突变体UbcH5B-C85S的活性鉴定
为了鉴定表达的UbcH5B、UbcH7、E2-25K和UbcH5B-C85S的活性,利用体外泛素转移反应,通过Western blot分析E2与泛素反应的活性.由于E2与Ub的结合物可能对DTT敏感程度不同[16],因此,分别加入还原(含有100mM DTT)或者非还原(不含DTT)上样缓冲液终止E1-E2的泛素传递反应,并且分别使用anti-HA抗体和anti-Flag抗体进行Western blot分析.结果发现在还原和非原性条件下都显示UbcH5B-C85S与Ub形成氧酯结合物UbcH5B-Ub条带(图3a和图3b第6泳道).由于UbcH5B-C85S没有融合Flag 标签,因此使用anti-Flag抗体检测不到UbcH5B-Ub条带(图3c 和图3d).相似地,UbcH5B和E2-25K 在还原和非还原条件下都可以与Ub反应,并且出现明显的“ladder”条带(图3a、图3b、图3c和图3d的第4、10泳道).相比而言,在非还原条件下,UbcH7~Ub条带非常明显,也显示“ladder”条带(图3b),但在还原条件下几乎不显示UbcH7~Ub条带,说明UbcH7~Ub对DTT较敏感.这些结果证明表达的UbcH5B、UbcH7、E2-25K和UbcH5B-C85S都具有泛素反应活性.

注:E2与一个Ub分子结合的条带使用“★” 标记
2.3 突变体UbcH5B-C85S对野生型E2体外泛素反应的影响
突变体UbcH5B-C85S可以与Ub 形成更加稳定的氧酯化合物,若将其加入野生型E2的泛素反应中,有可能与野生型E2竞争结合从E1活性位点解离的Ub,从而可能抑制野生型E2与Ub的反应.另外由于UbcH5B、UbcH7、E2-25K在非还原条件下均可以检测到E2~Ub的条带,为验证以上推测,在非还原条件下使用anti-Flag抗体通过Western blot 分析UbcH5B-C85S对UbcH5B、UbcH7、E2-25K体外泛素反应的影响.在正常E1-E2的Ub转移反应中,分别加入系列浓度的UbcH5B-C85S,共同反应一段时间,通过野生型E2和E2-Ub条带的强弱变化,判断UbcH5B-C85S是否可以抑制野生型E2参与的泛素反应.
为了观察UbcH5B-C85S对野生型E2泛素反应的影响,加入20 μM UbcH5B-C85S后观察到UbcH5B~Ub条带变弱,而UbcH5B本身条带变强,表明UbcH5B-C85S对UbcH5B参与的泛素反应产生一定的抑制作用(图4a).类似地,E2-25K~Ub条带也变弱(图4b),但UbcH7~Ub条带没有明显变化(图4c).以上结果表明UbcH5B-C85S对这3个野生型E2参与的泛素化反应影响程度不同,当反应中加入UbcH5B-C85S的量为野生型E2的2倍,对UbcH5B和E2-25K的泛素化反应有部分抑制作用,但对UbcH7的泛素化影响较小.
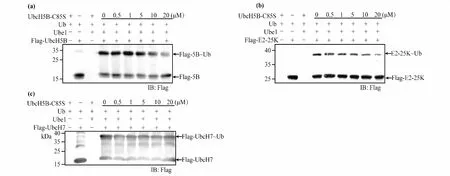
图4 UbcH5B-C85S部分抑制泛素传递到UbcH5B(a)和E2-25K(b),但对UbcH7影响较小(c)
2.4 突变体UbcH5B-C85S对野生型UbcH5B体外泛素传递的影响
为了进一步探究UbcH5B-C85S是否阻碍Ub从E2转移到E3,利用UbcH5B参与一个RING家族的 E3——TRIM23(分子量约为64kDa)的体外自泛素化[17].首先检测UbcH5B-C85S自身是否可以参与TRIM23的泛素化.通过逐渐减少野生型UbcH5B的量和逐渐增加突变体UbcH5B-C85S的量,并且保持两者总量为2 μM,结果显示TRIM23自泛素化的“smear”条带逐渐减弱.此外,当反应体系仅有UbcH5B-C85S时,几乎没有出现“smear”条带(图5a),即使反应中的UbcH5B-C85S为16 μM,也没有显示TRIM23泛素化的“smear”条带(图5b).这些结果证实UbcH5B-C85S不能将Ub传递到TRIM23.更重要的是,在野生型UbcH5B参与的TRIM23自泛素化反应中,加入16 μM UbcH5B-C85S(图5b和图5d),结果显示TRIM23自泛素化水平明显降低(图5b),表明UbcH5B-C85S抑制野生型UbcH5B参与TRIM23体外自泛素化.

图5 UbcH5B-C85S不参与TRIM23泛素化(a),但抑制UbcH5B 传递Ub到TRIM23(b);(c)与图(b)的等量相同反应体系的SDS-PAGE 分析结果
3 讨 论
在蛋白质泛素化过程中,E2可以结合来自E1的泛素分子,随后与E3合作将其传递到底物蛋白.随着对E2的深入研究,发现E2不仅在泛素化过程中作为中间传递者,而且在调节泛素化过程中也有重要的作用[18].如某些E2背面可以非共价结合另一个Ub分子,从而别构活化RING 家族E3介导的泛素传递[6].此外,有的E2在其UBC domain或者非保守的N末端或者C末端延展区发生自泛素化,从而抑制E2本身的活性[10, 18].但目前研究E2水平的泛素化反应调控仍然较少.
本研究选择与E1结合力较高的UbcH5B作为研究对象,将其催化活性的Cys85突变体成Ser,研究突变体UbcH5B-C85S是否可以调控泛素化.通过Western blot分析体外泛素转移反应,发现UbcH5B-C85S、UbcH5B和E2-25K在非还原和还原条件下都显示E2结合Ub的条带,但在还原条件下没有明显的UbcH7结合Ub的条带,表明UbcH7与Ub结合物可能对DTT更加敏感.当反应体系加入20 μM UbcH5B-C85S (野生型E2的2倍),在一定程度抑制UbcH5B和E2-25K与Ub反应,但对 UbcH7与Ub反应干扰较小,暗示UbcH7可能通过另外的机制调节其反应活性.由此推测,不同E2的泛素转移活性调节机制可能有差异.在UbcH5B-C85S不能将泛素传递到TRIM23前提下,将其加入UbcH5B参与的TRIM23体外自泛素化反应,当加入16 μM UbcH5B-C85S(UbcH5B 8倍),TRIM23的自泛素化受到损害,表明UbcH5B-C85S阻碍野生型UbcH5B传递Ub到TRIM23.
目前,我们主要在体外泛素转移反应中研究突变体UbcH5B-C85S对野生型E2泛素化的影响,为了更加深入理解E2的活性调节机制,我们将在体内(如细胞水平)研究突变体UbcH5B-C85S对野生型E2泛素化的影响.并且在相应的疾病模型中研究E2突变体对泛素转移活性的影响,将为与E2活性调控关联的疾病治疗提供一定的依据.
4 结 论
为了研究UbcH5B活性位点突变体UbcH5B-C85S对野生型E2传递泛素活性的影响,通过体外泛素转移反应,分别在E2水平和E3水平检测UbcH5B-C85S对野生型E2参与泛素化过程的影响,获得以下结论:
1) UbcH5B和E2-25K与Ub的结合物对DTT耐受,而UbcH7与Ub结合物则对DTT较敏感.
2) UbcH5B-C85S可以部分抑制UbcH5B和E2-25K与Ub的结合,但对UbcH7的泛素反应影响较小.
3) UbcH5B-C85S可以阻碍野生型UbcH5B参与TRIM23的体外自泛素化.

