提取方式对茶树菇菌糠多糖提取效率及生物学活性的影响
赵泽文 马雅静 潘起涛 杨政宁 刘 璇 程 新
(江西农业大学生物科学与工程学院/江西省农业微生物资源开发与利用工程实验室,江西 南昌 330045)
菌糠是真菌收获后的培养基剩余物,其内含有大量菌丝体以及丰富的糖、蛋白等生物大分子,有研究表明,每生产1 kg 食用菌,会产生5 kg 菌糠[1]。当前,随着食用菌需求量的不断增加,所产生的菌糠废料也越来越多。传统上菌糠处理的方法主要是简易堆置和燃烧[2],不仅会对环境造成一定的污染,而且会造成资源的极大浪费。因此,近年来,人们逐步开始将食用菌菌糠应用于堆肥生产[3]、动物饲料加工[4-5]、土壤改良[6]、制备新型能源材料[7]、食用菌的二次栽培[8]等领域,并取得了一定的进展。
目前,提取菌糠中的活性物质并将其加以利用日益成为研究的热点。菌糠多糖作为一种具有抗氧化[9-10]、免疫调节[11]的生物大分子物质,其提取工艺优化与应用在近年来被广泛研究。彭浩等[12]采用微波预处理,超声波辅助提取法提取香菇多糖,优化后多糖提取率可达7.16%,提取的多糖对1,1-二苯基-2-三硝基苯肼[1,1-diphenyl-2-picrylhydrazyl radical 2,2-diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl,DPPH]自由基和羟基自由基具有良好的清除能力;He 等[13]采用热碱浸提法从杏鲍菇菌糠提取的菌糠多糖,具有较强的2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸( diammonium 2,2′-azino-bis-3-ethylbenzothiazoline-6-sulfonate,ABTS)自由基清除能力;Zhu 等[14]采用浓硫酸法从冬虫夏草菌丝体中提取得到的新型硫酸多糖,表现出良好的抗氧化和抗肿瘤能力;Zeng 等[15]采用酸解法提取余甘子果肉多糖,所得多糖拥有良好的生物学活性,可用于免疫调节剂和自由基抑制剂。
茶树菇是一种极具开发潜力的珍稀食药用菌,目前其栽培数量和产品市场占有率已超过香菇[16],而大量茶树菇菌糠的废弃造成了严重的资源浪费和环境污染。为了更好地提高茶树菇菌糠的二次开发利用,延伸食用菌产业链,本研究比较了热水浸提、超声浸提和稀酸水解3 种不同方式对茶树菇菌糠多糖提取效率的影响,进而测定了不同提取方式制备的菌糠多糖抗氧化能力差异及其对水稻种子萌发的影响,并研究了多糖对铜胁迫条件下水稻种子萌发及抗逆性的影响,以期为茶树菇菌糠多糖在农业中的应用奠定基础。
1 材料与方法
1.1 试验材料
茶树菇菌糠由江西利康绿色农业有限公司提供,菌糠为泥炭状,颜色呈浅棕色,含水率41.07% ±2.72%,pH 值7.93±0.01,经烘干、粉碎、过40 目筛后备用。
1.2 试验设计
1.2.1 茶树菇菌糠多糖的提取 热水浸提法:取10 g菌糠,以蒸馏水作为溶剂,进行提取温度、料液比和提取时间对多糖得率影响的单因素试验。在料液比1 ∶30 g·mL-1、提取时间3 h 条件下,提取温度分别设为60、65、70、75、80、85、90、95℃;在提取温度75℃、提取时间3 h 条件下,料液比分别设为1 ∶10、1 ∶15、1 ∶20、1 ∶25、1 ∶30、1 ∶35、1 ∶40、1 ∶45 g·mL-1;在提取温度75℃、料液比1 ∶30 g·mL-1条件下,提取时间分别设为1.5、2.0、2.5、3.0、3.5、4.0、4.5 h。将多糖提取得到的浸提液于4 000 r·min-1离心10 min,取上清液测量其多糖浓度,计算菌糠粗多糖的提取率。
超声浸提法:取10 g 菌糠,以蒸馏水作为溶剂,进行提取温度、料液比和提取时间对多糖得率影响的单因素试验。在料液比1 ∶30 g·mL-1、提取时间20 min条件下,提取温度分别设为30、40、50、60、70、80℃;在提取温度50℃、提取时间20 min 条件下,料液比分别设为1 ∶10、1 ∶15、1 ∶20、1 ∶25、1 ∶30、1 ∶35、1 ∶40 g·mL-1;在提取温度50℃、料液比1 ∶30 g·mL-1条件下,提取时间分别设为5、10、15、20、25、30、35、40 min。将多糖提取得到的浸提液于4 000 r·min-1离心10 min,取上清液测量其多糖浓度,计算菌糠粗多糖的提取率。
稀酸水解法:取10 g 菌糠,以稀硫酸溶液作为溶剂,进行硫酸浓度、提取时间、料液比和提取温度对多糖得率影响的单因素试验。在提取时间60 min、料液比1 ∶30 g·mL-1、温度121℃条件下,硫酸浓度分别设为0、2%、4%、6%、8%、10%;在硫酸浓度2%、料液比1∶30 g·mL-1、 提取温度121℃条件下,提取时间分别设为20、40、60、80、100、120 min;在硫酸浓度2%、提取时间60 min、提取温度121℃条件下,料液比分别设为1 ∶15、1 ∶20、1 ∶25、1 ∶30、1 ∶35、1 ∶40 g·mL-1;在硫酸浓度2%、提取时间60 min、料液比1 ∶30 g·mL-1条件下,提取温度分别设为111、116、121、126℃。将多糖提取得到的浸提液于4 000 r·min-1离心10 min,取上清液测量其多糖浓度,计算菌糠粗多糖的提取率。
浸提液经活性炭吸附脱色、浓缩、加3 倍95%乙醇于4℃冷藏12 h 后,离心取沉淀烘干即为粗多糖。
1.2.2 抗氧化能力和生物学活性试验 消毒后的种子用蒸馏水浸泡24 h,挑选颗粒饱满的种子铺在含两层滤纸的平皿上,每皿30 粒,设置3 个重复,用不同质量浓度的茶树菇菌糠多糖溶液(1、10、100、1 000、2 000 mg·L-1)培养,以蒸馏水培养为对照组(CK)。培养皿放置于28℃培养箱进行黑暗处理,每2 d 换1 次培养液,培养至第8 天收集测定水稻种子萌发情况,研究不同提取方法制备的多糖对水稻种子萌发的影响。
将浸泡消毒后的水稻种子分别放入不同质量浓度的茶树菇菌糠多糖溶液(0、1、10、100、1 000、2 000 mg·L-1) 中,于室温下浸种24 h,挑选颗粒饱满的种子铺在含两层滤纸的平皿上,每皿30 粒,设置3 个重复,加入CuSO4使铜离子终浓度为6 mg·L-1,以无胁迫无多糖处理为对照组(CK)。培养皿放置于28℃培养箱进行黑暗处理,每2 d 换1 次培养液,培养到第8 天收集检测,研究茶树菇菌糠多糖在铜离子胁迫条件下对水稻种子的诱导抗逆活性。
1.3 测定项目与方法
1.3.1 多糖含量测定 采用硫酸苯酚法[17]测定浸提液中的多糖含量,根据公式计算粗多糖提取率:
式中,C为根据标准曲线得出的多糖浓度,g·mL-1;V为浸提液体积,mL;M为茶树菇菌糠质量,g。
1.3.2 抗氧化活性测定
1.3.2.1 DPPH 自由基清除能力的测定 参考文献[18],分别取2 mL 不同质量浓度(0.1、0.25、0.5、1、2、3、4、5 mg·mL-1)的菌糠多糖溶液,加入2 mL 0.1 mmol DPPH 溶液(无水乙醇配制),混匀后置于暗处,室温反应30 min,于517 nm 波长处测定吸光度值A1;以2 mL 无水乙醇代替DPPH 溶液为对照组,于517 nm 波长处测定吸光度值A2;以2 mL 蒸馏水代替多糖溶液为空白组,于517 nm 波长处测定吸光度值A0。以相同质量浓度的Vc 水溶液作试验对照,每个浓度样品溶液做3 次平行试验。根据公式计算DPPH 自由基清除率:
1.3.2.2 ABTS 自由基清除能力的测定 参考文献[19],取5 mL 7 mmol·L-1ABTS 溶液与5 mL 2.45 mmol·L-1过硫酸钾溶液混合,在室温避光条件下静置过夜,将混合液用磷酸缓冲液(pH 值6.6)稀释至波长734 nm 处吸光度值为0.7±0.10,即为ABTS 测定液。分别取0.2 mL 不同质量浓度(0.1、0.25、0.5、1、2、3、4、5 mg·mL-1) 的菌糠多糖溶液,加入2 mL ABTS 测定液,充分摇匀后放置6 min,于734 nm 波长处测定吸光度值A1;以2 mL 磷酸缓冲液(pH 值6.6)代替ABTS测定液为对照组,于734 nm 波长处测定吸光度值A2;以0.2 mL 蒸馏水代替多糖溶液为空白组,于734 nm波长处测定吸光度值A0。以相同质量浓度的Vc 水溶液作试验对照,每个浓度样品溶液做3 次平行试验。根据公式计算ABTS 自由基清除率:
1.3.2.3 羟基自由基清除能力的测定 参考文献[20],分别取1 mL 不同质量浓度(0.1、0.25、0.5、1、2、3、4、5 mg·mL-1)的菌糠多糖溶液,一次加入9 mmol·L-1硫酸亚铁溶液和0.03%(v/v)过氧化氢溶液各1 mL,摇匀静置10 min,再加入1 mL 的9 mmol·L-1水杨酸,将反应体系于37℃恒温水浴30 min 后,于510 nm 波长处测定吸光度值A1;以1 mL 无水乙醇代替水杨酸溶液为对照组,于510 nm 波长处测定吸光度值A2;以1 mL 蒸馏水代替多糖溶液为空白组,于510 nm 波长处测定吸光度值A0。以相同质量浓度的Vc水溶液作试验对照,每个浓度样品溶液做3 次平行试验。根据公式计算羟基自由基清除率:
1.3.2.4 还原力的测定 参考文献[21],取1 mL 不同质量浓度的菌糠多糖溶液(0.1、0.25、0.5、1、2、3、4、5 mg·mL-1),加入2.5 mL 磷酸缓冲液(pH 值6.6)和2.5 mL 1%(w/v)铁氰化钾溶液,充分摇匀,50℃水浴反应20 min 后,加入2.5 mL 10%(v/v)三氯乙酸,5 000 r·min-1离心10 min,吸取2.5 mL 上清液加入2.5 mL 蒸馏水和0.5 mL 0.1%(v/v)三氯化铁溶液,充分摇匀,室温反应10 min,以700 nm 波长处测定的吸光度值表示多糖的还原力。以相同质量浓度的Vc 水溶液作试验对照,每个浓度样品溶液做3 次平行试验。
1.3.3 水稻种子萌发测定 水稻种子培养时期每天记录水稻种子萌发数量,第3 天统计种子发芽势,第8天统计种子发芽率并测定水稻幼苗的根长和芽长。根据公式计算发芽势和发芽率:
1.4 数据处理
采用Origin 8.5、DPS 7.5 软件进行统计分析和差异显著性检验,对不同处理的数据进行单因素方差分析和Duncan 多重比较。表中数均为平均值±标准差。
2 结果与分析
2.1 提取工艺对菌糠多糖提取效率的影响
2.1.1 热水浸提法 通过提取温度、料液比、浸提时间3 个单因素试验优化热水浸提法提取菌糠多糖工艺,结果如图1 所示。在料液比1 ∶30 g·mL-1、提取时间3 h 条件下,提取温度60~75℃范围内多糖提取率变化不显著,75~90℃范围内随着温度的上升多糖提取率显著增加(P<0.05),但提取温度高于90℃时多糖提取率下降;在提取温度75℃、提取时间3 h 条件下,随着料液比由1 ∶10 g·mL-1稀释至1 ∶25 g·mL-1,多糖提取率显著上升(P<0.05),但在超过1 ∶25 g·mL-1后,多糖提取率显著下降;在提取温度75℃、料液比1 ∶30 g·mL-1条件下,随着提取时间的延长,多糖提取率先上升后降低。综合各单因素试验结果得到热水浸提法提取菌糠多糖的最佳组合为:温度90℃、料液比1 ∶25 g·mL-1、浸提时间3.5 h,在此条件下,菌糠多糖的提取率最高,达4.36%。
2.1.2 超声浸提法 通过提取温度、料液比、超声时间3 个单因素试验优化超声浸提法提取菌糠多糖工艺,结果如图2 所示。在料液比1 ∶30 g·mL-1、提取时间20 min 条件下,提取温度30~60℃范围内随着温度的上升多糖提取率呈显著增加趋势(P<0.05),但提取温度高于60℃时多糖提取率显著降低(P<0.05);在提取温度50℃、提取时间20 min 条件下,随着液料比由1 ∶10 g·mL-1稀释至1 ∶25 g·mL-1,多糖提取率显著增加(P<0.05),料液比1 ∶25 与1 ∶30 g·mL-1之间无显著差异,但料液比低于1 ∶30 g·mL-1时,多糖提取率开始下降;在提取温度50℃、料液比1 ∶30 g·mL-1条件下,随着提取时间的延长,多糖提取率先上升后降低。综合各单因素试验结果得到超声浸提法提取菌糠多糖的最佳组合为:温度60℃、料液比1 ∶25 g·mL-1、超声时间25 min,在此条件下,菌糠多糖的提取率最高,达2.11%。
2.1.3 稀酸水解法 通过硫酸浓度、提取时间、料液比、提取温度4 个单因素试验优化稀酸水解法提取菌糠多糖工艺,结果如图3 所示。在提取时间60 min、料液比1 ∶30 g·mL-1、温度121℃条件下,随着硫酸浓度的增加,多糖提取率先增加后降低,但在2%~8%范围内差异较小;在硫酸浓度2%、料液比1 ∶30 g·mL-1、提取温度121℃条件下,在提取时间20~60 min 范围内随提取时间延长多糖提取率显著增加(P<0.05),但提取时间超过80 min 后基本不变;在硫酸浓度2%、提取时间60 min、提取温度121℃条件下,多糖提取率随着料液比的增加无明显变化规律;在硫酸浓度2%、提取时间60 min、料液比1 ∶30 g·mL-1条件下,随着提取温度的升高多糖提取率先显著增加后显著降低(P<0.05)。从经济学角度考虑选择2%为最佳硫酸浓度,1 ∶25 g·mL-1为最佳料液比,综合各单因素试验结果得到稀酸水解法提取菌糠多糖的最佳组合为:硫酸浓度2%、提取时间60 min、料液比1 ∶25 g·mL-1、提取温度121℃,在此条件下,菌糠多糖的提取率最高,可达29.29%。
2.2 菌糠多糖的抗氧化能力比较
本试验以Vc 为阳性对照,分别研究了3 种不同提取方式多糖对DPPH 自由基、ABTS 自由基和羟基自由基的清除能力,以及还原力,从而评价茶树菇菌糠多糖的抗氧化活性,结果如图4 所示。随着热水浸提多糖浓度的增加,其清除DPPH 自由基能力先升高后降低,而超声浸提多糖的DPPH 自由基清除能力则与其浓度呈明显的正相关,稀酸水解多糖的DPPH 自由基清除能力总体随着浓度的增加呈升高趋势,但在浓度为5 mg·mL-1时略有下降。相同浓度下,3 种多糖及Vc 清除DPPH 自由基能力均呈现极显著的差异(P<0.01)。当稀酸水解多糖浓度为4 mg·mL-1时,其DPPH 自由基清除率可达最高(83.6%),极显著高于其他2 种提取多糖(P<0.01)。随着多糖浓度的增加,3 种提取多糖的ABTS 自由基清除能力均呈上升趋势,且当热水浸提多糖和稀酸水解多糖浓度达到2 mg·mL-1、 超声浸提多糖浓度达到5 mg·mL-1后,ABTS 自由基清除率达到100%,清除能力总体表现为热水浸提多糖>稀酸水解多糖>超声浸提多糖。当多糖浓度为0.25~2 mg·mL-1时,热水浸提多糖和稀酸水解的清除能力较为接近,但极显著高于超声提取多糖(P<0.01)。随着多糖浓度的增加,3 种提取多糖的羟基自由基清除能力总体均呈上升趋势,但均极显著低于Vc(P<0.01)。随着多糖浓度的增加,3 种提取多糖的还原力(OD700)均呈上升趋势,表现为稀酸水解多糖>热水浸提多糖>超声浸提多糖,且当浓度高于1 mg·mL-1时,3 种提取多糖间的还原力差异极显著(P<0.01),但均低于Vc。综上可知,本研究所制备的3种茶树菇菌糠多糖均有良好的抗氧化活性,其中热水浸提多糖具有较好的ABTS 自由基和羟基自由基清除能力,稀酸水解多糖具有较好的DPPH 自由基清除能力和还原力。
2.3 菌糠多糖的生物学活性差异
2.3.1 不同提取方法的多糖对水稻种子萌发的影响由表1 和图5 可知,与CK 相比,添加不同提取方式制备的茶树菇菌糠多糖对水稻种子发芽率和发芽势无明显影响,但适宜浓度的多糖可显著促进水稻根的生长,同时对芽的生长也存在一定的影响。随着热水浸提多糖和超声浸提多糖浓度的增加,水稻种子的根长也随之增加,分别较CK 增加4.06% ~ 32.50%和7.47%~47.71%;而较低浓度(1~10 mg·L-1)的稀酸水解多糖对水稻种子根长无明显促进用,当稀酸水解多糖浓度达到100 mg·L-1后,水稻种子的根长均显著高于CK,但随着多糖浓度的增加先增加后降低。
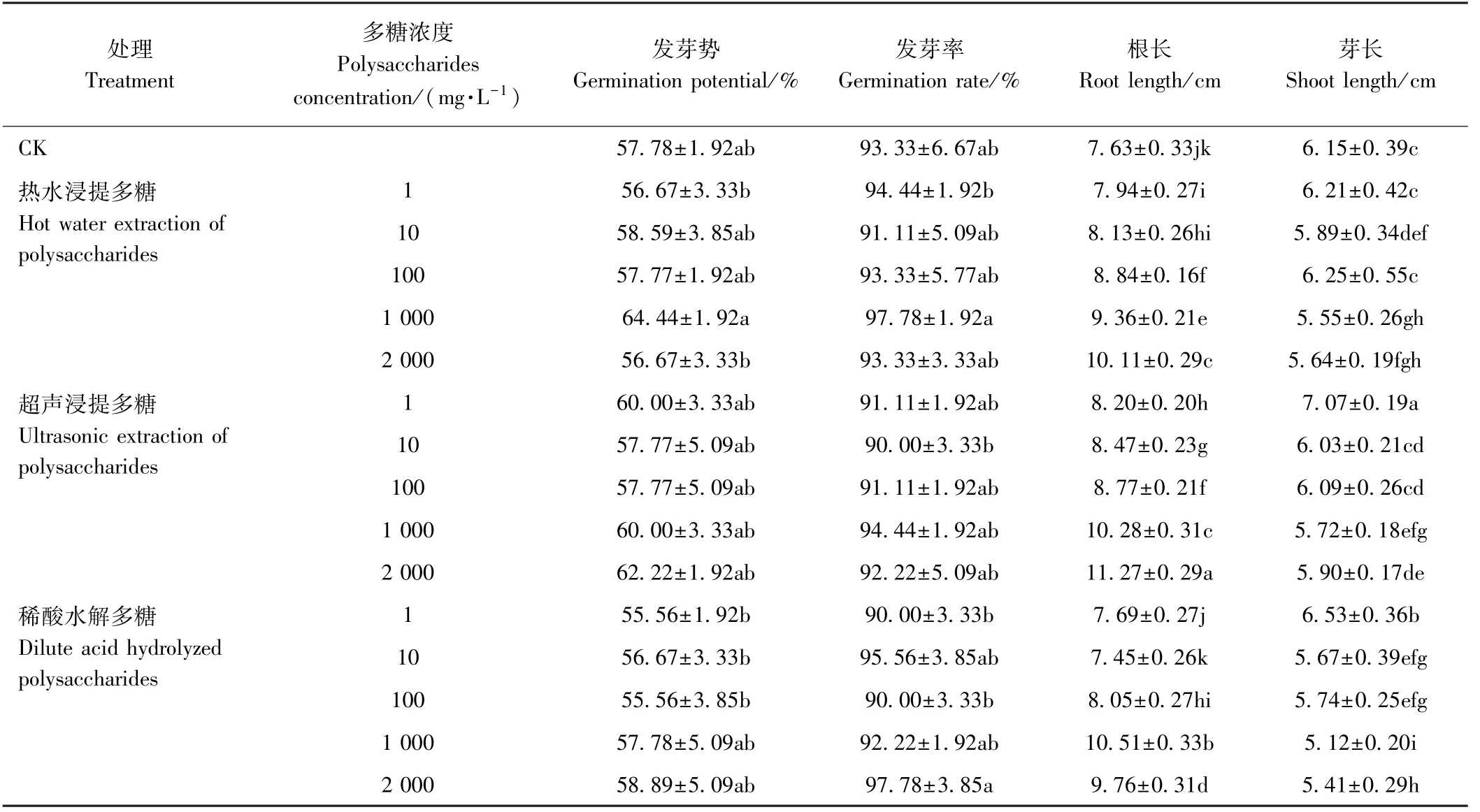
表1 不同提取方式茶树菇菌糠多糖对水稻种子萌发的影响Table 1 Effects of different extraction methods of Agrocybe cylindracea spent mushroom substrate polysaccharide on seed germination of rice
2.3.2 不同提取方法多糖对铜离子胁迫下水稻种子萌发的影响 在铜离子存在的条件下,水稻种子的萌发过程会受到抑制,而加入不同提取方式制备的茶树菇菌糠多糖对这一过程有明显的促进作用。由表2 和图6 可以看出,在铜离子胁迫条件下,水稻种子的发芽势、发芽率、根长较空白对照显著降低;而添加不同提取方式制备的茶树菇菌糠多糖对铜离子胁迫下水稻种子萌发的发芽势和发芽率有不同程度的缓解作用,其中对根长促进效果显著,但对芽长无明显促进作用。在热水浸提多糖和稀酸水解多糖的作用下,随着多糖浓度的增加,水稻种子的根长先增加后降低,但都显著高于单一铜离子胁迫处理组,较铜离子胁迫下根长分别增加8.47%~84.27%和24.19%~114.11%;在超声浸提多糖的作用下,低浓度多糖对铜胁迫下水稻种子萌发没有缓解作用,但当多糖浓度达10 mg·L-1时,随着多糖浓度的增加水稻种子的根长也随之增长,较铜离子胁迫下根长增加56.45%~104.84%。
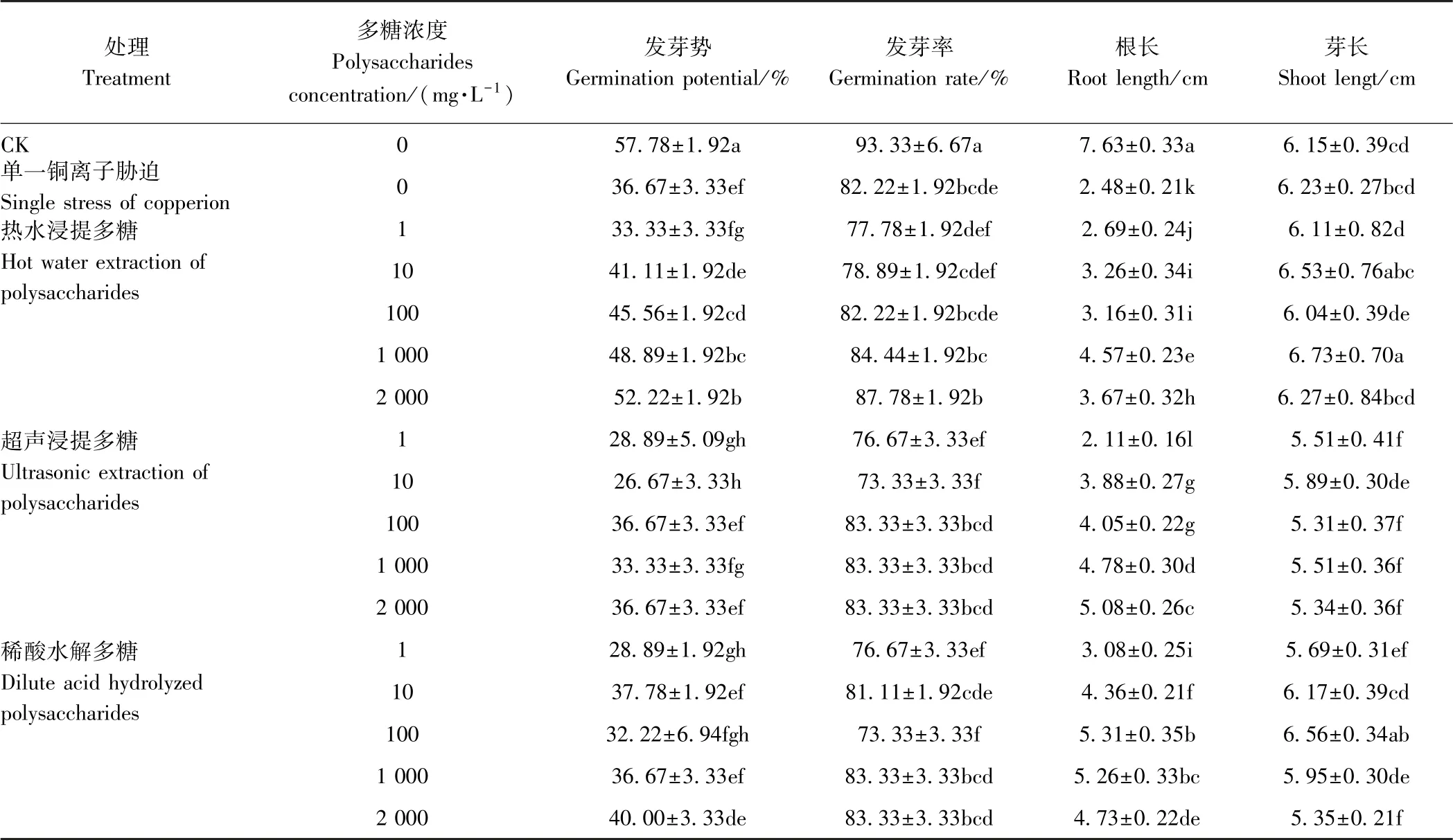
表2 不同提取方式茶树菇菌糠多糖对铜离子胁迫下水稻种子萌发的影响Table 2 Effects of different extraction methods of Agrocybe cylindracea spent mushroom substrate polysaccharide on seed germination of rice under copper ion stress
3 讨论
从废弃菌糠中提取多糖等有效物质是提升菌糠附加值的有效方式,但提取效率会直接影响其工业化生产潜力。有研究表明,提取方式的差异可能影响不同来源多糖的提取效率、多糖结构、物质组成和含量、生物活性等[22-23],而现有研究大多聚焦于不同提取方式对多糖提取率变化的影响,对其生物学活性差异的研究尚鲜见[24-25]。本研究结果表明,试验所用3 种提取方式的多糖提取率各不相同,同时不同方式制备的菌糠多糖在生物学活性上也有较大的差异,其中热水浸提多糖具有较好的ABTS 自由基和羟基自由基清除能力,稀酸水解多糖具有较好的DPPH 自由基清除能力和还原力,这与前人的报道也是一致的[26-27]。另外,尽管3 种方式所提取的多糖均可以较好地提高水稻种子萌发,诱导水稻种子对铜离子的抗逆性,但在其诱导效果上依然存在一定的差异,说明多糖的生物学活性会受到提取方式的影响,因此在生产实践中,除了要关注提取率之外,如何有效的保持多糖类产品的活性也是一个非常重要的问题。
热水浸提法具有操作简便、对多糖等生物大分子物质破坏较小等优势,目前已被广泛应用于不同菌糠多糖的提取[28],但这种方式的提取效率较低,因此采用超声、微波、酶解等辅助方式来提高提取过程的效率,是近年来常用的技术[29]。但在本研究中,采用超声辅助法后菌糠多糖的提取效率并未得到有效提升,反而较比热水浸提法有了一定程度的下降,造成这一现象的机理尚不清楚。同时,采用稀酸提取法可以大幅度提高菌糠多糖的提取效率,但研究表明,这种提取方式会产生大量的有色杂质,对后期的纯化等环节带来不利影响,而这一过程可能与酸碱类物质会对多糖分子有一定的降解作用有关[30],因此不适合于需要对多糖进行精制的生产过程。
4 结论
本研究结果表明,提取方式对茶树菇菌糠多糖的提取率、抗氧化活性及生物学活性均有较大的影响。稀酸水解法的多糖提取率最高可达29.29%,分别是热水浸提和超声浸提的6.72 和13.88 倍;3 种提取方式制备的多糖均有一定的体外抗氧化活性,其中热水浸提法制备的多糖具有较好的ABTS 自由基和羟基自由基清除能力,而稀酸水解法制备的多糖具有较好的DPPH 自由基清除能力和还原力;3 种多糖均能有效促进水稻种子的萌发以及诱导水稻种子产生抗逆性,促进水稻根系的生长,但不同提取方式的多糖对水稻不同部位的促进发育效果各不相同,可能是不同提取方式的多糖具有不同的结构和组分造成的,后续还需进一步试验来验证。

