超高压提取黄精多糖及提高运动耐力机制
张士凯 王 敏 程欣欣 张启月 吴 澎
(山东农业大学食品科学与工程学院/山东省高校食品加工技术与质量控制重点实验室,山东 泰安 271018)
黄精(Polygonatum sibiricum)是百合科黄精属(Polygonatum)多年生草本植物,为中华名药之一,多生于山坡背阳处、灌木丛中及树荫下,其茎柔长,叶呈线针状,略卷曲,五枚轮生,花开夏季,为白色或淡黄色,成熟时呈紫黑色,根茎横生,可药食两用。其中多糖是黄精中主要的活性成分之一,具有降血压、降血脂、延缓衰老、改善心脑血管功能和预防肿瘤等功效[1-3]。
目前提取黄精多糖常用的方法有热水浸提法、酸碱提取法、酶法提取等[4]。传统的提取方式耗能高、周期长、工序复杂,会破坏小分子活性成分。超高压提取技术为非热技术,具有快速、短时、节能、操作简单、高效等优势,不会对热敏性及小分子活性物质造成破坏[5],为食品领域科学研究、天然物质提取及工艺革新提供了新的思路。
机体在进行高强度或长时间运动时,会引起身体疲劳与不适,影响机体运动能力,导致工作效率低下[6]。研究表明,黄精具有抗氧化、缓解运动疲劳等功效,杨华杰等[7]比较了不同炮制黄精提取液的抗疲劳作用,结果表明,黄精各炮制品提取液均具备显著的抗疲劳作用;马怀芬等[8]以人参皂苷为阳性对照,通过小鼠游泳时间及肝糖原含量验证了黄精提取液的抗疲劳能力;陈靓雯等[9]通过对比灌胃黄精粗提物前后小鼠游泳时间、血清尿素氮、肝糖原、血乳酸水平的变化,发现黄精粗提物具有一定抗疲劳功效。关于黄精抗疲劳功效的研究并不缺少[10],但是缺乏对其机制的深入了解与全面分析。
本试验采用超高压技术提取炮制黄精多糖(processing of polygonatum polysaccharide,PPP),利用响应面法优化提取工艺,并以优化提取的PPP 为原料,通过小鼠力竭游泳时间及血清、肝脏、腓肠肌中相关酶指标变化验证PPP 提高运动耐力的能力,并对其机制进行推测,以期为PPP 提高运动耐力的研究提供一定的参考。
1 材料与方法
1.1 材料与试剂
黄精,取样于山东泰安徂徕山地区;SPF 级昆明(KM) 种雄性小鼠[许可证编号: SYXK (鲁)20170023],四周龄,体重19~26 g,购于山东朋悦实验动物繁殖有限公司;乳酸(lactic acid,Lac)、乳酸脱氢酶(lactate dehydrogenase,LDH)、血清尿素氮(serum urea nitrogen,SUN)、丙二醛(malondialdehyde,MDA)、ATP 酶、肌酸激酶(creatine kinase,CK)、总超氧化物歧化酶(total superoxide dismutase,T-SOD)等试剂盒均购于南京建成生物工程研究所。
1.2 仪器与设备
SpectraMax M5 多功能酶标仪,丹麦BioPorto 公司;HPP600MPA/3-5L 超高压设备,包头科发高压科技有限责任公司;5810/5810R 高速冷冻离心机,德国Eppendorf 公司;UV-VIS-NIR 紫外-可见分光光度计,美国Varian 公司。
1.3 黄精炮制
采用张伟娜等[11]描述的九蒸九晒方法对黄精进行炮制。
1.4 黄精多糖提取与优化
1.4.1 单因素试验 采用水提醇沉法提取粗多糖[12]。将炮制黄精烘干制粉过60 目筛后备用。取黄精粉1.0 g,分别按液料比5、10、15、20、30 mL·g-1,保压时间5 min,压强200 MPa 进行提取;取黄精粉1.0 g,分别设保压时间1、4、7、10、13 min,液料比20 mL·g-1,压强200 MPa 进行提取;取黄精粉1.0 g,分别设压强100、200、300、400、500 MPa,液料比20 mL·g-1,保压时间7 min 进行提取,然后将浸提液于6 500 r·min-1离心10 min,取上清,旋转蒸发浓缩,以减小溶液体积,加入4 倍体积96%(v/v)乙醇醇沉过夜,离心弃上清,依次用无水乙醇、丙酮和乙醚洗涤沉淀各3 次,得PPP,按公式(1)计算PPP 得率[13],得最佳单因素。绘制葡萄糖标准曲线为y=6.823 6x-0.042 3(R2=0.999 3),用以计算多糖浓度。
1.4.2 响应面优化试验 在单因素试验结果基础上,以PPP 得率为响应值,探究液料比、压强、保压时间3个因素对PPP 得率的影响,根据Box-Behnken 试验设计原理,采用Design-Expert.V8.0.6.1 软件进行3 因素3 水平响应面优化试验[14],得最佳提取工艺,同时以相同工艺对生黄精进行处理用作对照进行后续动物试验。
1.5 PPP 提高小鼠运动耐力试验
1.5.1 试验动物分组及试验设计 取50 只SPF 级KM 雄性小鼠,先适应性饲养3 d,然后随机分为5 组:PPP 高剂量组(1 600 mg·kg-1BW)、中剂量组(800 mg·kg-1BW)、 低剂量组(400 mg·kg-1BW)、空白对照组(0.9%生理盐水)及生黄精提取物组(1 600 mg·kg-1BW),连续灌胃19 d,灌胃量为每只0.5 mL·d-1,灌胃期间隔日对小鼠进行称重,统计进食量,试验期间自由饮水[15]。
1.5.2 小鼠负重游泳试验 灌胃期间进行4 次适应性游泳训练,前3 次分别无负重游泳10、20 和30 min,第4 次负重(体重量1%铅丝)游泳30 min,末次灌胃30 min 后,使小鼠尾部负重(体重量2%铅丝)于水深30 cm 游泳箱中进行力竭试验,水温保持在25±1℃,记录力竭游泳时间(头部沉入水中6 s 不能浮上水面[16])。
1.6 PPP 提高小鼠运动耐力机制初探
1.6.1 动物分组及试验设计 取30 只SPF 级KM 雄性小鼠,分为3 组:空白对照组(0.9%生理盐水)、空白游泳 组(0.9%生理盐水)、 PPP游泳组(800 mg·kg-1BW,最优剂量),连续灌胃19 d,灌胃量为每只0.5 mL·d-1,灌胃期间进行3 次适应性游泳训练(同1.5.2),末次灌胃30 min 后,将空白游泳组与PPP 游泳组于水深30 cm 游泳箱中负重(体重量2%铅丝)游泳40 min,水温保持在25±1℃,游泳结束后,立即对3组小鼠断头取血,解剖取肝脏、左腿腓肠肌,立即于-80℃冰箱保存[17]。
1.6.2 血清、肝脏和肌肉组织匀浆、线粒体制备 血清制备:小鼠断头取血后立即于3 500 r·min-1、4℃离心15 min,取上清即为血清,4℃保存[18]。
组织匀浆制备:取组织块(0.2~1 g)用冰冷生理盐水漂洗除去血液,然后加入10 倍生理盐水,用眼科剪将组织剪碎,倒入玻璃匀浆管中进行匀浆,充分研碎,使其组织匀浆化[19]。
线粒体提取:取10%组织匀浆于2 000 r·min-1离心10 min,取上清,9 500 r·min-1离心15 min,沉淀即为线粒体[20]。
1.6.3 疲劳相关指标的测定 分别测定3 组小鼠血清SUN、Lac 含量和LDH、T-SOD 活性,肝脏MDA 含量,左腿腓肠肌线粒体CK、ATP 酶活性等指标,按照南京建成生物工程研究所试剂盒说明书进行各指标测定。
1.7 数据统计分析
采用IBM SPSS statistics 24 软件与Design-Expert.V8.0.6.1 进行数据分析,采用Origin 9.1 软件绘图。
2 结果与分析
2.1 超高压提取PPP 工艺优化
2.1.1 响应面设计结果 通过试验确定其在每一个单因素条件下的最佳参数,分别为液料比20 mL·g-1,压强300 MPa,保压时间7 min。
采用Design-Expert.V8.0.6.1 软件,在最佳单因素试验结果基础上,以PPP 得率为指标,根据Box-Behnken 试验设计原理进行3 因素3 水平响应面优化试验,共计17 组(表1)
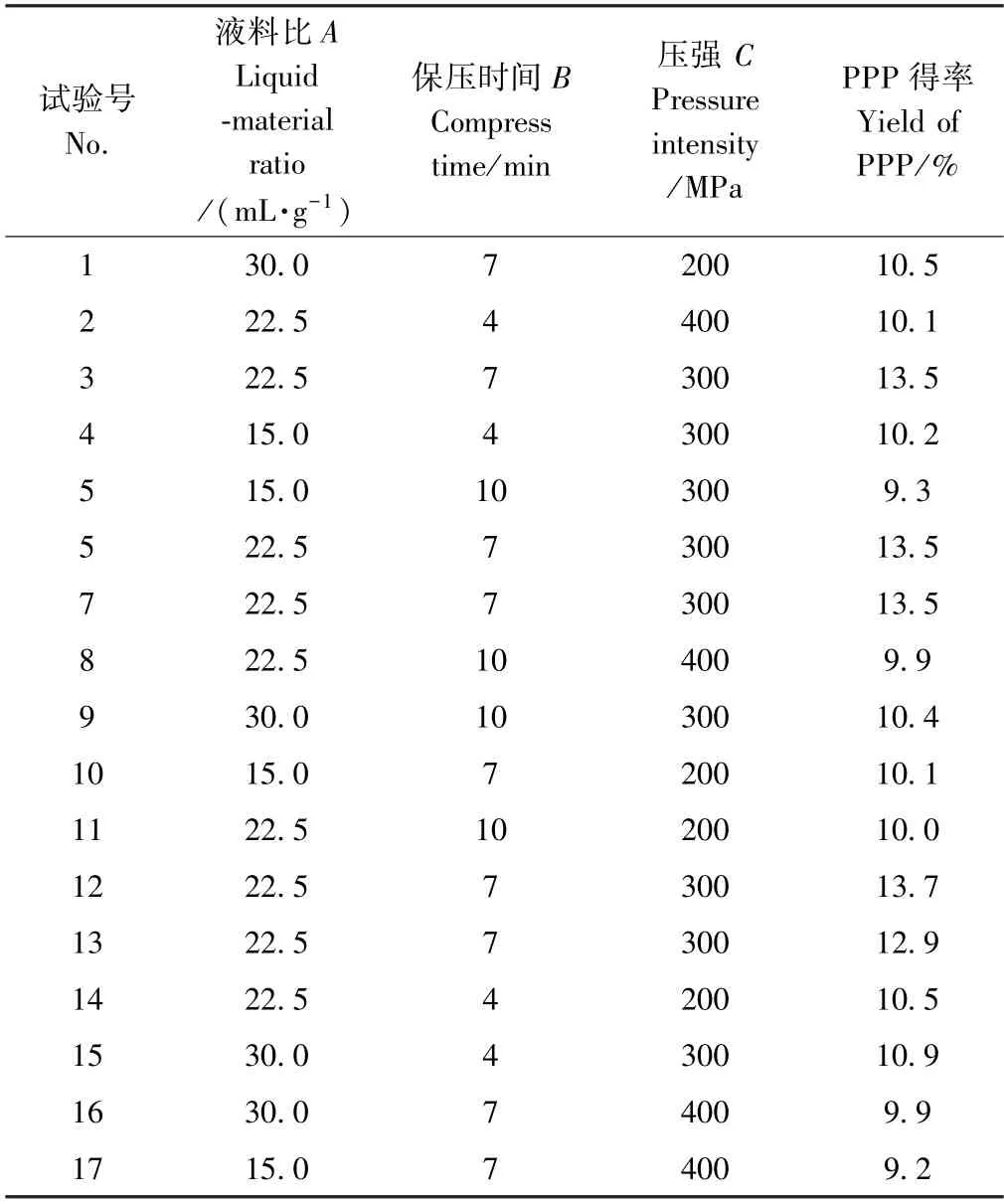
表1 Box-Behnken 试验设计及结果Table 1 Box-Behnken test design and results
2.1.2 模型方程的建立分析及验证 采用Design-Expert.V8.0.6.1 软件对结果进行方差分析,将数据进行多元回归拟合,得到PPP 得率(R)与压强(C)、保压时间(B)、液料比(A)的二次响应面回归方程为:R=13.42+0.36A-0.26B-0.25C+0.10AB+0.075BC-1.71A2-1.51B2-1.79C2,式中各项系数的绝对值表示单因素对水解度参数的影响程度,正负反映影响方向[21]。对模型进行方差分析可知(表2),此模型P<0.000 1,表明回归模型达到极显著水平;失拟项P>0.05,不显著,表明此模型拟合度良好,能较好解释响应中的变异;模型回归系数R2=0.985 4,=0.966 7,说明此模型对试验拟合度好,误差小,能解释96.67%响应值的变化,可以较好地预测超高压提取PPP 的工艺参数,可以用此模型进行分析和预测[22]。
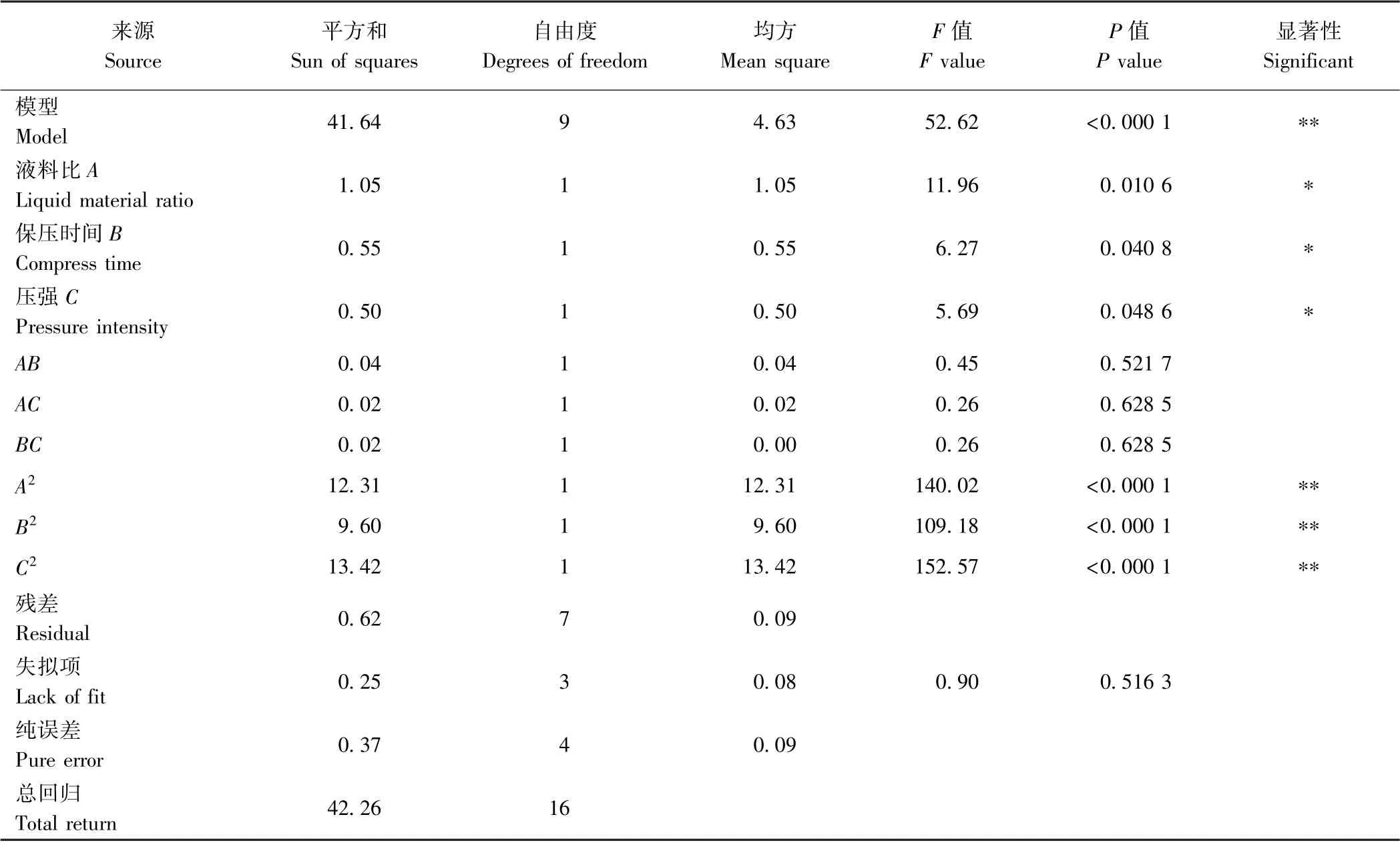
表2 回归方程模型方差分析Table 2 Analysis of Variance of Regression Equation Model
图1 可直观反映各因素之间的交互作用,PPP 得率随着液料比、保压时间、压强的增加呈先上升后下降趋势,具有极大值。根据响应面分析结果,得到最佳PPP 得率为13.46%,对应的各最佳因素条件分别为:液料比23 mL·g-1、保压时间6.73 min、压强293 MPa。
为检验预测模型的有效性,在最佳工艺条件下进行3 次平行试验,PPP 的提取率为13.12%,与模型预测值(13.46%)无显著差异,证实拟合的响应面模型具有良好的预测性,可用来预测黄精多糖提取率。在此工艺条件下提取的多糖浓度为58.19%,此外,未经炮制的生黄精提取的多糖浓度为61.12%。
2.2 PPP 抗疲劳功能研究
2.2.1 试验期间小鼠体重及摄食量变化 在试验期间,小鼠生长正常,个别小鼠灌胃后反应迟钝,腹部胀气,可能是一次性灌胃量过大引起,无死亡情况发生,灌胃30 min 后均活动灵敏。每隔1 d 记录小鼠体重与摄食量变化,发现各组小鼠体重变化情况无显著差异(P>0.05)(图2),19 d 摄食量也相近,无显著差异(P>0.05)(表3),说明灌胃PPP 对小鼠体重增长和摄食量无明显影响。
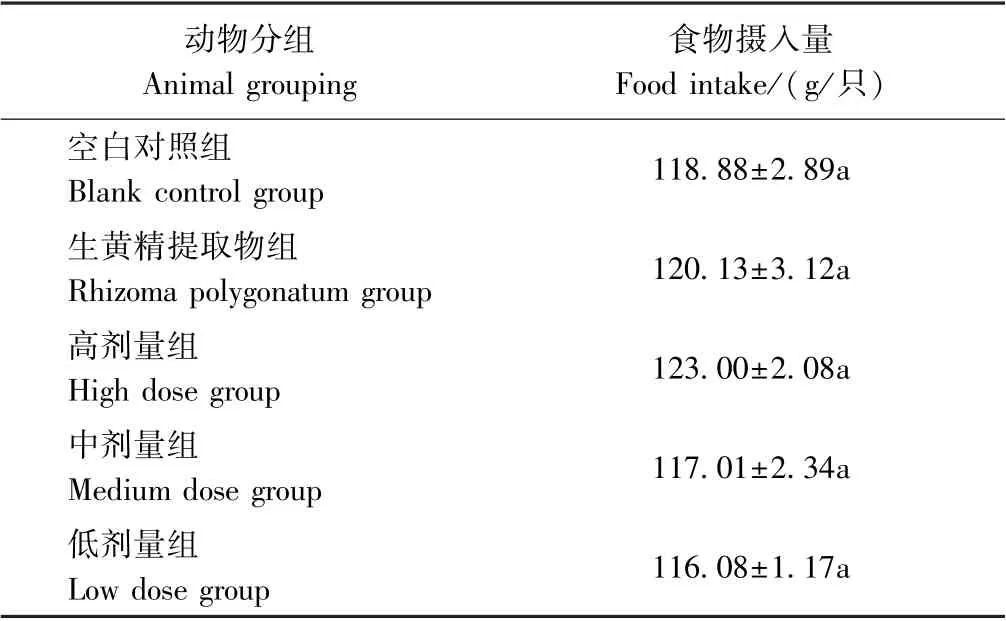
表3 小鼠进食量变化Table 3 Changes in mouse food intake
2.2.2 小鼠力竭试验结果 疲劳最直接的表现为运动耐力下降。本试验通过测定小鼠力竭游泳时间判断PPP 抗疲劳的功效,并比较不同浓度PPP 对游泳小鼠耐力提升表现。由图3 可知,PPP 中剂量(163.57 min)和高剂量组(157.86 min)小鼠力竭游泳时间显著高于空白对照组(114.43 min);与空白对照组相比,低剂量组(127.17 min)与生黄精提取物组(119.91 min)小鼠力竭游泳时间略有提高,但并无统计学差异(P>0.05),表明PPP 可提高小鼠运动耐力,具有一定抗疲劳功效。且PPP 抗疲劳效果比生黄精多糖效果更好,可能是在炮制过程中多糖内部结构或组成发生了微妙变化,从而赋予其更多的生物活性功能。
2.3 PPP 提高运动耐力机制初探
2.3.1 小鼠血清生化指标变化 机体在剧烈运动时会产生大量Lac,使机体内pH 值降低,Lac 的大量聚集会破坏机体酸碱平衡,进而引起疲劳。SUN 是与疲劳相关的血液生化指标之一,是蛋白质和氨基酸的代谢产物,也是衡量机体承受体力负荷时的灵敏指标,机体对运动耐力的适应能力越差,SUN 的增加就越明显[23-24]。由表4 可知,与空白对照相比,小鼠游泳后,其血清Lac 含量、 LDH活性与SUN 含量显著升高(P<0.05),T-SOD活性略有上升,但无显著差异(P>0.05);PPP 游泳组与空白游泳组相比,小鼠血清Lac、SUN 含量显著降低(P<0.05),表明PPP 可有效减少小鼠体内Lac、SUN 的产生。推测PPP 是通过增加糖原贮备,减少运动过程中Lac 的产生和蛋白质的分解,提高机体抗氧化、减轻运动应激损伤等途径达到提高运动耐力的功效。

表4 小鼠血清生化指标Table 4 Determination of serum biochemical indicators in mice
2.3.2 小鼠肝脏MDA 含量变化 MDA 是一种膜质过氧化产物,其含量可间接反映机体的损伤程度[25]。由图4 可知,相比于空白对照组(4.80 nmol·mL-1),空白游泳组(6.69 nmol·mL-1)与PPP 游泳组小鼠肝脏MDA 含量均显著升高(P<0.05);PPP 游泳组小鼠肝脏MDA 含量低于空白游泳组。表明小鼠经剧烈运动后,体内细胞氧化应激加强,出现一定损伤,推测PPP 是通过减轻机体运动过程中的氧化应激损伤,降低脂质过氧化程度从而达到提高运动耐力的效果。
2.3.3 小鼠腓肠肌线粒体生化指标变化 机体的运动离不开ATP 酶。ATP 酶能将ATP 催化水解,释放能量。肌肉活动中起主要作用的ATP 酶有3 种:Na+K+-ATP、Ca2+Mg2+-ATP 与肌球蛋白ATP 酶。ATP酶活性可以反映机体能量代谢水平。CK 主要存在于细胞质和线粒体中,可通过催化ATP 释放能量参与机体活动。机体强烈运动时,细胞膜在牵拉、震荡、自由基攻击等作用下膜通透性发生改变,导致CK 外渗至血液[26-27]。由表5 可知,与空白对照组相比,空白游泳组腓肠肌线粒体CK 活性显著降低(P<0.05),而PPP 游泳组小鼠腓肠肌线粒体CK 活性较空白游泳组显著提高;游泳组小鼠腓肠肌线粒体Na+K+-ATP 与Ca2+Mg2+-ATP 活性下降,其中PPP 游泳组Na+K+-ATP与Ca2+Mg2+-ATP 活性较空白游泳组稍有上升,但均不显著(P>0.05)。推测PPP 可通过防止细胞膜受损而保护腓肠肌线粒体功能,减少线粒体的应激损伤,对腓肠肌能量代谢产生一定的改善,增强运动过程中能量供给,有利于机体运动耐力的保持与加强,通过改善线粒体代谢功能增加机体运动耐力,可能是PPP 具有缓解运动疲劳的重要机制。
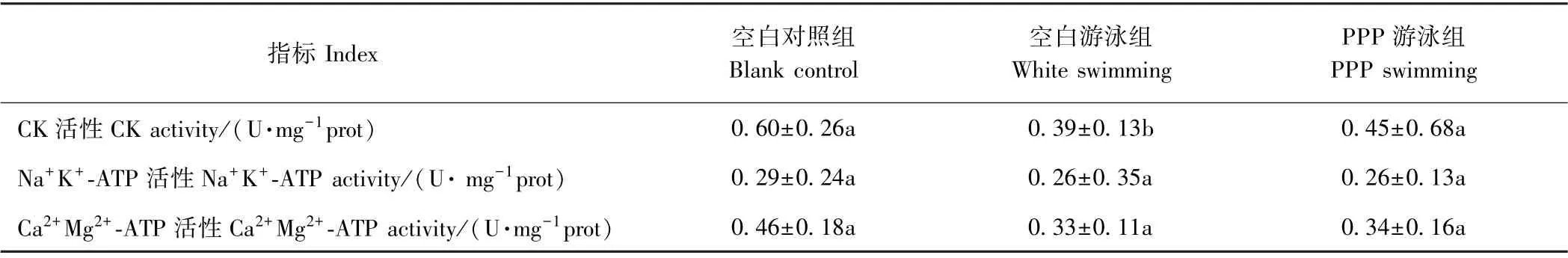
表5 小鼠腓肠肌线粒体生化指标Table 5 Determination of mitochondrial biochemical markers in mouse skeletal muscle
3 讨论
传统的多糖提取方法一般采用高温、强酸、强碱的条件,所得废液易对环境造成破坏。超高压提取技术避免了强酸/碱溶液的使用,具有低温、低耗等优势,对样品活性成分影响小,为黄精功能性成分的分离及开发提供了新思路。本研究通过响应面优化试验得到PPP 最佳提取工艺为:液料比23 mL·g-1、保压时间6.73 min,压强293 MPa,在此条件下PPP 得率为13.46%。李丽等[28]利用水提醇沉工艺所得黄精多糖最佳得率为8.295%;魏炜等[29]采用超高压提取黄精多糖,得到其最佳得率为19.83%。不同研究中黄精多糖提取率存在一定的差异,这可能与黄精品种和提取工艺的不同以及是否炮制有关。已有研究表明,2种提取技术的协同使用会提高产品得率与品质[30]。建议后续开展超高压与酶、超声波、微波辅助等技术协同提取PPP 的研究。
机体高强度运动后会产生过多自由基,从而影响机体的运动功能。本研究通过小鼠力竭游泳试验证实PPP 具有提高运动耐力的功效,这与杨华杰等[7]和马怀芬等[8]对黄精和黄精提取液的抗疲劳研究结果一致。本研究还发现,与空白游泳组相比,PPP 游泳组小鼠血清Lac 和SUN 含量显著降低,T-SOD 活性上升,肝脏MDA 活性下降,腓肠肌线粒体中CK 和Ca2+Mg2+-ATP 活性上升,Na+K+-ATP 活性不变。推测其功能机制为,PPP 可提高小鼠抗氧化能力,增加糖原储存,减少蛋白质分解,使机体在运动过程中减少Lac、SUN 等代谢产物的产生,同时提高腓肠肌能量代谢能力,降低运动过程中线粒体的应激损伤,进而达到提高运动耐力的能力。这与陈靓雯等[9]通过小鼠力竭游泳时间及游泳前后其血清SUN 和Lac 水平对比研究黄精提取液抗疲劳机制的结果相一致。但本研究并没有确定是哪种成分起作用,也未进一步综合分析抗疲劳机制研究,因此,可结合生物医学、生物分子学等多领域学科深入分析PPP 抗疲劳的机制。
4 结论
本研究对超高压提取PPP 工艺进行了优化,得到最佳工艺条件:液料比23 mL·g-1、保压时间6.73 min,压强293 MPa。此外,超高压提取的PPP 能够显著延长小鼠力竭游泳时长,具有较好的提高运动耐力的效果,其可能是通过提高机体代谢与抗氧化能力,减少腓肠肌线粒体应激损伤实现的。

