浙贝母生长过程中生物碱的累积动态及其与根际微环境的相关性分析
唐云佳 黄幸鸽 颜晓宁 袁小凤
浙江中医药大学生命科学学院 杭州 310053
浙贝母(Fritillaria thunbergii Miq.,F.thunbergii)为浙江省道地药材“浙八味”之一,主产于宁波,其鳞茎具有清热化痰、止咳、开郁、散结之功,临床用量极大[1]。 贝母素甲(C27H45NO3)及贝母素乙(C27H43NO3)都属于生物碱,是浙贝母的药效指标之一,2020版《中国药典》规定,干品浙贝母中贝母素甲和贝母素乙的含量不能低于0.080%[2]。一般来说,生物碱含量会随着季节性因素产生相应的改变[3],然而浙贝母生物碱的含量变化情况迄今未知。
植物的特性主要与其生长环境有关,尤其是对于根茎类药材,根际微环境对于其生理状态的塑造具有重要作用[4]。由于根际微生物在碳氮循环方面的作用,使得根际微环境对植物的营养、健康以及质量具有重要意义[5]。已有研究表明,根际微生物的存在能够引导植物生物碱的合成,如将织片草螺菌接种于狗尾草根部后,固定菌株定植的根中参与吲哚生物碱合成的化合物增多[6];罂粟的细胞培养物无法组成性地积累生物碱,而是依赖于某些微生物所提供的酶类或辅因子[7]。这些均表明,微生物对于植物生物碱的积累具有重要价值。
浙贝母作为一种传统中药材,其药物潜力被不断发掘并应用,为了提高药物质量,对于浙贝母有效成分生物碱的质量控制十分必要。因此,本研究以浙贝母根际土壤中的微生物为研究对象,借助高通量测序技术检测浙贝母根际土壤微生物组成的多样性,分析其变化规律;以分光光度法及高效液相色谱-蒸发光散射检测分析(high performance liquid chromatography-evaporative lightscattering detection,HPLCELSD)分别检测浙贝母不同生长期生物碱及单体碱的含量;并结合土壤理化性质,探讨浙贝母整个生长期内根际土壤微生物多样性变化与生物碱含量之间的相关性,为道地药材浙贝母的科学生产提供依据。
1 对象和方法
1.1 实验设计及样品采集 选择江苏南通、浙江宁波和磐安为浙贝母种植基地,每个基地均用同样的土壤种植3个种源(南通种源、宁波种源、磐安种源),于10月开始种植,次年1月25日左右开始出苗,分别于浙贝母苗期、花期和收获期按5点取样法采集土壤及鳞茎,每个样品重复取样3次,样品具体代码见表1。所有新鲜土壤过20目筛,去掉其中的石头和动植物残渣,装入无菌收集管中,迅速带回实验室,-20℃保存备用;所得到的鳞茎,带回洗净后生晒切片,烘干待用。
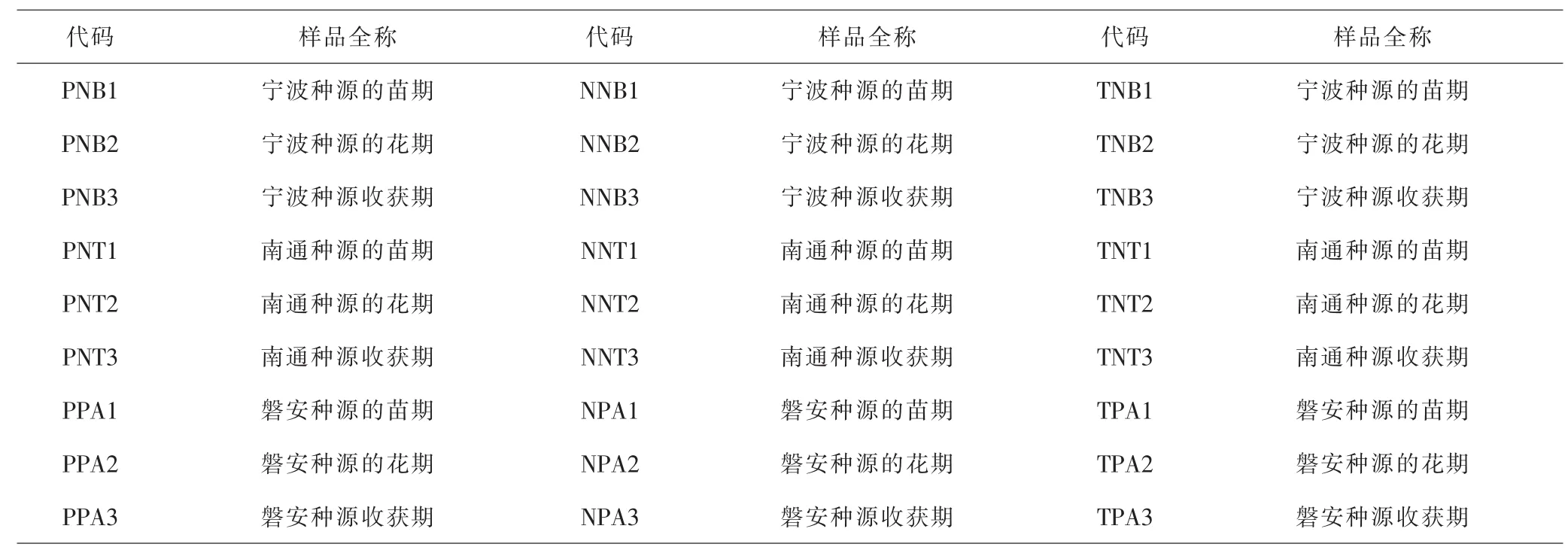
表1 样品代码及含义Tab.1 Sample code and meaning
1.2 试剂和仪器 浙贝母药材由浙江省中药研究所俞旭平教授鉴定,为百合科植物浙贝母(F.thunbergii)的鳞茎。贝母素甲和贝母素乙标准品均购于中国药品生物制品检所(批号:110750-200608、110751-200608);E.Z.N.A.ⓇSoil DNA Kit购于Omega公司(批号:00M56350 20000C02Q003);Qubit2.0 DNA检测试剂盒购于Life公司(批号:1759393);Agencourt AMPure XP磁珠购于Beckman公司(批号:14403400);其他无机盐和有机溶剂如无特殊说明均为分析纯,购于国药集团药业股份有限公司。PHS 3C型氢离子浓度指数(hydrogen ion concentration,pH)计为郑州宝晶电子科技有限公司产品;S22PC型可见分光光度计购于上海棱光技术有限公司;Agilent 1100型液相色谱仪为Agilent Technologies有限公司产品。
1.3 土壤样品理化性质测定 以pH计检测质量体积比1:2.5的土壤与水溶液的pH值,通过重铬酸盐消化测定有机质含量,以磷酸苯二钠比色法测定土壤磷酸酶的活性[8],以靛酚比色法测定土壤脲酶活性[9]。
1.4 鳞茎总生物碱及单体碱含量的测定 取浙贝母样品粉末约2.000g,按药典方法制备供试品溶液[2]。采用可见分光光度计测定吸光度(absorbance,A)值,根据所得线性方程计算样品中总生物碱的含量。
贝母素甲和贝母素乙标准品以0.05%盐酸甲醇溶液溶解,分别制成对照品溶液。分别精密吸取对照品溶液6、10、15μL,供试品溶液5~15μL,以液相色谱仪检测。用外标两点法对数方程分别计算贝母素甲、贝母素乙的含量[2]。
1.5 土壤基因组DNA提取、聚合酶链式反应(polymerase chain reaction,PCR)扩增及测序 作为道地产区的宁波,其土壤理化性质具有一定的代表性,也赋予了浙贝母得天独厚的生长环境,因此本研究以道地产区宁波为代表,研究浙贝母根际微生物。使用Omega E.Z.N.A.ⓇSoil DNA Kit试剂盒提取土壤基因组DNA。 上游引物5’-GCCTTGCCAGCCCGCTCAGTCAGAGTTTGATCCTGGCTCAG-3’, 下游引物5’-GCCTCCCTCGCGCATCAGNNNNNNNNNNCATGCTGCC TCCCGTAGGAGT-3’。以土壤基因组DNA为模板,对细菌16S rDNA的V2区进行PCR扩增。用0.6倍的磁珠纯化回收DNA,以Qubit2.0 DNA检测试剂盒精确定量DNA[10]。依照既往研究的方法,提取土壤真菌基因组DNA,并按照其反应体系和条件对真菌进行扩增[11]。每个样品DNA量取10ng,上机进行焦磷酸测序。
1.6 数据处理 采用焦磷酸测序方法对细菌进行分类和丰度分析。运算的分类单元(operational taxonomic units,OTUs)、Chao1指数、基于丰度的覆盖率估计值(abundance-based coverage estimator,ACE)是生境内菌群丰度的评估指标,Shannon指数是生境内菌群多样性的评估指标。具体处理方法详见文献[11]。
1.7 统计学分析 采用SPSS 16.0统计软件进行统计学分析,Excel及Origin 8.0软件作图。 计量资料以±s表示,多组均数比较用单因素方差分析;相关性分析采用Pearson相关性分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 不同生长期浙贝母根际土壤理化性质的变化 为研究土壤因子与生物碱的关系,将3个种源用同一类型的土壤培养,研究不同发育期之间土壤理化性质的差异。见图1。南通的根际土壤pH均在7.36~8.21之间,偏碱性;而浙江两地的pH均在7.0以下,偏酸性。尽管不同时期的pH动态变化规律不同,但随着浙贝母的生长,土壤pH均逐渐上升。见图1A。有机质含量表现为先下降后上升,整体呈上升趋势,只有宁波种源在本地种植表现为先升后降。见图1B。脲酶活性在浙贝母的生长过程中呈下降的趋势。见图1C。磷酸酶活性的动态变化均表现出先上升后下降的趋势,与脲酶活性的变化趋势基本相同。见图1D。总的来说,随着浙贝母的生长,土壤pH逐渐上升;有机质含量先下降后上升;而脲酶和磷酸酶活性则先上升后下降。作为道地产区,宁波的脲酶活性和磷酸酶活性均最高,表现出较好的土壤肥力。三个产区比较,浙江两地的土壤理化性质也更为相似。
图1 不同发育期的浙贝母土壤理化性质的动态变化图Fig.1 Dynamic changes of soil physical and chemical properties of F.thunbergii in different developmental stages
2.2 不同生长期浙贝母总生物碱及单体碱含量变化 随着浙贝母的生长,总生物碱及单体碱的含量均明显下降,收获期达到最低水平,种源、产地和生长期的不同均不会改变浙贝母总生物碱含量的变化趋势。在浙贝母的生长早期,贝母素乙所占的比重大于贝母素甲,然而随着鳞茎的生长贝母素甲的绝对含量虽然下降,但其相对含量却逐渐增加最终超过贝母素乙,表明贝母素乙比贝母素甲损失得更快。见图2。

图2 浙贝母生长期内总生物碱及单体碱含量柱状图Fig.2 Histogram of total alkaloid and monomer alkaloid content during the growth period of F.thunbergii
2.3 部分土壤理化性质与生物碱含量的相关性分析 对土壤pH、有机质含量、脲酶和磷酸酶活性与总生物碱、单体碱含量进行相关性分析。研究发现,贝母素甲与贝母素乙、贝母素甲与贝母素甲乙之和、贝母素乙与贝母素甲乙之和、贝母素甲与总生物碱含量、贝母素乙与总生物碱含量、贝母素甲乙之和与总生物碱含量均呈正相关(r=0.51、0.76、0.95、0.60、0.89、0.90,P<0.01),说明浙贝母中其他的单体碱与贝母素甲和贝母素乙的合成同步。此外,贝母素乙与有机质含量、总生物碱与有机质含量呈负相关(r=-0.63、-0.53,P<0.01);土壤中脲酶与磷酸酶的活性呈正相关(r=0.47,P<0.05),有机质含量与脲酶活性、pH与磷酸酶活性呈负相关(r=-0.45,P<0.05;r=-0.78,P<0.01)。 见表2。说明在浙贝母生长初期土壤中酶活性越高,微生物活动越频繁,从而导致土壤pH及有机质含量下降。

表2 土壤理化性质与生物碱含量的Pearson相关性分析Tab.2 Pearson correlation analysis of soil physical and chemical properties and alkaloid content
2.4 浙贝母土壤微生物多样性分析 从浙贝母际土壤样本中共检测到39 157条序列,分类和丰度分析见表3,其中83%属于细菌,17%属于真菌,表明浙贝母根际土壤中细菌的丰度远高于真菌。不同时期根际细菌的丰度显示,OTUs、Chao1指数、ACE差异均有统计学意义(P<0.05),且随着浙贝母生长呈下降趋势,表明根际细菌丰度和种类随浙贝母的生长而下降。而Shannon指数的排序结果与以上的丰度排序完全吻合,说明根际土壤中菌群多样性和均匀度水平也随浙贝母的生长而下降。根际真菌丰度和多样性随浙贝母的生长均呈现出先降后升的趋势,但Shannon指数却总体上升,表明根际土壤中真菌丰度虽然减少,但多样性反而增加。值得注意的是,在苗期和花期并无检测到曲霉属的存在,而在收获期检测到了曲霉属,且其丰度排名为优势属前20。
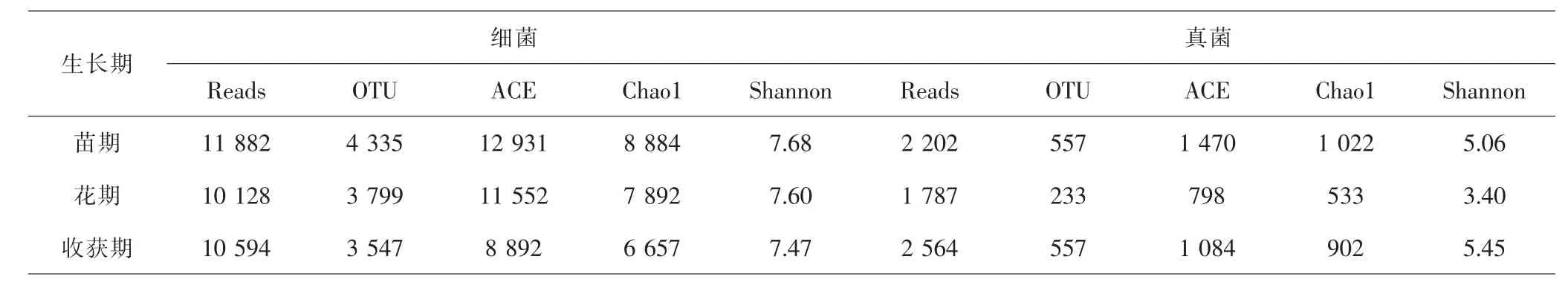
表3 浙贝母各生长期根际土壤微生物多样性分析Tab.3 Microbial diversity in rhizosphere soil of F.thunbergii in different growth stages
2.5 微生物群落的动态变化及优势菌群分析 在所有浙贝母根际土壤样本中共检测到32门细菌。见图3A。优势菌群分析发现,浙贝母土壤中主要包括变形菌门、酸杆菌门、放线菌门、厚壁菌门、拟杆菌门及绿弯菌门,它们占土壤细菌近90%。随着浙贝母的生长,变形菌门及酸杆菌门在根际土中的优势逐渐削弱,而放线菌门、厚壁菌门和拟杆菌门的优势则逐渐增强,尤其在收获期这些门的种类增加比较显著。相比之下,绿弯菌门的变化不太明显,再次证明浙贝母的生长对根际微生物有着重要影响。
在所有样本中共检测到10门真菌。见图3B。其中子囊菌门是绝对优势门(87%~90%),而其他真菌如毛霉亚门、壶菌门以及担子菌门等真菌仅占10%~13%。在整个生长期内,子囊菌门的丰度持续上升,毛霉亚门以及壶菌门丰度先下降后升高,而担子菌门以及Fungi_incertae_sedis丰度则表现出相反的趋势。
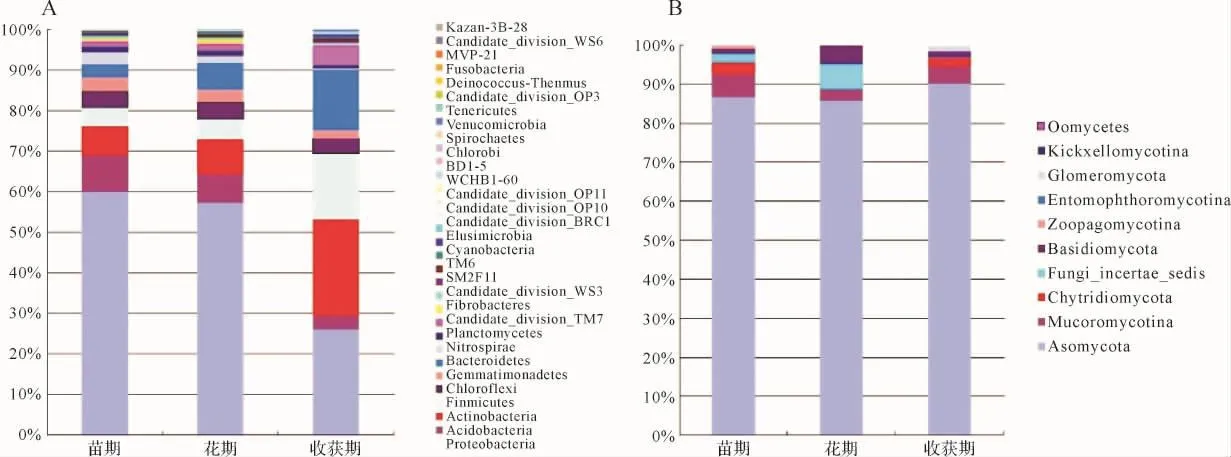
图3 浙贝母生长期内根际土壤微生物门水平群落结构组分图Fig.3 Composition map of horizontal community structure of microbial phyla in rhizosphere soil during the growth period of F.thunbergii
利用焦磷酸测序共检测到了浙贝母土壤中694个属,在排名前20的优势属中Nitrosomonadaceae-uncultured、Gemmatimonadaceae-uncultured 及 Methylocystaceae-uncultured随着浙贝母的生长其种类逐渐减少,这些细菌种类的变化趋势与生物碱含量的变化趋势完全相同,说明它们可能与生物碱合成密切相关。
2.6 生物碱与微生物多样性的相关性分析 对浙贝母3个生长时期的土壤理化性质、生物碱含量、微生物丰度指数Chao1以及微生物多样性指数Shannon进行Pearson相关性分析。结果表明,总生物碱含量和单体碱含量与细菌Chao1指数呈正相关(r=0.92、0.87,P<0.01),但与真菌Chao1指数无相关关系(r=0.22、0.46,P>0.05);总生物碱含量和单体碱含量与细菌Shannon指 数也呈正相关(r=0.96、0.87,P<0.01),但与真菌Shannon指数无相关关系(r=0.17、0.11,P>0.05)。 见表4。以上结果表明根际细菌的确与生物碱合成有着密切联系,甚至直接影响总生物碱及单体碱合成。此外,有机质含量与细菌及真菌Chao1指数均呈正相关(r=0.68、0.70,P<0.05),表明真菌和细菌对土壤养分起着活化作用,通过有机质含量的改变间接影响着生物碱的含量。
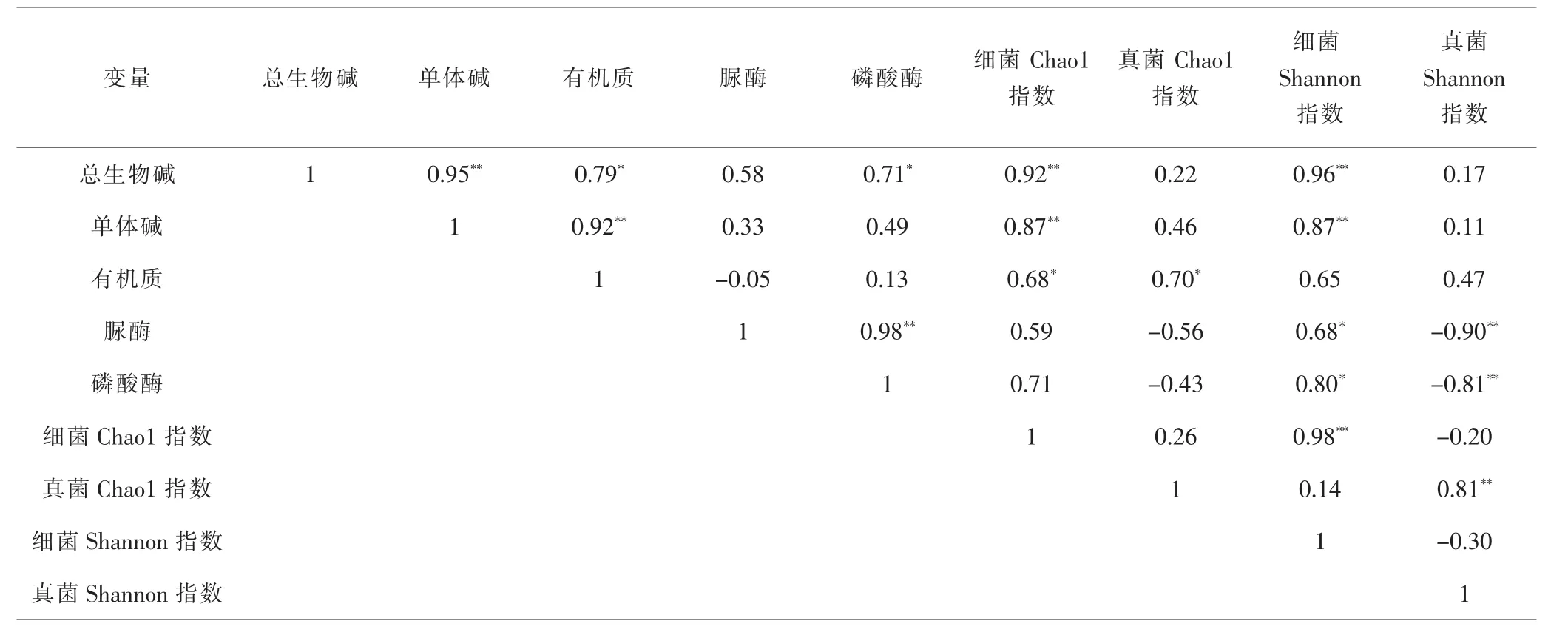
表4 浙贝母生物碱与微生物多样性之间相关性分析Tab.4 Correlation analysis between alkaloids of F.thunbergii and microbial diversity
3 讨论
为了探索土壤微环境对浙贝母生长和品质的影响,本研究从分子微生态学角度分析不同产区、不同种源及不同生长时期的浙贝母土壤理化性质与根际微生物及生物碱合成的关系。研究结果表明,将不同种源的浙贝母种植在同一种土壤中,随着浙贝母的生长,土壤pH逐渐上升,有机质含量先下降后上升,而脲酶和磷酸酶活性则先上升后下降。浙贝母的土壤性质均表现出产区差异及种源差异,产区间差异远大于种源内差异,这表明产区的外环境对浙贝母的生长会产生直接的影响。与土壤性质表现出产区、种源差异不同,浙贝母生长期内总生物碱及单体碱含量呈一致的减少趋势,这与藜芦中甾体生物碱含量的变化相似[12],表明种源、产地和生长期均不会影响浙贝母总生物碱含量的变化趋势。土壤理化性质与生物碱Pearson相关性分析显示,浙贝母中其他单体碱与贝母素甲和贝母素乙的合成同步,其合成皆与土壤有机质含量密切相关。浙贝母生长初期,土壤中酶活性越高,微生物活动越频繁,导致有机质含量下降。由此推测,土壤有机质含量的下降导致了总生物碱及单体碱含量减少。
研究发现,随着浙贝母的生长,生物碱含量、细菌丰度及多样性指数均呈下降趋势。Pearson相关性分析显示,细菌多样性与浙贝母总生物碱及单体碱含量呈正相关,说明生物碱含量与土壤细菌群落密切相关,和前期研究结果一致[13]。研究表明,细菌能够引导生物碱的合成[14]。Caputi等[15]用生物合成法合成两种酶,前二酮乙酸酯合成酶(precondylocarpine acetate synthase,PAS)和二氢前骨节心蛤碱合成酶(dihydroprecondylocarpine synthase,DPAS),从而实现了马达加斯加长春花中抗癌药物长春碱的生物合成。以上研究证明植物生长过程中缺少一些必需酶类,影响生物碱合成,而细菌可以提供这些必需酶类,使得生物碱合成代谢能够正常进行。本研究中根际细菌多样性的减少,可能使得浙贝母中依赖于细菌的生物碱合成途径受阻,导致生物碱含量持续减少,具体还有待进一步研究证实。值得注意的是,优势属中Nitrosomonadaceae-uncultured、Gemmatimonadaceae-uncultured及Methylocystaceae-uncultured的变化趋势与生物碱含量的变化趋势完全相同,而这些优势菌分别具有硝化作用[16]、几丁质降解作用[17]和甲烷氧化作用[18],这些优势属的减少导致相关生物学作用的减弱,从而影响生物碱的合成。贝母中单体碱合成需要氮元素,而含氮有机物大多需要经过细菌的分解才能被植物利用。因此,单体碱含量的下降以及有机质代谢减缓很可能与浙贝母根际酸杆菌门以及变形杆菌门等氮元素代谢相关细菌含量的减少有关。
研究显示,真菌是生物碱合成的重要因素之一[19]。本研究发现,随着浙贝母的生长,根际土壤中真菌丰度和多样性均呈现出先降后升的趋势,而Pearson相关性分析结果表明生物碱含量与土壤真菌多样性之间无相关性。值得注意的是,在苗期和花期并无检测到曲霉属真菌的存在,而在收获期检测到了曲霉属,且其丰度占据优势属前20。前期研究已证实,曲霉属真菌是浙贝母中的主要内生真菌[20]。正如镰刀菌属真菌等是川贝母鳞茎中产生生物碱的内生真菌一样[21],曲霉属真菌在收获期根际土中出现,可能与浙贝母生物碱的合成存在一定的关系,其内在联系还需进一步研究。
由于本研究仅使用道地产区宁波产区的浙贝母根际土壤进行微生物多样性分析,样品批次偏少,存在着一定的局限性,但结合早期研究结果[13],本研究仍能说明随着浙贝母的生长,细菌多样性与浙贝母生物碱含量之间呈正相关。此外,Pearson相关性分析以及细菌群落结构进行分析结果暗示了根际细菌对于浙贝母生物碱合成的促进作用,提示可以通过添加菌肥,提高土壤有机质含量及细菌多样性来增加浙贝母生物碱的含量,从而提高浙贝母品质,接下来的研究重点将放在与生物碱合成相关的特异菌群的筛选和机制研究等方面。

