miR-29c调节DNMT3A表达对乳腺癌细胞Sk-Br-3生长的影响
刘丽梅,惠赫童,范馨元,王添琦,汪洺卉,夏 薇
(北华大学医学技术学院,吉林 吉林 132013)
乳腺癌是女性最常见的恶性肿瘤之一,死亡率高.目前,我国乳腺癌的发病率呈逐年上升趋势,乳腺癌的发生发展涉及遗传与表观遗传等多种影响因素.我们的前期研究[1]发现:DNA甲基转移酶3B(DNA methyltransferase,DNMT3B)的改变会通过影响基因组的甲基化水平影响miRNA的表达.而miRNA作为机体内所产生的一类非编码RNA,同样具有调节基因表达的功能,成熟的miRNA可以与靶基因mRNA3′端非编码区完全或不完全配对结合,影响相关基因的表达,进而影响细胞生长[2].因此,miRNA及DNA甲基化之间存在着复杂的相互调控关系,在很多癌变组织中DNMT的表达都显示异常.为此,我们检测了乳腺癌患者癌组织及癌旁正常乳腺组织中DNA甲基转移酶的表达情况,并通过生物信息学软件预测了可与DNA甲基转移酶DNMT3A基因的mRNA结合的miRNA情况;同时采用细胞转染的方法,将人工合成的miRNA模拟体转染乳腺癌细胞中,考察其对DNMT3A表达的影响及其对乳腺癌细胞生长的影响,以探讨miRNA对DNMT3A的影响在乳腺癌发生发展中的作用,从而为乳腺癌的早期诊断、早期预防提供新的分子标志及治疗靶点.
1 材料与方法
1.1 研究材料
收集2017年8月—2018年7月吉林市中心医院乳腺外科10例乳腺癌患者的乳腺癌组织与癌旁组织,其中,乳腺导管癌5例,乳腺黏液癌5例.同时收集5例乳腺纤维瘤患者乳腺纤维瘤组织,均在患者知情同意情况下由吉林市中心医院乳腺外科医生采集病理组织,置于洁净的1.5 mL冻存管中,-80 ℃保存备用.人乳腺癌细胞系Sk-Br-3来源于中科院上海细胞库.
1.2 方 法
1.2.1 组织与细胞总RNA提取及DNA甲基转移酶检测
组织与细胞总RNA的提取使用组织RNA提取试剂盒Qiazol(Qiagen公司,德国),并按照说明书进行提取,将收集到的总RNA用反转录试剂盒(Takara公司,中国)按照说明书进行反转录.应用荧光定量PCR仪 (Thermo scientific PikoReal24)进行实时荧光定量PCR,以β-ACTIN为内参,检测DNA甲基转移酶DNMT1、DNMT3A与DNMT3B的相对表达量,引物序列见表1.扩增体系:SYBRGreen Premix(2×) 12.5 μL,上游引物(10 μmol/L) 0.5 μL,下游引物(10 μmol/L)0.5 μL,cDNA 1 μL,ddH2O 10.5 μL,共25 μL;扩增反应条件为95 ℃ 300 s预变性,扩增 40个循环,95 ℃变性5 s,52~56 ℃复性30 s,72 ℃延伸30 s;进行荧光信号采集,之后加载溶解曲线程序.

表1 引物序列Tab.1 Sequences of primers
1.2.2 miRNA模拟体的构建与转染
根据Targetscan软件分析结果选择可以与DNMT3A基因mRNA结合的MiRNA设计模拟体,序列送至上海吉玛生物技术有限公司合成,带有FAM标记的单链miR200c、miR-29b、miR-29c模拟体及其阴性对照.序列见表2.取对数生长期Sk-Br-3细胞,计数并调整细胞浓度为1×105个/mL,每孔1 mL,接种于24孔板中,待细胞贴壁后,次日进行转染.转染后,将细胞设空白对照组、阴性对照组、miR-200c模拟体组、miR-29b模拟体组与miR-29c模拟体组.用100 μL无血清培养基稀释80 ng miRNA模拟体及阴性对照,各加入3 μL HiPerFect Transfection Reagent转染试剂(Qiagen公司,德国),混匀,室温静止10 min,分别加至各组细胞中.转染24 h后,再加入Hoechst 33258避光染色10 min,用PBS清洗两次后在荧光显微镜下观察转染情况,计算转染效率.同样方法进行细胞转染,用于RNA及DNA提取,备用.
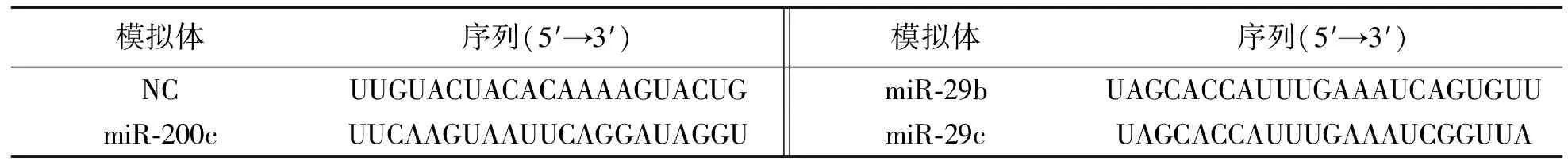
表2 模拟体序列Tab.2 Sequences of mimics
1.2.3 miRNA模拟体转染后细胞生长情况检测
将筛选后有效的miRNA 模拟体转染乳腺癌细胞中,分别于0、1、2、3、4、5 d消化细胞,制成细胞悬液,进行细胞计数.低倍镜下计数四角四个大方格内的细胞数,计算细胞浓度,以时间为横坐标,细胞数为纵坐标绘制细胞生长曲线.实验进行3次.
1.2.4 免疫印迹分析miRNA模拟体转染Sk-Br-3细胞后DNMT3A表达
miRNA模拟体转染细胞96 h后,提取各组细胞总蛋白,蛋白浓度一致后行SDS电泳,转膜后,用5%的脱脂奶4 ℃封闭过夜.将封闭好的膜置于配好的一抗中孵育,内参选用GAPDH(博士德公司,中国)一抗1∶400稀释,DNMT3A一抗(Santa Cruz公司,美国)1∶6 000稀释,室温孵育2 h,用PBS-T清洗4次,15 min/次.然后加入二抗孵育,内参选用GAPDH(博士德公司,中国)1∶4 000稀释,DNMT3A(博士德公司,中国)1∶5 000稀释,室温孵育40 min.用PBS-T洗两次,10 min/次,再用PBS平衡10 min,进行曝光,将胶片进行扫描拍照.
1.2.5 双荧光素酶报告基因的构建与检测
为进一步确定miRNA模拟体对甲基转移酶DNMT3A转录后修饰的作用,将DNMT3A与miRNA模拟体处结合序列交由上海吉玛生物技术有限公司合成,并克隆入双荧光素酶报告基因GP-miRGLO载体中,按HiPerFect Transfection Reagent转染试剂(Qiagen公司,德国)说明书将报告基因GP-miRGLO载体及miRNA 模拟体进行双转染,每组设置6复孔.转染24 h后,更换新鲜配制的含10%血清的完全培养基.转染48 h后,弃去培养基,用双荧光素酶检测试剂盒(Promega公司,美国)中的裂解液裂解细胞,按说明书操作依次加入萤火虫荧光素作用底物与海肾荧光素作用底物,并应用化学发光检测仪(Sirus公司,德国)记录数据.
1.3 统计学分析

2 结果与分析
2.1 乳腺癌组织DNA甲基转移酶表达差异
分别取癌旁正常乳腺组织、乳腺囊性纤维瘤、乳腺癌患者癌组织,提取RNA,反转录扩增DNMT3B、DNMT3A、DNMT1的mRNA,以β-ACTINE的转录作为内参,采用2-ΔΔCt计算3种基因的相对表达量.与正常乳腺组织比较,乳腺浸润性导管癌组织中DNMT3A及DNMT3B的相对表达量均显著增高(P<0.05).结果见表3.

表3 乳腺正常组织及乳腺癌组织中甲基转移酶转录情况Tab.3 DNA methyltransferases in tissues of breast cancer patients and healthy individuals
2.2 miRNA模拟体对DNMT3A表达的影响
针对DNMT3A设计并合成的miRNA 3种单链模拟体:miR-200c、miR-29b、miR-29c模拟体转染至乳腺癌细胞Sk-Br-3,转染72 h后,运用荧光定量PCR技术分别检测U6、hsa-miR-200c、hsa-miR-29b、hsa-miR-29c的表达水平,转染96 h后,运用Westen blotting检测甲基转移酶DNMT3A的表达情况:实验组与内参U6表达比较,可看出转染72 h后hsa-miR-200c、hsa-miR-29c、hsa-miR-29b的相对表达均显著上调.见表4~6.转染96 h后,Westen blotting结果可见转染miR-29c模拟体细胞甲基转移酶DNMT3A的表达显著下调(P<0.05).见图2、表7.提示miR-29c可与DNMT3A的mRNA结合,从而影响DNMT3A的表达.

表4 Sk-Br-3细胞转染miRNA模拟体后hsa-miR-200c表达情况

表5 Sk-Br-3细胞转染miRNA模拟体后hsa-miR-29b表达情况

表6 Sk-Br-3细胞转染miRNA模拟体后hsa-miR-29c表达情况
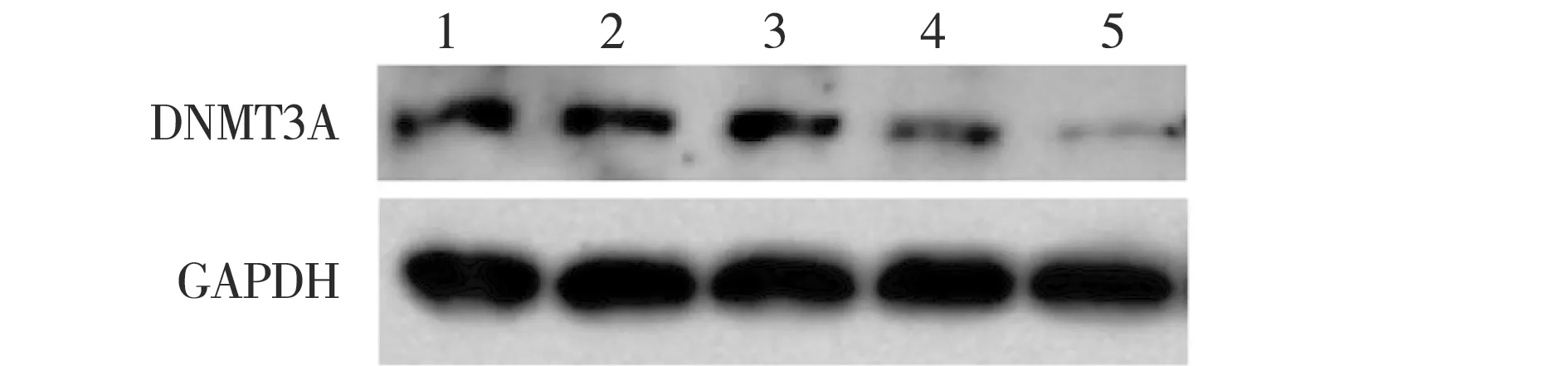
1.空白对照组;2.阴性对照组;3.miR-200c模拟体组;4.miR-29b模拟体组;5.miR-29模拟体组.图1 Sk-Br-3细胞转染miRNA模拟体后DNMT3A的表达情况Fig.1Expression of DNMT3A of Sk-Br-3 cell after transfection with miRNA mimics

表7 miRNA模拟体转染Sk-Br-3细胞后DNMT3A相对表达量
2.3 荧光素酶报告基因结果
为进一步确认miR-29c对DNMT3A的mRNA转录后修饰的作用,将与miR-29c所结合的序列克隆至双荧光素酶报告基因载体GP-miRGLO中.见图2.将其与miR-29c模拟体共转染到乳腺癌细胞Sk-Br-3中,通过化学发光检测仪检测人工合成的miRNA模拟体对双荧光素酶报告基因两种荧光素酶表达的影响,以确认其对DNMT3A转录后修饰的影响.结果发现:与阴性对照比较,miR-29c模拟体显著影响双荧光素报告基因荧光的表达(P<0.05).见表8.

表8 miR-29c模拟体对双荧光素酶报告基因的作用
2.4 miR-29c模拟体对乳腺癌细胞生长的影响
将筛选出可以明显抑制DNMT3A表达的miR-29c模拟体转染至乳腺癌细胞株Sk-Br-3细胞中,绘制细胞生长曲线,结果发现:miR-29c模拟体可以明显抑制Sk-Br-3细胞生长(P<0.05).见图3.
图2 双荧光报告基因GP-miRGLO载体与DNMT3A mRNA3′端序列Fig.2The dual-luciferase reporter gene vector GP-miRGLO and the sequence of the mRNA 3′ of DNMT3A
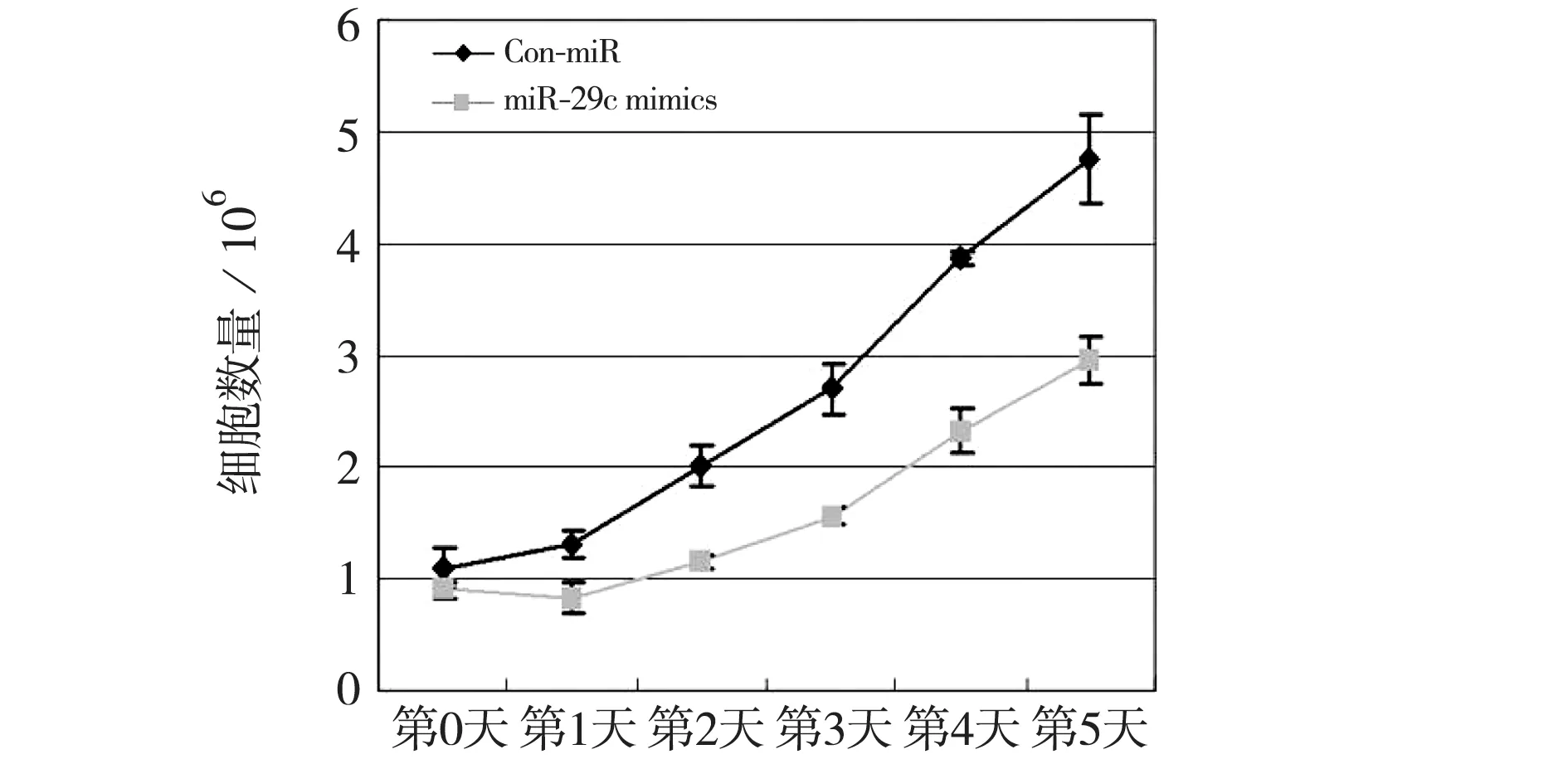
图3 miR-29c模拟体对乳腺癌细胞Sk-Br-3生长的影响Fig.3Effect of miR-29c mimics on growth of Sk-Br-3 cells
3 讨 论
有研究[3]显示:多种癌组织中DNA甲基转移酶表达异常,这很可能是癌组织中DNA异常甲基化产生的主要原因.为此,我们检测了乳腺癌患者的癌组织中与DNA甲基化有关的3种酶DNMT1、DNMT3A与DNMT3B的转录情况,结果显示:DNMT3A与DNMT3B的转录水平均显著增高.但TAVAKOLIAN S[4]的检测发现:只有DNMT3B的表达显著增高,这可能为所选取的患者乳腺癌组织类型不同所致,有研究[5]显示:DNMT3A的表达与HER基因表达有关,因此,在接下来的实验中我们选取HER基因表达阳性的乳腺癌细胞Sk-Br-3进行后续实验.
已有研究[6]发现:多种miRNA可以反馈调节DNMT3B,从而影响肿瘤的发生发展,但影响乳腺癌中DNMT3A的miRNA研究较少,为此,我们通过Targetscan筛选了3种影响DNMT3A的miRNA,通过免疫印迹与双荧光素酶报告基因确定miR-29c可以与DNMT3A的mRNA3′端非编码区相结合,从而影响DNMT3A的表达.早在2012年,PLAISIER C L等[7]发现在非小细胞肺癌中,miR-29c的表达呈下调.有研究[8]发现:miR-29s在肝癌细胞中表达明显下调,并显著抑制肝癌细胞的生长,这提示miR-29可能是一个有效的抑癌基因,可通过多种途径发挥抑癌作用.但前期研究[9]发现hsa-miR-29c在乳腺癌中的表达不一,这可能与乳腺癌的类型有关.AURE M R等[10]的研究发现:在雌激素受体簇的中心,hsa-miR-29c与DNMT3A的表达呈负相关,并且他们发现在浸润前乳腺病变中hsa-miR-29c的表达已失调,推测hsa-miR-29c可能触发雌激素受体阳性的乳腺癌早期异常DNA甲基化.由于DNMT3A的表达与HER基因的表达具有相关性,因此,对于雌激素受体阳性、HER基因表达阳性的乳腺癌患者,探讨miR-29c的表达变化有重要意义.
综上所述,在乳腺恶性导管癌组织中存在着DNMT3A的表达异常,而miR-29c可以通过与DNMT3A mRNA 3′端非编码区结合影响DNMT3A的表达,从而影响HER基因阳性的乳腺癌细胞的生长.miR-29c在乳腺癌发生发展中的作用还有待于进一步研究.

