外源独脚金内酯缓解小麦干旱胁迫的机制研究
魏如月,张慧兰,阚文杰,汤才国,吴丽芳*
(1.安徽大学 物质科学与信息技术研究院,安徽 合肥 230039;2.中国科学院合肥物质科学研究院 智能机械研究所,安徽 合肥 230031)
小麦是世界上最重要的粮食作物之一,也是我国主要的粮食作物.小麦对干旱、盐碱和低温等非生物胁迫非常敏感,其中,干旱是限制小麦生长的主要因素之一,不仅抑制小麦的生长和发育,对其产量和品质亦有十分严重的影响.干旱胁迫对小麦的影响主要表现在叶片萎缩、叶面积减少、叶片相对含水量降低、叶绿素含量减少、净光合速率和PS II最大光化学效率降低;同时诱导小麦体内产生过量的活性氧(reactive oxygen species, 简称ROS),进而引起氧化损伤和细胞膜的膜脂过氧化.因此,培育抗逆小麦新品种或增加小麦抗逆的调控措施,提高小麦的抗旱能力对于粮食安全具有重要意义.
独脚金内酯(strigolactone, 简称SLs)是从植物的根分泌物中分离出来的一种类胡萝卜素衍生物,是一种新型植物激素,对调节植物生长发育具有广泛作用.SLs在促进种子萌发、调节植物分枝和根的结构,以及延缓叶片衰老等方面发挥着重要作用.最近有研究表明,SLs在调节植物响应非生物胁迫方面也表现出积极作用.rac-GR24是人工合成的SLs类似物,可作为植物生长调节剂.外源GR24作为正向调节因子响应胁迫,可提高拟南芥(Arabidopsis
thaliana
L.)的耐旱性和耐盐性.近期研究表明,通过叶面施加GR24可促进葡萄(Vitis
vinifera
L.)生长和增强光合作用,激活氧化防御功能,提高干旱胁迫下葡萄的耐受性.Sharifi等研究发现,施加外源SLs到NaCl胁迫下的林荫鼠尾草(Salvia
nemorosa
L.)叶面,可改善其生物量、提高光合效率、激活酶和非酶抗氧化系统,从而促进植物生长.Zhang等研究表明,施加GR24可提高油菜(Brassica
rapa
L.)幼苗光合作用,提高细胞活力以及可溶性蛋白和脯氨酸(proline, 简称Pro)含量,增强抗氧化酶活性,抑制活性氧的产生,从而提高油菜的低温耐受性.SLs和脱落酸(abscisic acid, 简称ABA)有相同的生物合成来源——类胡萝卜素,有学者推测二者在合成水平上是相互影响的.Lopez-Raez等发现在番茄中,3个ABA-生物合成突变体(notabilis
、sitiens
和flacca
)的根分泌物中SLs含量显著降低,这可能是由于SLs生物合成基因CCD
7和CCD
8的转录水平降低引起的,这表明ABA影响SLs的合成.另一方面,SLs也可以影响ABA的合成,Torres-Vera等发现番茄SLs-生物合成突变体CCD
8的内源ABA水平降低,表明SLs缺乏会降低ABA水平.已有研究表明,水杨酸(salicylic acid)、褪黑素(melatonin)、ABA和Pro等均可提高小麦对干旱胁迫的抗性.然而,在干旱胁迫下,小麦对GR24的响应鲜有报道.笔者以百农207为试验材料,研究SLs对干旱胁迫下小麦幼苗的影响,为进一步研究SLs调控小麦耐旱胁迫的分子机制奠定基础.
1 材料与方法
1.1 供试材料
百农207小麦种子,来自中国科学院合肥物质科学研究院智能机械研究所吴丽芳课题组留种.1 mg rac-GR24(购自北京酷来搏科技有限公司)溶于335.6 μL丙酮,配制成10 mmol·L的母液,于-20 ℃冰箱储存备用.
1.2 试验处理
选取籽粒饱满、大小均匀一致的健康小麦种子,用1%的次氯酸钠溶液浸洗5 min,再用灭菌水漂洗5次,置于直径18 cm的培养皿中加水培养12 h.在培养皿中平铺3层滤纸,选取露白一致的小麦种子,均匀播种在滤纸上,每皿45粒,置于光照培养间培养,光照培养间的温度为25 ℃,光照强度为100 μmol·m·s,光照周期为16 h光照/8 h黑暗.待小麦幼苗长至高3~4 cm时,移植到含有500 mL 1/3 Hoagland营养液的黑色塑料盒中(规格为14 cm×9 cm×5 cm),在光照培养间进行水培养.
待小麦幼苗生长至两叶期,选取长势一致的小麦幼苗,分为4组:(1)对照组(CK):只用1/3 Hoagland营养液培养;(2)SL组(SL):1/3 Hoagland营养液+0.8 μmol·LGR24(依据前期预试验结果)培养;(3)干旱胁迫组(P):1/3 Hoagland营养液+20% PEG-6000(w
/v
)培养;(4)干旱胁迫+SL组(PS):1/3 Hoagland营养液+20% PEG-6000(w
/v
)+0.8 μmol·LGR24 培养.SL和PS组的小麦幼苗在干旱胁迫前24 h预先用0.8 μmol·LGR24处理24 h,CK和P组用等量的纯水处理,P和PS组的幼苗用20% PEG-6000施加干旱胁迫.设置3个生物学重复,每个重复48株小麦幼苗.干旱胁迫处理3,6,12,24,72 h和7 d后,取样,置于液氮中冻存.1.3 测定项目和方法
1.3.1 生长指标和叶片相对含水量测定
分别取干旱处理1,3,7 d后的植株,用纯水清洗,擦干水分后,测量株高和根长,将植株地上部分和地下部分分开,立即称重,分别记为根鲜重(fresh weight of root, 简称FWR)叶鲜重(fresh weight of leaf, 简称FWL).将叶片浸入双蒸水中浸泡过夜充分吸水后取出,用吸水纸擦干叶片表面水分,称重,记为膨胀重 (turgid weightof leaf, 简称TWL).最后,将根和叶置于烘箱中,烘干至恒重后称重,分别记为根干重(dry weight of root, 简称DWR)和叶干重(dry weight of leaf, 简称DWL),每个处理重复3次.叶片相对含水量(relative water content, 简称RWC)采用Teulat等的方法按以下公式进行计算:RWC (%) = (FWL-DWL) / (TWL-DWL) ×100.
1.3.2 叶绿素含量及光合效率测定
参照植物叶绿素试剂盒(南京建成生物工程研究所)的说明提取叶绿素,提取液在645 nm和663 nm处用Scandrop分光光度计(Analytikjena, Jena, Germany)测定吸光值,计算叶绿素的含量.
使用便携式植物光合效率现场测定仪(中国科学院安徽光学精密机械研究所) 测量光合效率,记录PS II的最大光化学效率F
v/F
m.1.3.3 抗氧化酶活性测定
按照超氧化物歧化酶(superoxide dismutase, 简称SOD)、过氧化氢酶(catalase, 简称CAT)和过氧化物酶(peroxidase, 简称POD)比色法测试盒(Elabscience, 武汉)的说明分别测定SOD、CAT和POD活性.将100 mg叶片样品在液氮中研磨成粉末,悬浮于0.9 mL 100 mmol·L磷酸盐缓冲液(pH 7.4).样品在4 ℃,10 000×g离心10 min,取上清液分别测定酶活.
1.3.4 谷胱甘肽含量测定
采用谷胱甘肽测试盒(南京建成生物工程研究所)测定总谷胱甘肽(total glutathione, 简称T-GSH)和氧化型谷胱甘肽(glutathiol, 简称GSSG)含量.将200 mg小麦叶片在液氮中研磨成粉末.根据412 nm处吸光度(A
和A
)的变化测定T-GSH和GSSG的含量.GSH含量为T-GSH和GSSG含量的差值:GSH = T-GSH-2×GSSG.1.3.5 HO和MDA含量测定
按照过氧化氢(HO)和丙二醛(malondialdehyde, 简称MDA)比色法测试盒(Elabscience,武汉)的说明分别测定植株过氧化氢和丙二醛的含量.
1.3.6 脯氨酸含量测定
使用脯氨酸(Pro)比色法测试盒(Elabscience,武汉)测定植株脯氨酸的含量.
1.3.7 RNA提取和RT-qPCR
根据植物RNA提取试剂盒(Omega,上海)的说明提取小麦叶片和根样品中的总RNA.分别用琼脂糖凝胶电泳和Scandrop分光光度计测定RNA的质量和浓度.使用TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix (Transgen Biotech)试剂盒以500 ng总RNA为模板,反转录得到cDNA,并将最终的反转录产物稀释36倍,于4 ℃冰箱中保存备用.RT-qPCR使用Roche Light Cycler 96仪器,并按照Tang等之前描述的标准方案进行.利用在线软件Primer3web 4.1.0(https://bioinfo.ut.ee/primer3/)设计目标基因特异性引物(表1).每个试验3次技术重复,设3个生物学重复.以小麦的甘油醛-3-磷酸脱氢酶基因(TaGAPDH
, GI: 7579063)为内参基因,采用2法计算目的基因相对表达量.
表1 qPCR 的引物列表
1.4 数据处理
试验数据值为3次独立测定的测量值的平均值,并表示为平均值±标准误差.使用Origin9.0软件作图,同时运用SPSS 18.0软件进行单因素方差分析,采用Ducan’s检验分析在0.05水平上的显著性.
2 结果与分析
2.1 外施独脚金内酯对干旱胁迫抑制小麦幼苗生长的缓解作用
植物生长状况可作为非生物胁迫影响的重要指标.在表型上,与单独的干旱胁迫相比,外施GR24 7 d后,小麦幼苗的干旱症状得到缓解,叶片黄化和萎蔫程度有所缓解,叶片较舒展,如图1所示.与P组相比,PS组植株的株高、根长(图2(a))和鲜、干重(图2(b)~(c))显著增加,其中株高增加36.7%,地上部分和地下部分鲜重分别增加103.7%和32.9%,干重分别增加40.9%和26.2%.这可能与SLs参与调控植物地上、地下部分的发育有关,因为有许多研究表明,SLs对植物分枝和根系结构有重要的调节作用.

图1 不同处理下小麦幼苗的生长状况
叶片相对含水量是衡量植物脱水耐受性最有意义的指标.与对照组(CK组)相比,干旱胁迫下(P组)叶片相对含水量显著降低,而外施GR24后(PS组)叶片相对含水量较P组显著增加,其中,7 d后,叶片相对含水量增加了12.2%(图2(d)).这可能与气孔关闭引起的蒸腾量减少有关,因为已有研究表明,SLs合成缺陷拟南芥突变体max
3和max
4比野生型拟南芥更易散失水分,这是由蒸腾作用的变化引起的.以上结果表明,SLs参与调控植物对干旱胁迫的响应,且外源SLs可缓解干旱胁迫对小麦幼苗生长的抑制作用.
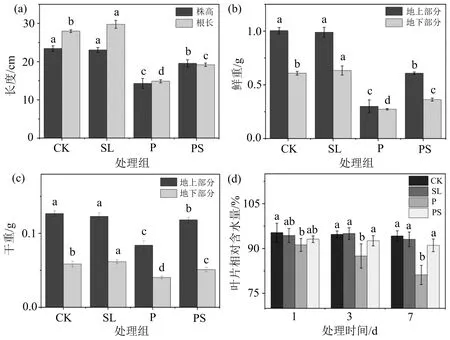
(a)为株高和根长,(b)为鲜重,(c)为干重,(d)为叶片相对含水量;不同小写字母(a,b,c,d)表示同一取样时间不同处理组间存在显著性差异(p<0.05),相同字母表示无显著性差异.图2 独脚金内酯对干旱胁迫下小麦幼苗生长状况的影响
2.2 干旱胁迫下外施独脚金内酯对叶绿素含量和光合效率的影响
叶绿素是植物进行光合作用的主要色素.干旱对小麦叶绿素含量有显著的影响,与CK组相比,P组叶绿素a、b和总叶绿素含量均显著降低(图3).随着处理时间的延长,CK组、P组和PS组的叶绿素含量均呈下降趋势(图3(a)).施加GR24的PS组较单独干旱胁迫的P组叶绿素a、叶绿素b和叶绿素总含量均明显上升(图3(a)~(c)),其中干旱处理后1~3 d,P组叶绿素总含量相对CK组下降了29.8%,PS组相对CK组下降了7.5%;7 d时,PS组的总叶绿素含量相对于P组提高了23.6%,说明施加GR24可以很大程度地缓解干旱引起的叶绿素含量下降.这与前人的报道一致,即在重金属镉胁迫下的大麦和干旱胁迫下的水稻中都观察到SLs对叶绿素含量的保护作用.在光合效率方面,干旱胁迫下,光合效率显著降低,7 d时,P组的光合效率较CK组下降了54.4%;PS组的光合效率较P组增加了84.3%(图3(d)).然而,单独的GR24处理对叶绿素含量和光合效率没有显著影响.以上研究结果表明,提高叶绿素含量和光合效率可能是SLs帮助植物适应胁迫的一种策略.
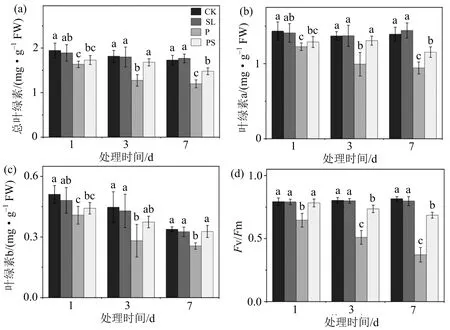
(a)为叶绿素a含量,(b)为叶绿素b含量,(c)为叶绿素总含量,(d)为Fv/Fm;不同小写字母(a,b,c,d)表示同一取样时间不同处理组间存在显著性差异(p<0.05),相同字母表示无显著性差异.图3 独脚金内酯对干旱胁迫下小麦幼苗叶绿素和光合效率的影响
2.3 干旱胁迫下外施独脚金内酯对丙二醛和过氧化氢含量的影响
干旱胁迫会诱导植物产生大量活性氧,活性氧会氧化细胞内的核酸、蛋白质和脂质等生物大分子,攻击细胞膜,造成膜损伤,导致植物细胞膜脂过氧化和氧化损伤.丙二醛(MDA)是膜脂过氧化的重要产物之一,通过测定MDA含量,可了解膜脂过氧化程度,从而间接判定膜系统受损程度及植物的抗逆性.干旱胁迫加剧了细胞膜脂过氧化程度,与CK组相比,干旱处理3 d时,P组的MDA含量增加22.5%;7 d时,P组的MDA含量显著增加85.3%(图4(a)).干旱胁迫下施加GR24,能够显著降低干旱胁迫诱导的膜脂过氧化反应,其中,7 d时,PS组的MDA含量较P组显著降低31.6%(图4(a)).
植物在干旱胁迫下会积累大量的HO,HO可以破坏细胞膜,加速细胞衰老和死亡,使核酸和蛋白质等生物大分子发生氧化反应.20% PEG-6000处理后(P组),HO含量较CK组显著上升,7 d时,较CK组显著增加112.3%,而GR24协同处理的PS组小麦幼苗内源HO水平较CK组显著增加56.5%,较P组降低了26.3%(图4(b)).

不同小写字母(a,b,c,d)表示同一取样时间不同处理组间存在显著性差异(p<0.05),相同字母表示无显著性差异.图4 独脚金内酯对干旱胁迫下小麦幼苗体内丙二醛(a)和过氧化氢(b)的影响
以上结果表明,SLs能有效降低MDA含量,抑制HO的生成,防止叶片细胞膜脂过氧化.
2.4 干旱胁迫下外施独脚金内酯对植物抗氧化能力的影响
植物通过非酶促和酶促活性氧清除系统来抵御活性氧的破坏.非酶促活性氧清除系统主要包含一些抗氧化物质,如谷胱甘肽,它可游离于细胞内或结合在蛋白上,主要以还原形式存在.笔者研究了干旱胁迫下,外源独脚金内酯处理后小麦幼苗的GSH和GSSG水平,结果如图5所示.
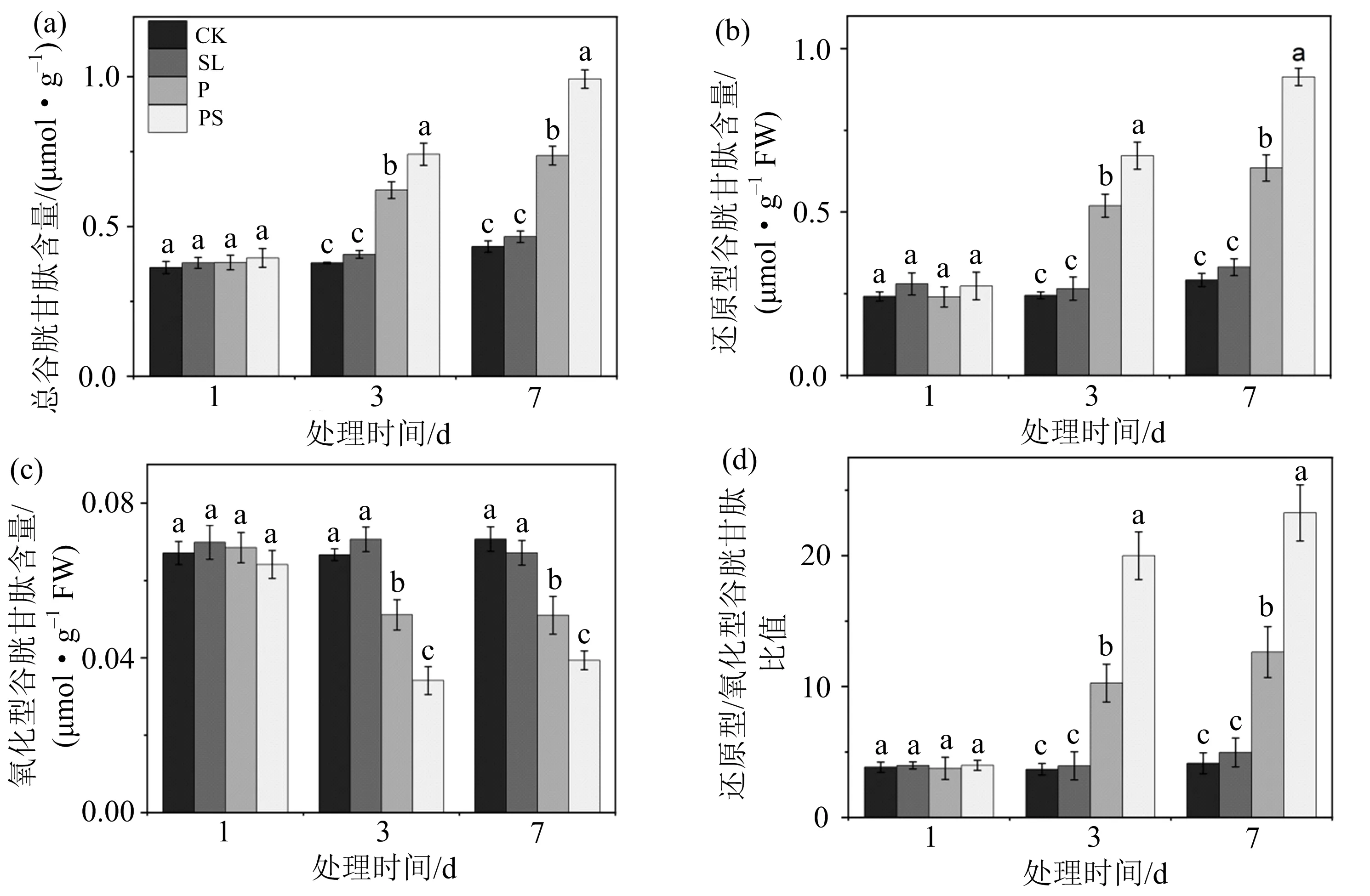
(a)为总谷胱甘肽含量,(b)为还原型谷胱甘肽含量,(c)为氧化型谷胱甘肽含量, (d)为还原型/氧化型谷胱甘肽比值;不同小写字母(a,b,c,d)表示同一取样时间不同处理组间存在显著性差异(p<0.05),相同字母表示无显著性差异.图5 独脚金内酯对干旱胁迫下小麦幼苗体内谷胱甘肽含量的影响
由图5可知,干旱胁迫能增加小麦幼苗的谷胱甘肽(GSH)含量,其中干旱处理3 d时,P组幼苗体内GSH含量较CK组显著增加111.8%;7 d时,P组GSH含量较CK显著增加117.3%(图5(b)).施加外源独脚金内酯后,谷胱甘肽含量和GSH/GSSG比值进一步提高;7 d时,PS组的GSH含量较P组显著增加43.9%,PS组的GSH/GSSG比值较P组显著增加了84.2%(图5(d)).结果表明,干旱胁迫下外施SLs能显著增加GSH含量,并提高GSH/GSSG的比值,维持叶片中较高的抗氧化能力和还原势,增强其清除细胞中过氧化物的能力,减轻活性氧对叶片的氧化损伤程度.
酶促活性氧清除系统中主要包括各种抗氧化酶,超氧化物歧化酶(SOD)是催化O歧化为HO的关键酶,然后HO被过氧化氢酶(CAT)、过氧化物酶(POD)和抗坏血酸过氧化物酶(ascorbate peroxidase, 简称APX)进一步催化成HO.
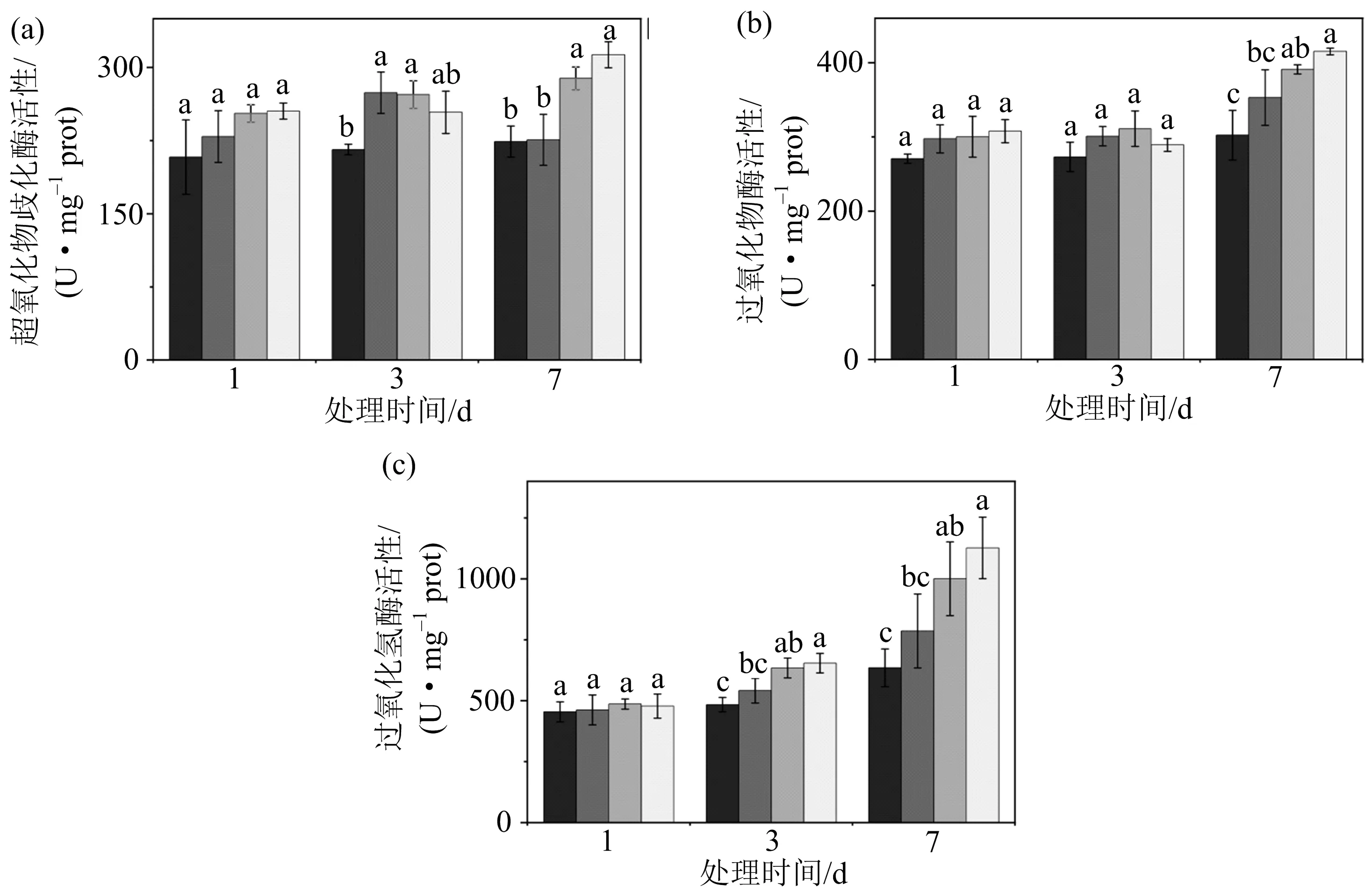
(a)为超氧化物歧化酶活性,(b)为过氧化物酶活性,(c)为过氧化氢酶活性;不同小写字母(a,b,c,d)表示同一取样时间不同处理组间存在显著性差异(p<0.05),相同字母表示无显著性差异.图6 独脚金内酯在干旱胁迫下对关键抗氧化酶活性的影响
由图6可知,干旱胁迫处理后(P组),SOD,POD,CAT活性较CK组显著提高,7 d时,分别提高28.9%,29.3%,57.6%;外施GR24后(PS组),SOD,POD,CAT的活性进一步提高,7 d时较P组分别增加了8.4%,6.2%,12.6%.这些研究结果表明,干旱胁迫诱导了包括POD,SOD,CAT在内的一系列抗氧化酶活性的提高,施加外源独脚金内酯后进一步提高了小麦叶片的抗氧化酶活性,从而加速活性氧的清除.
2.5 干旱胁迫下外施独脚金内酯对脯氨酸等渗透调节物的含量的影响
小麦叶片中含有脯氨酸(Pro)等多种渗透调节物质,Pro能够在非生物胁迫下迅速大量积累,从而维持细胞液渗透平衡,缓解逆境胁迫对细胞的伤害.干旱胁迫下外施独脚金内酯可降低脯氨酸等渗透调节物的含量,如图7所示,干旱胁迫下(P组),Pro含量较CK组显著增加,其中,3 d时,P组小麦幼苗体内Pro含量较CK组显著增加40.7%;7 d时,P组Pro含量较CK组显著增加72.8%.而GR24协同处理后(PS组)Pro含量显著降低,3 d时,PS组小麦幼苗内源Pro含量较P组降低了15.9%;7 d时,PS组内源Pro含量较P组降低了41.7%.这表明外源SLs处理显著降低了Pro含量,说明SLs能有效缓解干旱胁迫带来的不利影响,叶片不需要更多的渗透调节物质来稳定植物大分子结构.
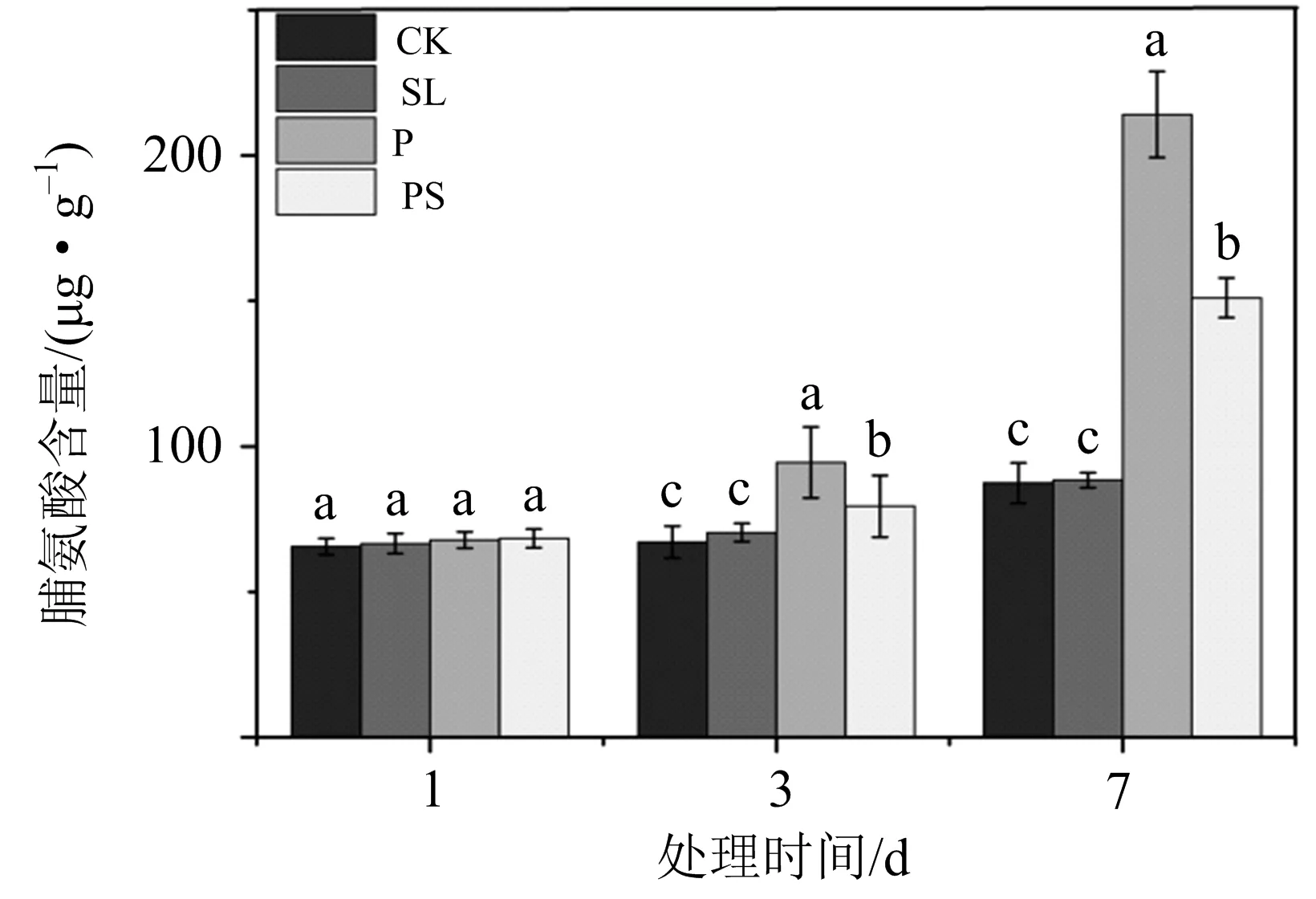
不同小写字母(a,b,c,d)表示同一取样时间不同处理组间存在显著性差异(p<0.05),相同字母表示无显著差异.图7 独脚金内酯在干旱胁迫下对脯氨酸含量的影响
2.6 独脚金内酯信号转导和ABA代谢关键基因的表达分析
在植物中,TaD
14,TaMAX
2,TaD
53是SLs的信号转导关键基因,有报道称其参与干旱和盐等非生物胁迫.在干旱胁迫下,叶片中TaD
14,TaMAX
2,TaD
53基因表达上调(图8(a)、(c)和(e)),而根中TaD
14,TaMAX
2,TaD
53基因表达显著下调(图8(b)、(d)和(f)),这与前人报道的干旱胁迫抑制了莲花根中SLs的积累的研究结果一致.Visentin等发现,在番茄根中SLs含量的减少可能是干旱胁迫的一种系统信号,使地上部分做出生理反应,从而更好地适应干旱,同时SLs含量减少也是ABA在茎中快速积累的前提.干旱胁迫下,经GR24处理后(PS组)的叶片和根中,TaD
14,TaMAX
2,TaD
53基因表达水平相对于P组均有所上调(图8).其中,叶片中基因上调水平非常显著,GR24处理72 h后,叶片中TaD
14,TaMAX
2,TaD
53基因表达量较P组分别显著增加了157.2%,144%,187.8% (图8(a)、(c)和(e));GR24处理72 h后,根中TaD
14,TaMAX
2,TaD
53基因表达量较P组分别显著增加了18.4%,23.5%,12.3%,但相对于CK组基因表达均显著下调(图8(b)、(d)和(f)).综上所述,SLs可能通过靶向特定的信号成分来响应干旱胁迫,从而在小麦幼苗应对干旱胁迫的过程中发挥作用.TaNCED
1是参与ABA生物合成的关键限速基因.笔者的研究表明,干旱胁迫诱导了TaNCED
1的表达,并且外施SLs显著上调TaNCED
1的表达,处理72 h后(PS组),叶片中TaNCED
1的表达量相对P组显著上调90.2%,根部TaNCED
1的表达量相对P组显著上调12.5%(图9(a)~(b)).TaSnRK
2s
参与ABA信号的调节,研究发现TaSnRK
2s
对非生物胁迫有响应.在干旱胁迫下(P组),根和叶片中TaSnRK
2.
3的表达量相对于CK组均显著上调,与前人的研究结果一致.在干旱胁迫下外施SLs显著提高了TaSnRK
2.
3的表达,处理72 h后,叶片中TaSnRK
2.
3的表达量相对P组显著上调281.2%,根中TaSnRK
2.
3的表达量相对P组显著上调11.7%(图9(c)~(d)).TaHYD
1是ABA分解代谢的关键基因,干旱胁迫下,其表达下调,经过外源独脚金内酯处理后,TaHYD
1的表达量进一步下调(图9(e)~(f)).研究表明,ABA在NCED
1上调和HYD
1下调的作用下积累.试验结果显示,SLs和ABA之间存在一定的相互作用,先前也有人报道过SLs~ABA的特异性相互作用.但是,SLs和ABA之间的相互作用还需要更深入的研究.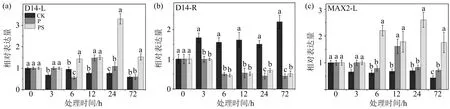
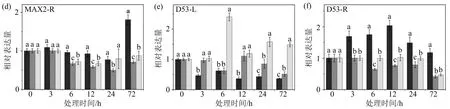
(a)和(b)为TaD14基因分别在叶片和根中的表达,(c)和(d)为TaMAX2基因分别在叶片和根中的表达,(e)和(f)为TaD53基因在叶片和根中的表达;不同小写字母(a,b,c,d)表示同一取样时间不同处理组间存在显著性差异(p<0.05),相同字母表示无显著性差异.图8 外源独脚金内酯处理对干旱胁迫下独脚金内酯信号转导基因表达的影响
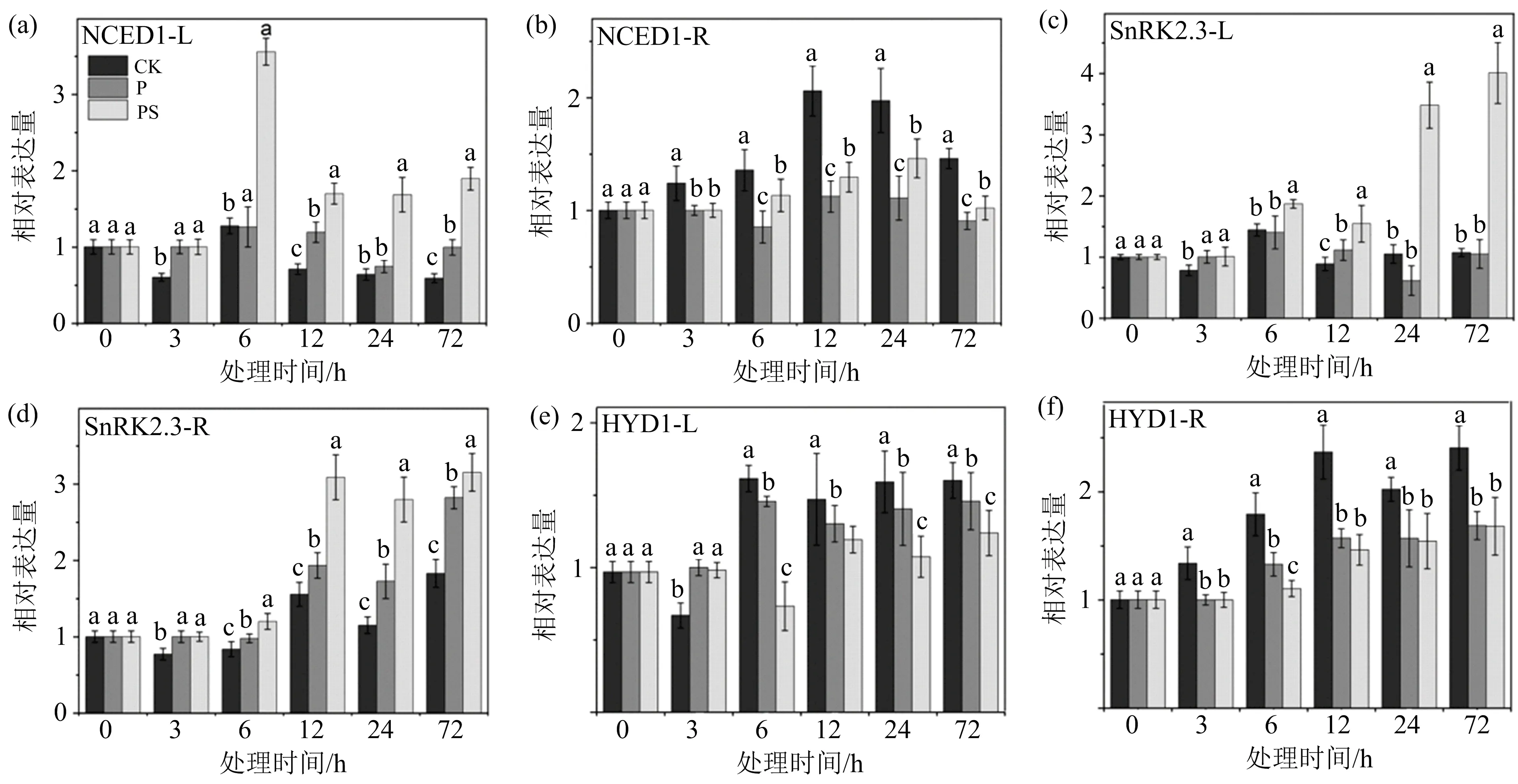
(a)和(b)为TaNCED1基因分别在叶片和根中的表达,(c)和(d)为TaSnRK2.3基因分别在叶片和根中的表达,(e)和(f)为TaHYD1基因分别在叶片和根中的表达;不同小写字母(a,b,c,d)表示同一取样时间不同处理组间存在显著性差异(p<0.05),相同字母表示无显著性差异.图9 外源独脚金内酯处理对干旱胁迫下脱落酸关键基因表达的影响
3 结束语
SLs作为一种新型植物激素,在小麦抵御干旱胁迫中起着正调控的作用.干旱胁迫下,GR24处理的小麦幼苗叶片更舒展,黄化和萎蔫的程度减轻,叶片相对含水量和叶绿素含量显著提高.外施GR24提高了SOD,POD,CAT等抗氧化酶的活性和谷胱甘肽等抗氧化物的含量;显著降低了Pro等渗透调节物的含量,从而显著降低HO含量、抑制MDA生成.同时,外施GR24还上调了SLs信号转导关键基因以及ABA生物合成和信号调节关键基因,并下调ABA分解代谢关键基因.该研究从生理和分子水平阐明了外源SLs缓解小麦干旱胁迫的机制,为进一步研究SLs调控小麦耐旱胁迫的分子机制奠定基础.

