槲皮素调节大鼠肝细胞谷胱甘肽代谢的机制
高蔚娜 边祥雨 金秀 王玲玲 麻玉莹 于艺婧 蒲玲玲 郭长江


摘 要:目的:探讨60 μmol/L槲皮素调节BRL大鼠肝细胞谷胱甘肽(GSH)代谢的可能机制。方法:采用MTT法测定槲皮素对BRL细胞活力的影响;采用试剂盒法检测细胞内GSH和GSSG的含量,以及谷胱甘肽过氧化物酶(GSH-Px)、肝脏谷胱甘肽 S转移酶(GST)、γ-谷氨酰半胱氨酸连接酶(γ-GCL)、谷胱甘肽还原酶(GR)的活性;采用实时荧光定量PCR法检测GSH-Px、GST、γ-GCL和GR基因mRNA的表达情况;采用ELISA法测定细胞内的Keap1、总Nrf2、ERK1/2、磷酸化ERK1/2(p-ERK1/2)、JNK、p-JNK,以及细胞核Nrf2的蛋白水平。结果:槲皮素不影响大鼠肝细胞的活力(P>0.05);与对照组比较,槲皮素组细胞内还原型GSH含量和GSH/GSSG比值(P<0.05)显著降低(P<0.05),γ-GCL酶活性显著减弱(P<0.05),GR和GSH-Px的mRNA表达显著减少(P<0.05),Keap1和JNK蛋白水平显著降低(P<0.05)。结论:槲皮素可减少BRL大鼠肝细胞还原型GSH的含量,这种作用主要与槲皮素抑制GSH的生成有关。
关键词:槲皮素;谷胱甘肽;γ-谷氨酰半胱氨酸连接酶;Keap1/Nrf2信号通路;MAPKs信号通路
槲皮素是一种类黄酮物质,也是分布最广泛的多酚类化合物之一,主要存在于蔬菜、水果、红酒、茶叶等食物和饮料中[1]。我国绝大多数水果和蔬菜中均含有槲皮素,尤其是水果中的山楂、冬枣、红提、石榴等,以及蔬菜中的洋葱、茴香、菠菜、球茎甘蓝、小白菜等[2]。槲皮素对人体有许多有益的作用,如抗氧化、抗炎、免疫调节、抗2型糖尿病、预防动脉粥样硬化等[3-7]。本课题组前期的研究显示[8-9],以含0.5%槲皮素的AIN93饲料饲喂大鼠,大鼠肝脏和血清中的谷胱甘肽(GSH)含量、还原型GSH与氧化型GSH(GSSG)比值显著降低;血清中的谷胱甘肽过氧化物酶(GSH-Px)活性增强;肝脏谷胱甘肽 S转移酶(GST)活性和mRNA表达显著增强,而谷氨酰半胱氨酸连接酶(GCL)活性和mRNA表达显著受抑,谷胱甘肽还原酶(GR)mRNA表达减少。本研究体外培养BRL正常大鼠肝细胞,以60μmol/L槲皮素诱导细胞内GSH含量减少,在此基础上探讨槲皮素对GSH代谢酶及相关代谢通路,如Kelch样红细胞衍生相关蛋白1(Keap1)/核因子E2样因子2(Nrf2)信号通路、丝裂原活化蛋白激酶(MAPKs)信号通路的影响,为阐明槲皮素下调GSH含量的机制,以及制定槲皮素的推荐摄入量标准提供科学依据。
1 材料与方法
1.1 细胞株与试剂
1.1.1 BRL细胞株 BRL 细胞株为正常大鼠肝细胞,购自中国科学院上海生命科学院。
1.1.2 试剂与试剂盒 槲皮素(纯度≥99.9%),美国Sigma-Aldrich公司;胎牛血清,美国Gibco Life Technologies;高糖DEME培养基,北京索莱宝科技有限公司;GSH、γ-谷氨酰半胱氨酸连接酶(γ-GCL)、GR、GSH-Px、GST试剂盒,南京建成生物工程研究所;TRIzol试剂、cDNA合成試剂盒、SYBR Green Master mix,瑞士罗氏公司;Keap1、总Nrf2、核Nrf2、细胞外信号调节激酶1/2(ERK1/2)、p-ERK1/2、c-Jun NH2-末端激酶(JNK)、p-JNK ELISA检测试剂盒,上海江莱生物科技有限公司;BCA蛋白试剂盒,上海生工生物工程股份有限公司。其余试剂均为国产分析纯。
1.2 方法
1.2.1 细胞培养及处理 将BRL细胞以4×105/mL的密度接种到含10%胎牛血清的DMEM高糖培养基中,用60 μmol/L槲皮素干预4 h后,弃培养液后加1.25%胰酶消化细胞,1 000 r/min、5 min离心收集细胞沉淀。加入适量生理盐水后,用超声破碎仪(美国Sonics & Materials公司)破裂细胞,离心(4℃,10 000 r,20 min),取上清,用于GSH、γ-GCL、GR、GSH-Px、GST活性的测定。
1.2.2 细胞活力测定 槲皮素以DMSO溶解,制成浓缩液。实验时以完全培养液将其稀释,槲皮素在培养液中的终浓度为60 μmol/L,DMSO为0.5‰(v/v)。收集细胞沉淀,加完全培养基配制成细胞悬液,密度5×104/mL,将细胞悬液接种于96孔板,每孔200 μL。以MTT法测定60 μmol/L槲皮素干预4 h后细胞的活力,每组设5个复孔。参照冯建等[10]的方法进行。
1.2.3 GSH、γ-GCL、GR、GSH-Px、GST活性测定 按照南京建成生物工程研究所的试剂盒说明书进行。以uQuant 200-999超级酶标仪(美国Biotek公司)测定相应指标的吸光度值,按照公式计算GSH、GSSG的含量,以及4种酶的活性。
1.2.4 γ-GCL、GR、GSH-Px、GST mRNA表达测定 实时荧光定量PCR法(qPCR)。参照Zhang等[11]的方法进行。采用ABI实时定量PCR系统检测荧光信号,以GAPDH为内参,计算4种酶基因的相对表达量。所用的引物如表1所示。
1.2.5 Keap1、总Nrf2、核Nrf2、ERK1/2、磷酸化ERK1/2(p-ERK1/2)、JNK、p-JNK蛋白水平测定 按照上海江莱生物科技有限公司ELISA检测试剂盒说明书进行测定。绘制标准曲线,计算蛋白的表达量。
1.2.6 蛋白定量BCA法 按照上海生工生物工程股份有限公司的试剂盒操作进行测定,以uQuant 200-999超级酶标仪测定相应指标的吸光度值,按照公式计算细胞的蛋白含量。
1.3 统计学处理
结果均以均数±标准差(±s)表示,使用SPSS 18.0 软件进行独立样本t检验。
2 结果与分析
2.1 槲皮素对细胞活力的影响
对照组、60 μmol/L槲皮素和0.5‰DMSO的吸光度值分别为(1.78±0.14)、(1.70±0.12)、(1.61±0.12)。统计分析显示,槲皮素和DMSO不影响细胞的活力(P>0.05)。
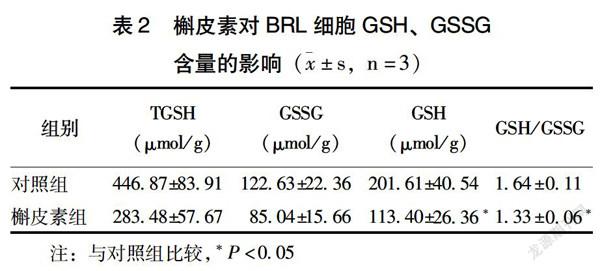
2.2 槲皮素对细胞内GSH、GSSG含量的影响
与对照组比较,60 μmol/L槲皮素组还原型GSH含量和GSH/GSSG比值均显著降低(P<0.05)(表2),说明该剂量槲皮素具有减少细胞内GSH含量,降低GSH/GSSG比值的作用。
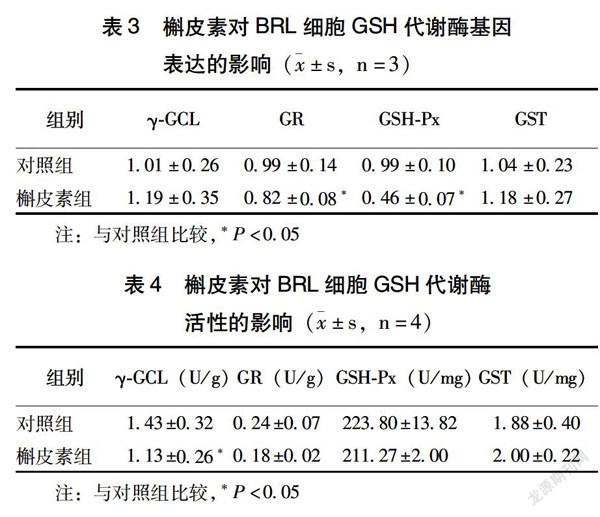
2.3 槲皮素对细胞GSH代谢酶活性和基因表达的影响
与对照组比较,槲皮素组GR和GSH-Px的mRNA表达显著减少(P<0.05)(表3),γ-GCL酶活性显著减弱(P<0.05)(表4),说明槲皮素能够减少GR和GSH-Px的基因表达,抑制γ-GCL酶活性。该浓度槲皮素对γ-GCL、GST的基因表达,以及GR、GSH-Px、GST的活性影响不明显。
2.4 槲皮素对Keap1/Nrf2信号途径的影响
与对照组比较,60 μmol/L槲皮素组Keap1蛋白表达显著降低(P<0.05),说明槲皮素能够抑制Keap1的蛋白表达。槲皮素对总Nrf2和核Nrf2蛋白表达影响不明显(表5)。
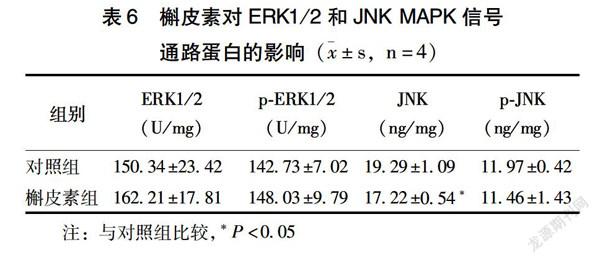
2.5 槲皮素对ERK和JNK MAPKs信号途径的影响
与对照组比较,60 μmol/L槲皮素组JNK蛋白表达显著减少(P<0.05),说明槲皮素抑制JNK蛋白的表达。槲皮素对p-JNK、ERK1/2、p-ERK1/2表达影响不大(表6)。
3 讨论
GSH是人体内含量最丰富的抗氧化剂,也是体内氧化防御体系的主要组成成分之一[12]。在参与GSH代谢的4种酶中,GST以GSH为底物,结合外源性物质和异生化合物起到解毒的作用[13]。 GSH-Px以GSH为电子供体,催化过氧化物的还原反应[14]。在这些反应中,GSH转变成其氧化形式GSSG。在GR的催化下,GSSG再生为GSH。γ-GCL是催化GSH合成的限速酶[15]。這4种GSH代谢酶中,GSH-Px和GST催化以GSH为底物的生物学反应,这些过程消耗GSH;GR催化GSH从GSSG再生为GSH,γ-GCL是GSH合成的关键酶,这两种酶活性/表达增强有助于GSH含量增加。在本研究中,60 μmol/L槲皮素显著降低BRL大鼠肝细胞内的GSH含量,降低GSH/GSSG比值,同时抑制GSH-Px和GR的基因表达,以及GCL酶活性,说明GSH生成减少是60 μmol/L 槲皮素降低大鼠肝细胞GSH含量的主要原因,GR的基因表达受抑制可能引起GSH再生减少。另外,我们以20 μmol/L 槲皮素干预BRL细胞24 h后,肝细胞内还原型GSH含量、GSH/GSSG比值显著增加,GST、γ-GCL活性显著增强,而GSH-Px活性显著下降[10],说明GSH合成增加而消耗减少是20 μmol/L 槲皮素增加细胞GSH含量的主要原因。两个浓度的槲皮素都影响了γ-GCL的酶活性,高浓度抑制该酶活性,低浓度增强该酶活性。因此,不同浓度的槲皮素可能主要通过调节γ-GCL酶活性从而引起细胞内GSH含量的变化,γ-GCL酶是槲皮素发挥GSH代谢调节作用的重要靶点。
从MTT结果来看,尽管该剂量槲皮素引起了大鼠肝细胞GSH生成减少,但细胞的活力未受影响。我们对这种情况也进行了分析。研究者用含有槲皮素的饲料处理大鼠后,槲皮素及其甲基化代谢物(包括异鼠李素和柽柳黄素)广泛分布于血浆和组织中,肝脏、肾脏和肺脏中的水平最高[16]。在前期的研究中,我们发现槲皮素大部分以其甲基化代谢产物的形式存在于血清和肝脏中[8],还发现槲皮素在 Caco-2单层细胞模拟的跨膜转运过程中伴随着广泛的代谢转化,主要以甲基化、硫酸化和葡萄糖醛酸化为主[17-18]。槲皮素的代谢物仍然具有抗氧化活性,不过作用要弱于槲皮素[19]。研究表明,部分的槲皮素代谢物会转化成槲皮素从而在组织中发挥其抗氧化作用[20-21]。我们推测槲皮素在大鼠肝细胞中应该也有类似的代谢过程。槲皮素及其代谢产物所具备的抗氧化作用,在一定程度上弥补了GSH含量减少造成的肝细胞抗氧化防御体系功能减弱,维持了细胞的正常生存状态。
槲皮素发挥抗氧化作用的一个重要途径就是Keap1/Nrf2信号通路。在正常情况下,Keapl与Nrf2耦联,并与肌动蛋白结合被锚定于胞浆中。当Keap1中的半胱氨酸残基被破坏,或者蛋白激酶诱导了Nrf2的磷酸化,则Nrf2与Keap1解耦联,那些游离的Nrf2移位到细胞核中,与小分子肌腱纤维瘤蛋白蛋白结合形成异二聚体并与抗氧化反应元件上游的启动子区域结合,从而激活多种抗氧化、解毒酶等基因的转录[22-24]。因此核内Nrf2水平决定了Keap1/Nrf2途径在激活基因表达方面是否起效。MAPKs属于丝氨酸和苏氨酸蛋白激酶家族,这类激酶与细胞的生存、死亡、增殖、分化等重要生命过程密切相关。在肝脏中,MAPKs信号途径可以被多种应激激活,如氧化应激、炎症等。JNK和ERK1/2蛋白是MAPKs家族的重要成员[25-26],当这两个蛋白分子被磷酸化后,JNK和ERK1/2信号通路被激活。其中JNK对应激起反应,而ERK1/2对增殖刺激起作用[27]。有研究认为,高浓度槲皮素可能是一种促氧化剂,生物反应过程中有可能产生自由基[28],而一些自由基可诱导ERK1/2和JNK MAPK信号通路激活[29]。本研究发现,60 μmol/L槲皮素显著减少Keap1和JNK蛋白表达,但对核Nrf2含量和p-JNK表达的影响不明显,说明在本研究的实验条件下,槲皮素仅影响Keap1和JNK的蛋白表达,而Keap1/Nrf2和JNK MAPKs通路未被激活。不过槲皮素是否通过Keap1/Nrf2和JNK MAPKs信号通路调节GSH代谢值得进一步研究。
综上所述,在体外实验条件下,60 μmol/L槲皮素减少BRL大鼠肝细胞细胞内的GSH含量,降低GSH/GSSG比值,抑制γ-GCL活性和GR的表达,因此槲皮素主要通过调节GSH的合成来发挥其对GSH代谢的调节作用。另外,在下一步的研究中,应调整实验条件,如在浓度不变的情况下改变槲皮素干预的时间,并引入MAPK信号通路抑制剂,观察槲皮素对核Nrf2、p-JNK水平的影响,并筛选更多可能与GSH代谢相关的信号通路,深入探讨槲皮素对信号途径的调节作用。
参考文献
[1]Yao L H,Jiang Y M,Shi J,et al.Flavonoids in food and their health benefits [J].Plant Foods for Human Nutrition(Dordrecht,Netherlands),2004,59(3):113-122.
[2]杨月欣.2018 中国食物成分表标准版 [M].北京:北京大学医学出版社,2018:262-283.
[3]Liu H,Zhang L and Lu S.Evaluation of antioxidant and immunity activities of quercetin in isoproterenol-treated rats [J].Molecules(Basel,Switzerland),2012,17(4):4281-4291.
[4]Carullo G,et al.Quercetin and derivatives:useful tools in inflammation and pain management [J].Future Medicinal Chemistry,2017,9(1):79-93.
[5]Abdelmoaty M A,et al. Confirmatory studies on the antioxidant and antidiabetic effect of quercetin in rats [J].Indian Journal of Clinical Biochemistry,2010,25(2):188-192.
[6]Badolato M,et al.Quercetin/oleic acid-based G-protein-coupled receptor 40 ligands as new insulin secretion modulators [J].Future Medicinal Chemistry,2017,9(16):1873-1885.
[7]Ishizawa K,Yoshizumi M,Kawai Y,et al.Pharmacology in health food:metabolism of quercetin in vivo and its protective effect against arteriosclerosis [J].Journal of Pharmacological Sciences,2011,115(4):466-470.
[8]Gao W,Pu L,Chen M,et al.Glutathione homeostasis is significantly altered by quercetin via the Keap1/Nrf2 and MAPK signaling pathways in rats [J].Journal of Clinical Biochemistry and Nutrition,2018,62(1):56-62.
[9]陳明,高蔚娜,蒲玲玲,等.槲皮素对大鼠血清谷胱甘肽水平及相关代谢酶活性的影响 [J].营养学报,2015,37(3):279-282.
[10]冯建,高蔚娜,韦京豫,等.槲皮素对大鼠肝细胞谷胱甘肽水平及其相关代谢酶活性的影响 [J].营养学报,2016,38(2):177-180.
[11]Zhang M,Xie Z,Gao W,et al.Quercetin regulates hepatic cholesterol metabolism by promoting cholesterol-to-bile acid conversion and cholesterol efflux in rats [J].Nutrition Research,2016,36(3):271-279.
[12]Hou Y,Wang Y,Wang H,et al.Induction of glutathione synthesis in human hepatocytes by acute and chronic arsenic exposure:differential roles of mitogen-activated protein kinases [J].Toxicology,2014(325):96-106.
[13]Dickinson D A and Forman H J.Cellular glutathione and thiols metabolism [J].Biochemical Pharmacology,2002,64(5-6):1019-1026.
[14]Harris E D.Regulation of antioxidant enzymes [J].FASEB journal:official publication of the Federation of American Societies for Experimental Biology,1992,6(9):2675-2683.
[15]Dringen R.Metabolism and functions of glutathione in brain [J].Progress in Neurobiology,2000,62(6):649-671.
[16]de Boer V C,et al.Tissue distribution of quercetin in rats and pigs [J].Journal of Nutrition,2005,135(7):1718-1725.
[17]李素云,李崢,王立芹,等.槲皮素在Caco-2细胞中的代谢产物分析与初步鉴定 [J].国际药学研究杂志,2019,46(2):123-129、136.
[18]李素云,李峥,王立芹,等.槲皮素在Caco-2单层细胞模型上的跨膜吸收和甲基化代谢[J].中国药理学与毒理学杂志,2019,33(4):273-280.
[19]Manach C,et al.Quercetin is recovered in human plasma as conjugated derivatives which retain antioxidant properties [J].FEBS Lett,1998,426(3):331-336.
[20]Yeh S L,Lin Y C,Lin Y L,et al.Comparing the metabolism of quercetin in rats,mice and gerbils [J].European Journal of Nutrition,2016,55(1):413-422.
[21]O’Leary K A,Day A J,Needs P W,et al.Flavonoid glucuronides are substrates for human liver beta-glucuronidase [J].FEBS Lett,2001,503(1):103-106.
[22]Nguyen T,Sherratt P J,Pickett C B.Regulatory mechanisms controlling gene expression mediated by the antioxidant response element [J].Annual Review of Pharmacology and Toxicology,2003(43):233-260.
[23]Umemura K,Itoh T,Hamada N,et al.Preconditioning by sesquiterpene lactone enhances H2O2-induced Nrf2/ARE activation [J].Biochemical and Biophysical Research Communications,2008,368(4):948-954.
[24]Sekhar K R,Rachakonda G,Freeman M L.Cysteine-based regulation of the CUL3 adaptor protein Keap1 [J].Toxicology and Applied Pharmacology,2010,244(1):21-26.
[25]Owens D M,Keyse S M.Differential regulation of MAP kinase signalling by dual-specificity protein phosphatases [J].Oncogene,2007,26(22):3203-3213.
[26]Zhang Y,Dong C.Regulatory mechanisms of mitogen-activated kinase signaling [J].Cellular and molecular life sciences,2007,64(21):2771-2789.
[27]Jiménez-Castro M B,et al.Mitogen activated protein kinases in steatotic and non-steatotic livers submitted to ischemia-reperfusion [J].International Journal of Molecular Sciences,2019,20(7):1785.
[28]Min K,Ebeler S E.Quercetin inhibits hydrogen peroxide-induced DNA damage and enhances DNA repair in Caco-2 cells [J].Food and Chemical Toxicology,2009,47(11):2716-2722.
[29]Daubney J,et al. Cardioprotective and cardiotoxic effects of quercetin and two of its in vivo metabolites on differentiated h9c2 cardiomyocytes [J].Basic and Clinical Pharmacology Toxicology,2015,116(2):96-109.
Mechanism of Quercetin on Modulating Glutathione Metabolism in Rat Hepatocytes
GAO Wei-na,BIAN Xiang-yu,JIN Xiu,WANG Ling-ling,MA Yu-ying,YU Yi-jing,PU Ling-ling*,GUO Chang-jiang*
(Tianjin Institute of Environmental and Operational Medicine,Academy of Military Medical Sciences,Academy of Military Sciences,Tianjin 300050,China)
Abstract:【Objective】 To explore possible mechanisms of quercetin(60 μmol/L)on glutathione(GSH)metabolism in BRL rat hepatocytes.【Method】 The viability of hepatocytes was measure by MTT method.Intracellular GSH and GSSG contents,as well as activities of glutathione peroxidase(GSH-Px),glutathione s-transferase(GST),γ-glutamic cysteine ligase(γ-GCL)and glutathione reductase(GR)were measured by commercial kits.Message RNA expressions of GSH-Px,GST,γ-GCL and GR genes were assayed by quantitative real-time PCR method.Protein levels of Keap1,total Nrf2,ERK1/2,phosphorylated ERK(p-ERK1/2),JNK,p-JNK,and nuclear Nrf2 were determined by ELISA method.Protein quantification was assayed by BCA method.【Result】 Quercetin had no effect on viability of rat hepatocytes(P>0.05).Compared with control,intracelluar GSH content and GSH/GSSG ratio were decreased distinctly(P<0.05),activity of γ-GCL was weakened notably(P<0.05),mRNA expression of GR and GSH-Px was reduced remarkably(P<0.05),and protein levels of Keap1 and JNK were decreased significantly in quercetin group(P<0.05).【Conclusion】 Quercetin reduces the content of reduced GSH in BRL rat hepatocytes,which was mainly due to the inhibition of GSH production.
Keywords:quercetin;glutathione(GSH);γ-glutamic cysteine ligase(γ-GCL);Keap1/Nrf2 signal transduction pathway;MAPKs signal transduction pathway
基金項目:国家自然科学基金面上项目(项目编号:81372988)。
作者简介:高蔚娜(1977— ),女,博士,副研究员,研究方向:植物化学物的生物学活性。
共同通信作者:蒲玲玲(1979— ),女,硕士,高级实验师,研究方向:植物化学物的生物学功能;郭长江(1963— ),男,博士,研究员,研究方向:植物化学物的生物学活性。

