胸腔镜肺段与肺叶切除并淋巴结清扫治疗老年NSCLC效果比较
邹金标,辛娣,曲宝迪,单清华,于文娟
(1 青岛市第八人民医院心胸外科,山东 青岛 266100; 2 青岛大学附属医院病理科)
肺癌是威胁人类生命健康的常见恶性肿瘤,根据病理组织学分类可分为小细胞肺癌及非小细胞肺癌(NSCLC),其中NSCLC占80%~85%[1]。得益于影像技术发展及居民健康意识的提高,当前有越来越多NSCLC在早期被发现,使得病人早期行根治性手术成为可能[2]。随着微创理念普及以及腔镜技术发展,传统开胸手术因创伤较大在临床应用越来越少,胸腔镜肺叶切除联合淋巴结清扫已成为早期NSCLC的标准术式[3]。但肺段切除可在确保肿瘤病灶切除同时,更好保护病人肺功能,其应用逐渐受到临床重视[4]。本研究将全胸腔镜肺段切除联合淋巴结清扫用于老年NSCLC病人治疗,并与传统胸腔镜肺叶切除联合淋巴结清扫进行比较,旨在观察其对病人呼吸功能及预后影响。
1 资料与方法
1.1 一般资料
收集2015年1月—2017年12月于青岛市第八人民医院心胸外科行全胸腔镜根治术的老年NSCLC病人113例,对其临床资料进行回顾性分析。纳入标准:①年龄60~80岁;②胸部CT显示肺部结节直径≤2 cm,且实性成分>50%;③未见肺内及远处转移;④术后病理证实TNM分期ⅠA2期及更早分期NSCLC;⑤术前ASA分级Ⅰ~Ⅱ级;⑥术前未接受放化疗,临床资料完整;⑦无明显手术禁忌证。排除标准:①合并有严重基础疾病(糖尿病、高血压、慢性阻塞性肺疾病及缺血性脑血管病等);②术前进行放化疗;③术中中转开胸手术;④术后病理提示良性结节;⑤Ⅱ期以上NSCLC或小细胞肺癌;⑥同期行肺段及肺叶切除;⑦临床资料不全。肺段切除术的适应证为在不增加手术风险且技术允许的前提下可用于以下情况。①肺功能差或因其他严重并发症,而不能耐受肺叶切除术。②CT提示为肺内周围型非侵袭性病变(指位于肺实质外侧1/3),且病变直径≤2 cm,并具有以下任一特征:病理证实为单纯的原位腺癌(AIS);CT随防1年以上高度怀疑为恶性肿瘤,磨玻璃样成分≥50%;影像学检查证实肿瘤倍增时间≥400 d;术中需要保证切除肺组织切缘距离病变边缘≥2 cm,或切缘距离≥肿瘤直径,快速病理检查结果显示为切缘阴性。113例病人根据手术方式不同分为:肺段组58例,肺叶组55例。肺段组男26例,女32例,年龄60~80岁,平均(66.82±5.29)岁。结节直径0.7~2.0 cm,平均(1.63±0.34)cm。结节部位:左上叶16例,左下叶12例,右上叶20例,右下叶10例。病理类型:附壁型腺癌9例,腺泡型腺癌14例,乳头型腺癌15例,微乳头型腺癌5例,黏液腺癌1例,鳞癌10例,腺鳞癌4例;TNM分期ⅠA1期31例,ⅠA2期27例。肺叶组男31例,女24例,年龄60~80岁,平均(66.02±4.72)岁。结节直径为0.8~2.0 cm,平均(1.69±0.27)cm。结节部位:左上叶19例,左下叶10例,右上叶15例,右下叶11例。病理类型:附壁型腺癌7例,腺泡型腺癌12例,乳头型腺癌17例,微乳头型腺癌6例,鳞癌8例,腺鳞癌5例;TNM分期ⅠA1期21例,ⅠA2期34例。两组基线资料比较差异无统计学意义(P>0.05)。
1.2 手术方法
肺段组行气管插管下全麻,取健侧折刀卧位,单肺通气。采取完全胸腔镜三孔法进行手术。根据CT影像检查,明确病灶位置;将纵隔胸膜打开,游离解剖段门区,使靶段动脉、段间或段内静脉、支气管暴露,采用直线切割缝合器沿叶间肺动脉将靶段肺动脉分支离断,分离、阻断靶段支气管,自肺静脉向远端游离,使段间或段内静脉暴露,处理段内静脉并保留段间静脉。患肺行纯氧通气,采用肺膨胀-萎陷法明确段间平面,并用电凝钩灼肺表面标记,沿标记采用直线切割缝合器切开。术中根据病灶、支气管切缘、肺切缘及淋巴结冷冻病理检查结果等,决定是否行扩大切除,最后再进行纵隔淋巴结清扫,右侧清扫2、4、7、8、9组,左侧清扫4~9组,并对10~12组淋巴结采样。创面充分止血,检查有无漏气,冲洗胸腔后,于观察孔放置1根引流管,常规缝合、关胸。肺叶组行常规胸腔镜肺叶切除并淋巴结清扫术[5]。
1.3 观察指标
①围术期指标:比较两组手术时间、术中出血量、淋巴结清除数、术后胸腔引流时间、总引流量及术后住院时间等。②术后并发症:记录两组术后切口感染、肺部感染、肺不张、肺漏气、乳糜胸及心房颤动等主要并发症发生情况。③呼吸功能:于术前、术后采用肺功能检测仪检测病人肺功能,包括第1秒用力肺活量(FEV1)、用力肺活量(FVC)、第1秒用力肺活量占用力肺活量比值(FEV1/FVC)等参数。④预后:随访2年,统计两组复发率及病死率。
1.4 统计学方法
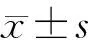
2 结 果
2.1 两组围术期指标比较
肺段组手术时间显著长于肺叶组(t=2.776,P<0.05),术后住院时间则显著短于肺叶组(t=4.875,P<0.05),两组术中出血量、淋巴结清除数、胸腔引流时间及引流量等比较差异无统计学意义(P>0.05)。见表1。
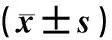
表1 两组病人围术期指标比较
2.2 两组术后并发症发生率比较
肺段组病人术后并发症总发生率为8.62%,肺叶组为10.91%,两组比较差异无统计学意义(P>0.05)。见表2。

表2 两组病人术后并发症发生率比较(例(χ/%))
2.3 两组手术前后呼吸功能指标比较
肺段组术后FEV1、FVC、FEV1/FVC较术前降低,但差异无统计学意义(P>0.05);肺叶组术后FEV1、FVC、FEV1/FVC均显著低于术前,差异均有统计学意义(t=2.785~4.301,P<0.05)。肺段组FEV1、FVC、FEV1/FVC术后降低比例均显著低于肺叶组,差异均有统计学意义(t=10.548~19.699,P<0.05)。见表3。
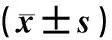
表3 两组手术前后FEV1、FVC、FEV1/FVC比较
2.4 两组随访结果比较
两组术后均接受2年随访,肺段组有效随访病例55例(3例失访),肺叶组为53例(2例失访),随访率95.57%。两组随访期间无肿瘤原因所致死亡病例,肺段组2例发生局部复发(同一肺叶内出现转移病灶),复发率3.44%,肺叶组1例发生局部复发(同侧肺叶和同侧胸膜出现转移灶),复发率1.82%;两组复发率差异无显著性(P>0.05)。
3 讨 论
胸腔镜肺叶切除相较传统开放术式具有精准、微创优势,目前是早期NSCLC主流术式。但肺叶切除并非以最小的手术创伤获取更好疗效的微创方式[6]。解剖性肺段切除对肺组织完整性破坏更小,且肺段拥有相对独立循环血供、独立支气管,原则上符合肿瘤切除要求,因此在NSCLC治疗中受到重视[7]。尤其是对老年病人而言,更小的手术创伤往往意味着更快的术后恢复、更少的并发症,对提高病人的术后生存质量十分重要,因此,肺段切除在老年NSCLC病人中展现出良好的应用前景[8]。
手术时间是术中对病人损伤评估的一项重要指标,其主要受手术复杂程度、操作者熟练程度等因素的影响。本研究显示,肺段组手术时间明显长于肺叶组,这可能一方面因为肺段临床解剖更复杂,术中操作更精细,需等待段平面出现、分辨靶段及保留段等过程相关;另一方面肺段切除开展时间较短,其学习曲线较长,操作者熟练程度不及肺叶切除术,故最终手术耗时更长[9]。术中出血量、术后引流时间及引流量与手术创伤密切相关。本研究显示,肺段组术中出血量、术后引流时间及引流量与肺叶组比较均无显著差异。但既往有报道显示,肺段组术后引流时间及引流量短于或低于肺叶组[10],这可能因为行肺段切除可减少肺组织切除量,术后残腔小、渗出量更少。本研究结果与其存在一定差异,后期可扩大样本量进一步观察。淋巴结清扫是根治性肺癌手术的重要内容,其范围、数量、病理结果等可影响术后病理分期、辅助治疗及预后[11]。本研究两组病人均尽可能行系统淋巴结清扫,结果显示两组淋巴结清除枚数比较差异无统计学意义。此外,本研究还显示,肺段组术后住院时间显著短于肺叶组,提示行肺段切除更利于病人早期康复。
术后并发症是反映手术安全性的重要指标。本研究显示,肺段组术后并发症总发生率为8.62%,肺叶组为10.91%,二者比较差异无统计学意义,说明两种术式安全性相当。本研究病人术后并发症主要为切口感染、肺部感染、肺不张、肺漏气、乳糜胸及心房颤动等,两组各出现1例切口感染,经局部换药后切口愈合良好;肺段组、肺叶组术后分别发生1例、2例肺部感染,经抗感染、纤维支气管镜吸痰等常规治疗后治愈;肺叶组出现1例肺不张,通过指导呼吸锻炼、有效咳嗽等干预后肺复张;肺段组和肺叶组分别出现2例与1例肺漏气,经闭式引流负压吸引后残气腔缩小,肺膨胀症改善;两组各出现1例乳糜胸,经抗感染、禁食、静脉营养等处理后好转;肺叶组发生1例心房颤动,经强心复律、维持水电解质平衡等处理恢复正常心率。
肺组织切除可一定程度上影响病人呼吸功能,且与切除范围密切相关。理论上而言,行肺段切除为解剖学意义上切除,可保留更多正常肺组织,能减少肺功能损伤[12]。本文研究结果显示,两组术后FEV1、FVC、FEV1/FVC均较术前降低,但肺段组术后FEV1、FVC、FEV1/FVC降低百分比均显著低于肺叶组,提示行肺段切除病人呼吸功能恢复优于肺叶切除。受研究时间限制,本研究仅对病人术后进行2年随访,结果显示,两组均无肿瘤所致死亡病例,且局部复发率分别为3.45%和1.82%,二者比较差异无显著性。黎小龙[13]对12篇相关研究共2 058例病人进行meta分析显示,早期NSCLC病人行肺段切除与肺叶切除术后1、3、5年复发率及生存率均无显著差异,提示两种手术对早期NSCLC远期疗效相当。
综上所述,胸腔镜肺段切除或肺叶切除均是老年早期NSCLC治疗的有效术式,其中肺段切除在降低肺组织损伤、促进术后恢复、减轻呼吸功能损伤等方面更具优势,值得老年病人优先选择。当然,受肺段切除严格的适应证限制,其并不能完全取代肺叶切除,但仍值得临床优先考虑,以进一步降低病人手术创伤,促进术后恢复。本研究的样本量较少,后期还需加大样本量进一步探讨更有效的NSCLC的手术方式。