HPLC测定醋酸阿比特龙的含量与有关物质
杜 超,罗 舟,卓秋琪,唐 云,李 伟
HPLC测定醋酸阿比特龙的含量与有关物质
杜 超1,2,罗 舟2,卓秋琪2,唐 云1,*李 伟1
(1. 宜春学院化学与生物工程学院,江西,宜春 336000;2. 深圳万乐药业有限公司,广东,深圳 518029)
本实验建立HPLC测定醋酸阿比特龙的含量与有关物质,为醋酸阿比特龙质量综合评价和控制提供参考。采用 Eclipse plus C18 (5 μm,4.6 mm×250 mm),流动相A:乙腈溶液(含2 %异丙醇) B:0.01 mol/L的醋酸铵溶液,流速:1.0 mL/min,波长:254 nm,梯度洗脱。实验结果显示,其在0.3033~1.0111 mg/mL范围内,具有良好的线性关系,平均回收率为99.41 %(RSD=1.10 %),且能与有关物质可实现很好分离。在16 h内溶液稳定性良好,RSD=0.33 %;定量限为0.97 ng,检测限为0.291 ng。该法简单、便捷、精准、灵敏度高,适用于醋酸阿比特龙含量与有关物质测定。
醋酸阿比特龙;HPLC;含量测定;有关物质
醋酸阿比特龙可抑制CYP17酶,主要用于治疗转移性去势抵抗前列腺癌(mCRPC)[1-5]。相比于其他药物,该药物使患者生存率提高了36%,中位总生存期增加到14.8个月。而且它还显著增加了疾病进展时间和PSA反应率。
近年来,醋酸阿比特龙的作用机理和临床应用研究取得了很大进展。它通过药物与基因的相互作用,可以让mCRPC 患者的ASA受到很大的抑制,进而使雄激素的分泌减少,使癌细胞受到抑制而发挥治疗作用,从而提高mCRPC患者的生存率[6-11]。
醋酸阿比特龙单独使用时,具有活性强、选择性高的特点。同时,其多种联合治疗方案,在治疗前列腺癌时而被欧美国家列为前线治疗药物。其与泼尼松联合治疗mCRPC,使患者的总生存期延长4.4月,且不良反应率显著降低且可控[12-15]。
虽然已有文献报道了醋酸阿比特龙的测定方法,但尚未进行深入的研究。而且,前者分析方法不够简单且成本较高。目前,该药在国内尚未全面推广,市场前景良好。因此,建立一种简便、可靠的测定醋酸阿比特龙的方法具有重要意义,可为以后该药物研究提供一定参考依据[16-18]。
1 仪器与试剂
1.1 仪器
LC-20AT(岛津);SPD-M20A检测器;SIL-20AC自动进样器;DGU-20A5在线脱气机;电子天平。
1.2 试剂
异丙醇(Fisher,色谱纯,192060);醋酸铵(AR,190525);异丙醇(色谱纯,192060);乙腈(Merck,色谱纯,JB086630);醋酸阿比特龙(深圳万乐药业有限公司,批号190817、190819、190821);工作对照品:190817-1(湿品含量:99.7%)。
2 方法与结果
2.1 色谱条件与系统适用性
色谱柱:Eclipse plus C18,5 μm 4.6 mm×250 mm;流动相A:乙腈溶液(含2 %异丙醇)B:0.01 mol/L的醋酸铵溶液;流速:1.0 mL/min;波长:254 nm;柱温:25 ℃;梯度洗脱。
表1 流动相梯度洗脱表
Table 1 Mobile phase elution table
时间(min)A(%)B(%) 07525 109010 309010 407525 457525

图 1 醋酸阿比特龙系统适应性色谱图
从上述的系统适应图谱中可以看出,醋酸阿比特龙与各有关物质都能实现有效分离。主峰的保留时间为19.3 min,各个色谱峰之间的分离度为4.3、2.1、3.1、2.2、4.1、3.8、23.3、13.4、7.9。此条件下各色谱参数较为理想,因此初步将此液相条件确定为有关物质检查的液相条件。
2.2 溶液的配制
准确称量,加入乙腈溶液(含2%异丙醇)溶解适量的供试品/对照品,制备成浓度为0.5 mg/mL的溶液。
2.3 有关物质检测方法
2.3.1 方法专属性试验
2.3.1.1 未破坏样品溶液
破坏试验前供试品溶液的测定:取醋酸阿比特龙9.5 mg,置10 mL量瓶中,按色谱条件中溶液的配制方法配制。
2.3.1.2 强酸破坏试验
室温条件下,精密称取醋酸阿比特龙10.49 mg,放置于10 mL的容量瓶中,准备稀释盐酸,并加入盐酸溶液(1mol/L)1 mL。使样品浸润、润湿、溶解后,于室温中放置14 d。破坏结束后,滴加氢氧化钠溶液(1mol/L)调节pH至中性(防止剧烈条件对仪器损坏)。最后用流动相A稀释至刻度。
2.3.1.3 氧化破坏试验
室温条件下,精密称取醋酸阿比特龙10.08 mg,放置于10 mL容量瓶中,加入过氧化氢浓溶液(30%)1mL。使样品浸润、润湿、溶解后,于室温放置14 d。破坏结束后,用流动相A稀释至刻度。
2.3.1.4 光照破坏试验
室温条件下,取适当样品,在日光灯10000 lx下放置10 d,紫外灯90 uW•cm-2,2 d。取样13.4 mg,置10 mL量瓶中,并溶解稀释至刻度。
2.3.1.5 高温破坏试验
室温条件下,取本品适量,分别放置于130℃烘箱放置8 h,60℃烘箱放置10 d。待上述样品,冷却至室温,分别精密称取60℃10 d样品13.8 mg,分别用流动相A溶解并稀释至刻度。
2.3.1.6 强碱破坏试验
室温条件下,精密称取醋酸阿比特龙9.6 mg,放置于10 mL量瓶中,加入氢氧化钠溶液(1 mol/L)1 mL,使样品浸润、润湿、溶解后,于室温中放置92 h。破坏结束后,滴加盐酸溶液(1 mol/L)调节pH至中性(防止剧烈条件对仪器损坏)。最后用流动相A稀释至刻度。
将上述破坏溶液、样品和空白溶液,各取10 µL,注入色谱仪。同时,还考察了醋酸阿比特龙在不同的破坏条件下,主峰的成分与降解过程中杂质的相互分离作用情况、出现的位置以及降解杂质的数量。结果表明,醋酸阿比特龙的主峰成分可与在破坏条件中的的各杂质实现有效分离。破坏试验的质量平衡均在95% ~ 105%之间,质量平衡良好。
通过高效液相色谱仪中的SPD-M20A检测器,对上述溶液的主成分峰,进行纯度检测,并结合各图谱,利用峰面积归一化法,得出各主峰的主成分均大于90%。综合上述破坏试验数据,可知该方法的专属性良好。破坏试验结果见图2和表2。
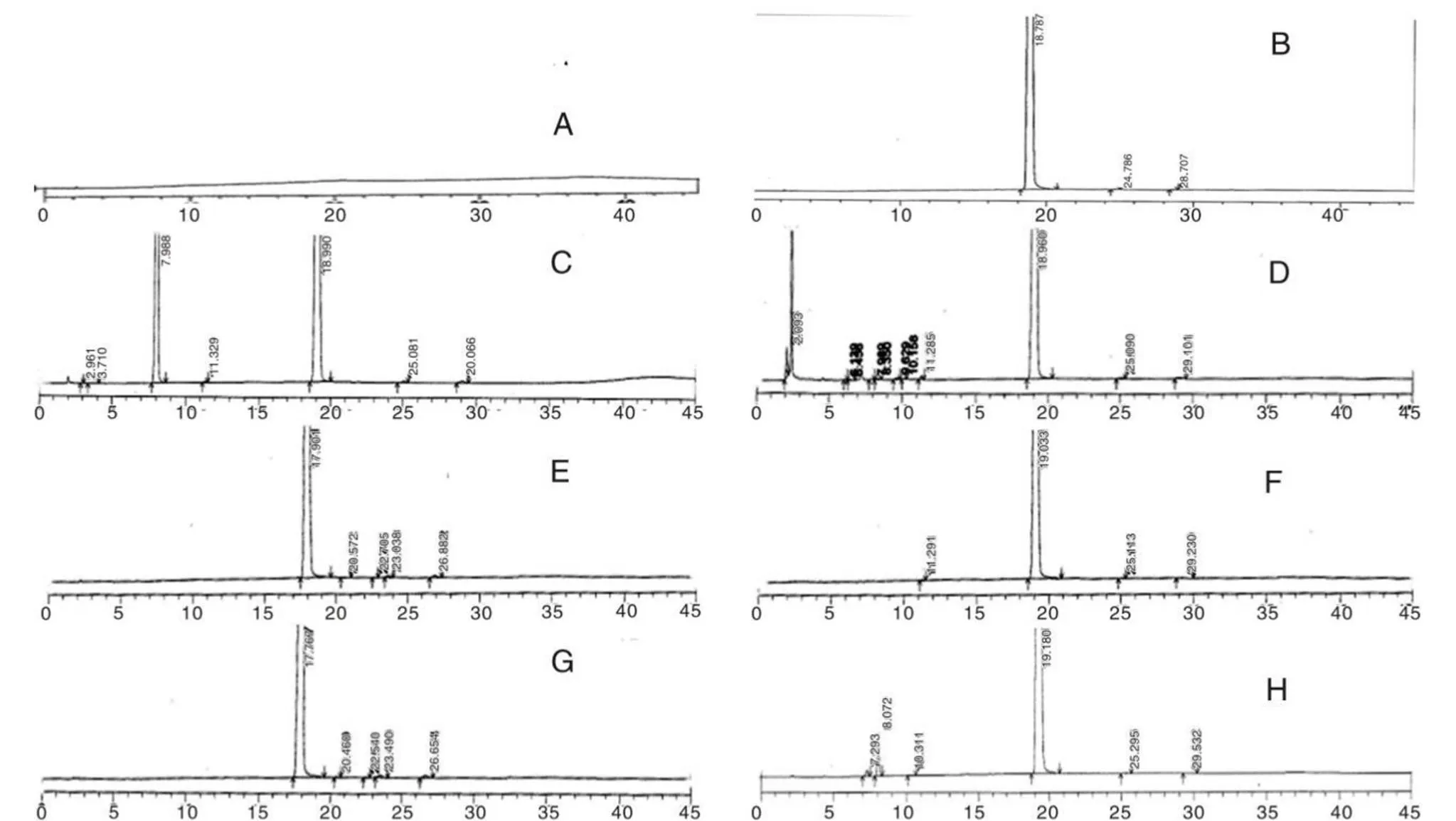
A:空白;B:样品;C:酸实验;D:氧化实验 E:强光实验;F:高温实验(105 ℃ 6 h);G:高温实验(60 ℃10 d);H:碱实验
表2 破坏实验结果
Table 2 Destruction experiment results
破坏实验内容杂质保留时间杂质个数质量平衡情况(%) 破坏前25.2、29.42/ 酸破坏3.0、3.7、8.0、11.3、25.1、29.16100.0 氧化破坏2.1、4.6、6.5、2.1、6.1、6.5、8.0、8.3、9.6、10.2、11.3、25.1、29.110104.2 光照破坏20.6、22.7、23.6、26.94101.3 热破坏(105℃6 h)11.3、25.1、29.23104.7 热破坏(60℃10 d)20.5、22.5、23.5、26.7499.2 碱破坏7.3、8.1、10.3、25.3、29.55103.6
2.3.2 定量限与检测限
准确称量适量对照品,将其溶解在流动相A中,并稀释到含0.97 mg/mL的醋酸阿比特龙溶液中,利用逐级稀释的方式,进行稀释。当溶液的浓度为97 ng/mL时,进样10 μL,S/N约为10,故定量限为0.97 ng;当溶液的浓度为29.1 ng/mL时,S/N约为3,进样10 μL,故检测限为0.291 ng。
2.3.3 稳定性试验
精密称取醋酸阿比特龙(190817)13.61 mg,置于25 mL量瓶中,用乙腈溶液(含2%的异丙醇)溶解稀释至刻度。再进行时间控制,分别在0、2、4、6、8、10、12、14、16 h进样观察。计算平均峰面积和RSD值,根据数据显示,RSD值为0.33 %,则证明在16 h 内该系统适用性溶液较稳定。
2.3.4 重复性试验
取醋酸阿比特龙(190821)适量,精密称定,称重分别为10.0、10.2、11.3、11.1、10.0、10.1 mg。按照溶液配制方法进行制备。进样10 μl,记录数据。
最大单杂(%)分别为0.016、0.016、0.016、0.015、0.015、0.015。总杂(%)分别为0.032、0.032、0.031、0.031、0.031、0.032。结果表明,单杂与总杂都维持在一定范围,故此法的结果重复性良好。
2.3.5 耐用性试验
2.3.5.1 流速的改变
原始色谱条件中调整流速为0.95、1.05 mL/min,取样品适量,按照溶液配制方法进行制备。进样10 μL,注入色谱仪,结果见表3。
2.3.5.2 波长的改变
原始色谱条件中调整波长为(254±2)nm,取样品适量,按照溶液配制方法进行制备。进样10 μL,注入色谱仪,数据结果见表3。
2.3.5.3 流动相成分的改变
原始述色谱条件中的初始水相比例调整为75%±2%,取样品适量,按照溶液配制方法进行制备。进样10 μL,注入色谱仪,数据结果见表3。
原始述色谱条件中的梯度末端水相最高比例调整为10%±2%,取适量样品,按溶液配制方法配制。注入10 μL,注入色谱仪,数据结果见表3。
2.3.5.4 柱温的耐用
原始色谱条件中的柱温改为25℃±5℃,取样品适量,按照溶液配制方法进行制备。进样10 μL,注入色谱仪,数据结果见表3。
2.3.5.6 不同色谱柱的耐用
原始色谱条件中的色谱柱改Eclipse plus C18为Extent C18柱进行试验,取样品适量,按照溶液配制方法进行制备。进样10 μL,注入色谱仪,数据结果见表3。
表3耐用性数据总结
Table 3 Summary of durability data
条件峰间分离度最大单杂%总杂质% 起始条件28.4、5.7、19.90.0120.027 流速0.9529.1、5.9、20.50.0120.027 1.0522.3、28.5、5.8、20.10.0120.028 波长252 nm28.4、5.7、19.90.0120.028 256 nm28.4、5.7、20.00.0120.028 初始比例73%27.1、5.6、19.70.0110.027 77%29.4、5.8、19.60.0120.028 末端比例8%27.9、5.6、19.00.0130.028 12%28.5、5.9、19.90.0130.029 柱温20℃26.8、5.8、20.20.0120.027 30℃28.3、6.0、20.40.0120.028 不同色谱柱22.7、6.0、20.70.0100.025
耐用性结果表明,当设定的色谱条件发生细微改动时,各杂质相对保留时间基本稳定,各杂质的检出量未发生明显变化,且各杂质分离良好。因此,证明该方法的耐用性良好。
2.4 含量测定方法
2.4.1 标准曲线的绘制
取样101.21 mg,置100 mL量瓶中,用流动相A溶解稀释至刻度作原液用,并作线性溶液⑥。取其3.0、4.0、5.0、6.0、7.5 mL,分别置10 mL量瓶中,稀释至刻度。分别作线性溶液①、②、③、④、⑤。进样10 μL,注入色谱仪,并作图计算。
通过结果可知,在0.3033~1.0111 mg/mL浓度范围内,回归方程为:y = 14974430.06 x - 70233.49(n = 6) r = 1.0000。因此,醋酸阿比特龙样品溶液呈现良好的线性关系。
2.4.2 仪器精密度试验
取上述线性溶液③,重复进样6次,各吸取10µL,利用峰面积归一化法来考察精密度。通过仪器精密计算得到峰面积的平均值及RSD等相关数据。其中RSD值为0.02 %,证明该方法进样精密度良好。
2.4.3 重复性试验
精密称取,醋酸阿比特龙(190817)6份,每份约12.5 mg,置25 mL量瓶中,用流动相A溶解,稀释至刻度。取10 mL注入色谱仪。平均含量为101.26 %,RSD=0.62 %,证明该法重复性良好。
2.4.4 回收率试验
取醋酸阿比特龙(190817)9份,每份约6.2 mg,置于25 mL量瓶中,分低中高三个浓度,每个浓度3份,低浓度的样品加80 %的线性溶液9.3 mL,中浓度的样品加100 %的线性溶液12.5 mL,高浓度的样品加120 %的线性溶液14.6 mL,稀释至刻度。取10 mL注入仪器,结果见表4。
表4 醋酸阿比特龙回收率试验结果
Table 4 Abiraterone acetate recovery test results
重量(mg)原始浓度(mg/mL)测得浓度(mg/mL)回收率%平均回收率%RSD% 6.150.15040.149799.5199.411.10 6.200.15040.148098.36 6.080.15040.1525101.34 6.240.25280.248498.26 6.310.25280.248998.48 6.140.25280.252299.78 5.670.35430.349798.71 5.540.35430.3559100.46 5.610.35430.353699.80
上述数据中平均回收率为99.41 %,RSD值为1.10%,符合回收率的要求,从而证明本法的准确度较好,故此法适合本品的含量测定。
2.5 样品的有关物质及含量测定
按照“2.1”项的色谱条件进行检测,结果见表5。
表 5 醋酸阿比特龙有关物质及含量测定结果
Table 5 Related substances and results of determination of abiraterone acetate
批号杂质个数最大杂质/%总杂质/%含量/% 19081740.0150.031101.67 19081930.0110.02899.86 19082140.0130.030100.62
通过上述数据可知,样品的单杂与总杂数量都维持一定水平,且含量处于相对稳定的水平,因此,该方法适用于醋酸阿比特龙有关物质及含量测定结果。
3 讨论与小结
3.1 稀释剂的选择
由于醋酸阿比特龙中主成分在水相中溶解度不好,所以选择2 %的异丙醇的乙腈作为稀释剂,做到有效的溶解。
3.2 检测波长的确定
称取醋酸阿比特龙适量,用乙腈溶液(含2 %的异丙醇)稀释至适宜浓度。再选择适当波长范围,使其在200~400 nm扫描溶液。
实验结果表明,醋酸阿比特龙最大吸收波长分别为254 nm 和230 nm这两个波长。而且,在254 nm范围内,醋酸阿比特龙及其各杂质均有吸收,从而表明在该波长检测可得到良好的分离效果。同时该样品在该波长范围内,检测基线噪音较小。故选择254 nm作为有关物质的检测波长。
3.3 色谱柱的选择
本实验采用Eclipse plus C18,Extent C18等型号的色谱柱,在对醋酸阿比特龙进行测定时,从色谱图中可以看出,各峰的分离度、相对保留的时间、理论层数均可以保证实验结果符合要求。而且,使用Eclipse plus C18柱时,各峰理论塔板数相对较高,对称性较好,故采用Eclipse plus C18柱。
3.4 含量测定对照品的选择
醋酸阿比特龙研制过程中使用了自制对照品。供试品190817批原料纯度为99.97 %,水分为0.11 %,残留溶剂0.14%,炽灼残渣0.039 %,则本品按无水无溶剂物计,含C26H33NO2为99.68 %,即99.7 %;按湿品计为99.9 %。该批原料质量满足对照品质量标准,对照品批号定为100817-1。
3.5 测定方法评价
(1)因溶剂(乙腈溶液(含2%的异丙醇))不干扰主成分及杂质的检测,因此确定为空白溶剂。
(2)按色谱条件,样品连续进样六次,测得RSD为0.02 %,样品之间的差值较小,因此证明该方法精密度良好。
(3)样品在16 h 内主成分峰面积的RSD值为0.33%,主成分以及各杂质的比例都处于较稳定的区间,则证明在16h内该系统适用性溶液较稳定。
(4)经过线性回归,主成分浓度约在0.3033 ~1.0111 mg/mL之间时,r = 1.0000,符合样品的要求,呈现良好的线性关系。
(5)各批样品主成分回收率均处于80%~ 120 %的范围内,且回收率RSD值均小于2 %,则证明回收率结果良好。
(6)当设定的色谱条件发生细微改动时,各杂质相对保留时间基本稳定,各杂质的检出量未发生明显变化,且各杂质分离良好,依旧适用于醋酸阿比特龙的检查分析,因此证明该法耐用性良好。
(7)醋酸阿比特龙主峰可与各有关物质和降解杂质实现有效分离,且各主峰的主成分均大于90%。结果证明,该方法具有很好的专属性。
(8)通过对同一份样品的多次测定,得到样品的单杂与总杂数量都维持一定水平,则说明该方法重复性良好。
(9)通过样品测定,表明各批样品有关物质和含量检测合格,且符合要求。
综上所述,证明拟定的色谱条件,简单、耐用、可靠。
[1] Thiery-Vuillemin Antoine , Poulsen Mads Hvid , Lagneau Edouard, et al. Impact of abiraterone acetate plus prednisone or enzalutamide on patient-reported outcomes in patients with metastatic castration-resistant prostate cancer: final 12 - mo analysis from the observational AQUARiUS Study[J]. Pubmed,2020,77(3):380-387.
[2] 刘玲,官倩倩,李宁等.醋酸阿比特龙原料药粒度分析方法研究[J].中国药业,2020,29(5):120-122.
[3] 袁小明,江德福,刘伟锋,等.阿比特龙工艺杂质研究[J].浙江化工,2020,51(2):7-10.
[4] 解晓冬,张辉,游蓉丽,等.醋酸阿比特龙合成路线图解[J].江西化工,2019(6):61-63.
[5] 袁小明,江德福,刘伟锋,等.醋酸阿比特龙二聚体杂质合成研究[J].浙江化工,2019,50(12):6-9.
[6] Samuel Mach, Alexandr Jegorov, Marek Kuzma, J , et al. Epoxidation is the preferred pathway of first-stage metabolism of abiraterone acetate in brown bullhead (Ameiurus nebulosus)[J]. Springer Berlin Heidelberg, 2019, 26(20): 34896-34904.
[7] Kimata Ryoji, Tomita Yuji, Kondo Yukihiro. Safety of abiraterone acetate administration in elderly patients receiving peritoneal dialysis with castration-resistant prostate cancer: two case reports [J]. Pubmed, 2019, 86(2): 135-138.
[8] M.C. Goena Vives, I. Rilo, R. Garcia, et al. Safety of abiraterone and enzalutamide in prostate cancer patients treated with anticoagulants[J]. Elsevier B.V., 2019, 18(11): 37-45.
[9] Dittadi Ruggero, Polesello Vania, Zivi Andrea, et al. Evaluation of the possible interference of abiraterone therapy on testosterone immunoassay [J]. Pubmed, 2019, 57(10): 253-254.
[10] Ami Schattner, Ina Dubin, Ami I Y. Drahy. Abiraterone and aortic dissection [J]. American Journal of Therapeutics, 2019, 26(26): 624-625.
[11] Shivji Alisha, Ali Raafi, North Scott ,et al. Real world evidence: Abiraterone use post-docetaxel in metastatic castrate-resistant prostate cancer [J]. Pubmed, 2019, 25(6): 1293-1300.
[12] Zhao Jinge, Zhang Mengni, Liu Jiandong, et al. AKR1C3 expression in primary lesion rebiopsy at the time of metastatic castration-resistant prostate cancer is strongly associated with poor efficacy of abiraterone as a first-line therapy [J]. Pubmed, 2019, 79(13): 1553-1562.
[13] 褚定军,张毅,谢晓强. 醋酸阿比特龙合成工艺改进[J].浙江化工, 2019, 50(8): 5-7.
[14] Masamrekh Rami A, Kuzikov Alexey V, Haurychenka Yaraslau I, et al. In vitro interactions of abiraterone, erythromycin, and CYP3A4: implications for drug-drug interactions [J]. Pubmed, 2019, 34(1):120-130.
[15] Almendros S,Berenguer-Francés M A, Ferrer-González F, et al. Predictive factors for abiraterone withdrawal syndrome[J]. Elsevier Doyma,2019,43(6):300-304.
[16] Romero-Laorden N, Lozano R, Jayaram A. Phase II pilot study of the prednisone to dexamethasone switch in metastatic castration-resistant prostate cancer (mCRPC) patients with limited progression on abiraterone plus prednisone (SWITCH study)[J]. Br J Cancer, 2018,119: 1052-1059.
[17] Umang Swami, Sumanta K. Pal, Neeraj Agarwal. Ideal glucocorticoid regimen with abiraterone acetate: options and Challenges [J]. American Medical Association, 2019, 5(8):1167-1169.
[18] 丁亚明.阿比特龙醋酸酯的研究进展[J].化学工程与装备, 2016 (5):226-227.
DETERMINATION OF ABITRON ACETATE AND ITS RELATED SUBSTANCES BY HPLC
DU Chao1,2, LUO Zhou2, ZHUO Qiu-qi2, TANG Yun1,*LI Wei1
(1. School of Chemistry and Biological Engineering, Yichun College, Yichun, Jiangxi 336000, China;2. Shenzhen Wanle Pharmaceutical Co. Ltd., Shenzhen, Guangdong 518029, China)
A method for determination of the content and related substances of abiraterone acetate by HPLC was established to provide a reference for the comprehensive evaluation and control of the quality of abiraterone acetate. The column was Eclipse plus C18 (5 μm, 4.6×250 mm), the mobile phase A and B were acetonitrile solution (containing 2% isopropanol) and 0.01 mol/L ammonium acetate solution, respectively, the flow rate was 1.0 mL/min, and the wavelength was 254 nm, gradient elution was applied. The results showed that it had a good linear relationship in the range of 0.3033~1.0111 mg/mL, the average recovery rate was 99.41% (RSD=1.10%), and it could be separated from related substances well. The stability of the solution was good within 16 h, RSD=0.33%; the limit of quantification and detection were 0.97 ng and 0.291 ng, respectively. The method is simple, convenient, accurate and highly sensitive, and is suitable for the determination of abiraterone acetate content and related substances.
abiraterone acetate; HPLC; content determination; related substances
O657.7
A
10.3669/j.issn.1674-8085.2021.03.006
1674-8085(2021)03-0025-06
2020-12-20;
2021-02-08
江西省教育厅科技计划项目(GJJ190856);膀胱癌靶向药物及新型制剂产业化开发项目(20180309162621813)
杜 超(1993-),男,山东郯城人,硕士生,主要从事新药化学工艺研究与开发(E-mail:1246901670@qq.com);
罗 舟(1986-),女,广州深圳人,工程师,主要从事新药化学工艺研究与开发(E-mail:luozhou6835@163.com);
卓秋琪(1982-),女,广州深圳人,高级工程师,主要从事新药化学工艺研究与开发(E-mail:243643597@qq.com);
唐 云(1986-),女,江西吉安人,讲师,博士,主要从事新药化学工艺研究与开发(E-mail:tangyun-2008-happy@163.com);
*李 伟(1985-),男,江西吉安人,副教授,博士,硕士生导师,主要从事新药化学工艺研究与开发(E-mail:nobel2025@163.com).

