猪肉中呋喃妥因代谢物残留液相色谱检测方法的建立
胡洁芳
(江西工业贸易职业技术学院,南昌 330038)
在众多饲料安全问题中,兽药残留一直是影响饲料安全的最主要因素之一。兽药在促进动物生长、预防和治疗动物疾病、控制动物繁殖等方面起着重要作用。由于我国在兽药的使用和管理上存在很多问题,致使动物性产品中兽药残留超标事件屡屡发生,严重影响了人们的身体健康和我国动物性产品的出口贸易。目前对人畜危害较大的兽药主要包括抗生素类、磺胺类、硝基呋喃类、抗寄生虫类及激素类等药物。其中硝基呋喃类药物因具有杀菌能力强、抗菌谱广、不易产生耐药性、价格低廉、疗效好等优点,曾经在畜禽水产养殖业中广泛应用[1-3]。
呋喃妥因是硝基呋喃类兽药的一种,杀菌能力强、抗菌谱广、不易产生耐药性、价格低廉、疗效好,在临床上得到了广泛应用,主要用于鸡白痢、鸡大肠杆菌病、鸡球虫病等各种肠道感染性疾病的治疗及用作猪、禽类和水产促生长的添加剂。有关研究证明,大剂量或长时间使用呋喃它酮原药能对养殖动物有毒性作用,表现为厌食、腹泻、胃肠出血、周围神经炎、兴奋、惊厥、瘫痪等,严重还会导致死亡。呋喃妥因及其代谢物AHD还能够诱导有机体基因突变及致畸胎且能够诱发癌症[4-5]。
目前关于呋喃妥因及其代谢物AHD残留监测常用的方法主要有高效液相色谱法(HPLC)[6]、液相-串联质谱法(LC-MS/MS)[7]和免疫分析方法[8]。本研究采用高效液相色谱法对猪肉中呋喃妥因代谢物AHD残留进行检测,并对色谱条件和样品前处理条件进行优选,在最优的色谱条件和样品前处理条件基础上建立猪肉中AHD残留的高效液相色谱检测方法并对建立的方法进行一系列的方法学评价,为动物性食品中呋喃妥因原药和代谢物AHD残留监控提供理论基础,具有很好的应用前景。
1 试验材料和仪器
1.1 试验材料
猪肉,购买于农贸市场;邻硝基苯甲醛,氢氧化钠,三水合磷酸氢二钾,吐温-20,二甲基亚砜,冰乙酸,盐酸等均为分析纯;无水甲醇,乙腈为色谱纯(天津市永大化学试剂开发中心);AHD标准品和NPAHD标准品(美国Sigma公司)。
1.2 主要仪器
Waters2487高效液相色谱仪(美国Waters公司),TDL-5-A低速大容量离心机(上海安亭科学仪器厂),RE-52AA旋转蒸发器(上海亚荣有限公司生化仪器厂),pHS-3C pH计(上海雷磁仪器厂)等。
2 试验方法
2.1 试剂配制
①PBS:0.05g磷酸二氢钾,0.725g十二水磷酸氢二钠,2g氯化钠,0.05g氯化钾溶于250mL容量瓶中。
②PBST:取50mLPBS和25μL吐温-20混合于小烧杯中,并用保鲜膜封口。
③2mg/mL呋喃妥因母液:准确称取呋喃妥因标准品,并用二甲亚砜作为溶剂配成2mg/mL浓度的母液。
2.2 样品处理
取1.0g均质样品于50mL离心管中,加入4mL蒸馏水,0.5mL 1mol/mL盐酸和400μL 10 mmol/L 2-硝基苯甲醛,充分振荡30 s,然后用锡箔纸进行包裹,置于37℃水浴中恒温振荡16h,取出冷却后加入5mL 0.1mol/mL磷酸氢二钾,用1mol/L的氢氧化钠调节至合适的pH,再加5mL乙酸乙酯,涡旋振荡30 s,于4500g离心10min,取出乙酸乙酯层于旋转蒸发瓶蒸发至干,用3mL正己烷溶解干燥物,加1mL 0.01mol/mL PBST适当的混合,在室温下4500 g离心10 min,下层液体用0.45μm滤头过滤后进行高效液相色谱检测。
2.3 参考色谱条件
本实验参考了GB/T 20752-2006猪肉、牛肉、鸡肉、猪肝和水产品中硝基呋喃类代谢物残留量的测定的色谱条件[9],其色谱条件如下:色谱柱:Atlantis-C18,3.5μm,150mm×2.1mm; 柱 温:35℃;进样量:40μL;梯度洗脱程序(见表1):
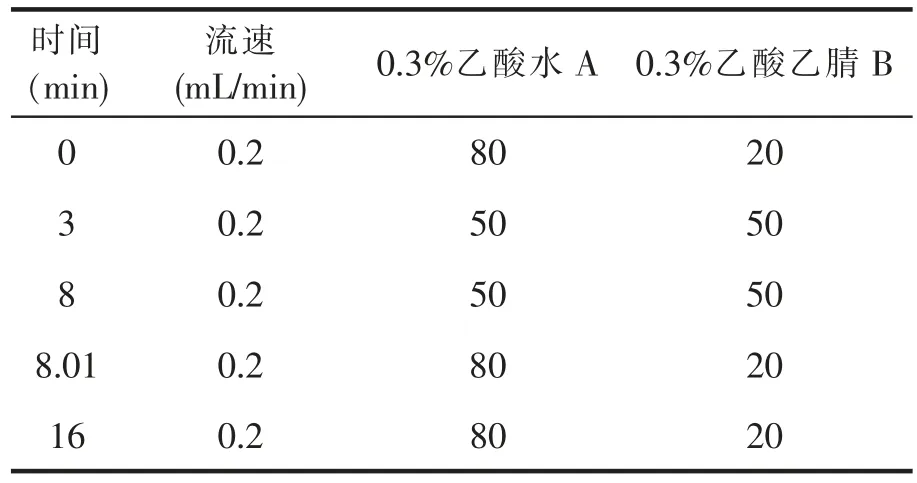
表1 国标色谱梯度洗脱程序
2.3.1 色谱条件的优化
由于本实验使用的色谱柱同参考的国标方法所用的色谱柱型号不同,为Symmerry-C18(5μm,4.6×250mm),在预实验中发现参考的国标的色谱条件对此色谱柱不合适,需要对柱温,流速,流动相等色谱条件进行优化,从而得到在此色谱柱条件下测定呋喃妥因代谢物AHD残留的最佳色谱测定条件。
2.3.2 柱温
本实验选择20℃,25℃,30℃,35℃,40℃五个柱温对同一个样品进行高效液相色谱测定,考察不同柱温对样品峰分离效果的影响,从而选出最优柱温进行后续实验[9-10]。
2.3.3 流速
流速对高效液相色谱测定样品出峰时间和分离效果会有一定的影响,本实验中选择0.2mL/min,0.4mL/min,0.5mL/min,0.6mL/min,0.8mL/min五个流速对同一个样品进行高效液相测定,探究不同流速对NPAHD峰分离效果的影响,从而选出最优流速进行后续实验[9-12]。
2.3.4 流动相pH
由于流动相的酸度对NPAHD峰分离效果有一定的影响,参考国标中0.3%乙酸水的酸度比较大(pH约为3),考虑到流动相酸度过高对色谱柱和液相色谱仪有较大腐蚀作用,为保护所使用的色谱柱和仪器,希望在更低的酸度条件下进行实验也能得到较好的分离效果,所以本实验选择pH=3.0,pH=4.0,pH=5.0三个流动相酸度来进行液相色谱测定,探究流动相不同酸度对NPAHD分离效果的影响,从而找出最优流动相pH。
2.4 样品预处理条件的优化
2.4.1 甲醇水处理对NPAHD提取影响
彭涛等人[10]发现样品在酸解之前加入甲醇水处理样品能够有效的去除样品中的杂质,有利于后续NPAHD的提取,但大部分文献都没有做这一步处理,所以本实验设置了酸解前加甲醇水处理和不加甲醇水处理两组实验,考察酸解前加甲醇水处理对NPAHD提取效果的影响。
2.4.2 衍生液PH对乙酸乙酯提取NPAHD的影响
样品衍生16h后衍生液pH对乙酸乙酯提取NPAHD有一定的影响,本实验选择了pH=6.0,pH=6.5,pH=7.0,pH=7.5四个衍生液酸度梯度,考察衍生液不同pH对后续乙酸乙酯提取NPAHD的影响,每个pH做两个平行样,从而选出最优衍生液pH来进行后续添加回收的实验测定。
2.5 NPAHD标准曲线的建立
取2mg/mL NPAHD标准储备液,用PBS稀释至1μg/mL、0.5μg/mL、0.2μg/mL、0.1μg/mL、0.05 μg/mL等浓度,按前述优选好的色谱条件进样液相色谱测定,每个浓度做两个平行测定,以浓度作为横坐标,峰面积作为纵坐标绘制标准曲线,计算线性回归方程和相关系数。
2.6 精密度试验
用3个不同浓度的标准NPAHD溶液在前述优选好的色谱条件下,连续进样5次,对得到的峰面积进行差异分析,计算标准差(SD)和变异系数(CV),确定方法的精密度。得到的变异系数越小,方法的精密度越高。按下面公式计算标准差和变异系数:

式中:X为n次重复测定的算术平均值;Xi为n次测定中的一次;n为重复测定的次数。
2.7 添加回收率试验
称取均质好的1g猪肉样品,分别加入1mL配 制 好 的0.2μg/mL,0.5μg/mL,1μg/mL,2μg/mL的AHD标准品,加入4mL蒸馏水,0.5mL 1mol/mL盐酸和400μL 10mmol/mL 2-硝基苯甲醛,充分振荡30 s,置于37℃水浴中恒温振荡16h,取出冷却后加入5mL 0.1mol/mL磷酸氢二钾,用1mol/mL氢氧化钠溶液调到最适pH,5mL乙酸乙酯,涡旋振荡30 s,于4500g离心10min,取出乙酸乙酯层于旋转蒸发瓶蒸发至干,用3mL正己烷溶解干燥物,加1mL 0.01mol/mL PBST适当的混合,在室温下4500g离心10min,下层液体用0.45μm滤头过滤后进行高效液相色谱检测。每个样本做2个平行实验,根据NPAHD检测结果得到AHD回收检出量,计算方法的添加回收率。
3 结果与分析
3.1 色谱条件的优选
3.1.1 柱温的选择(见图1)
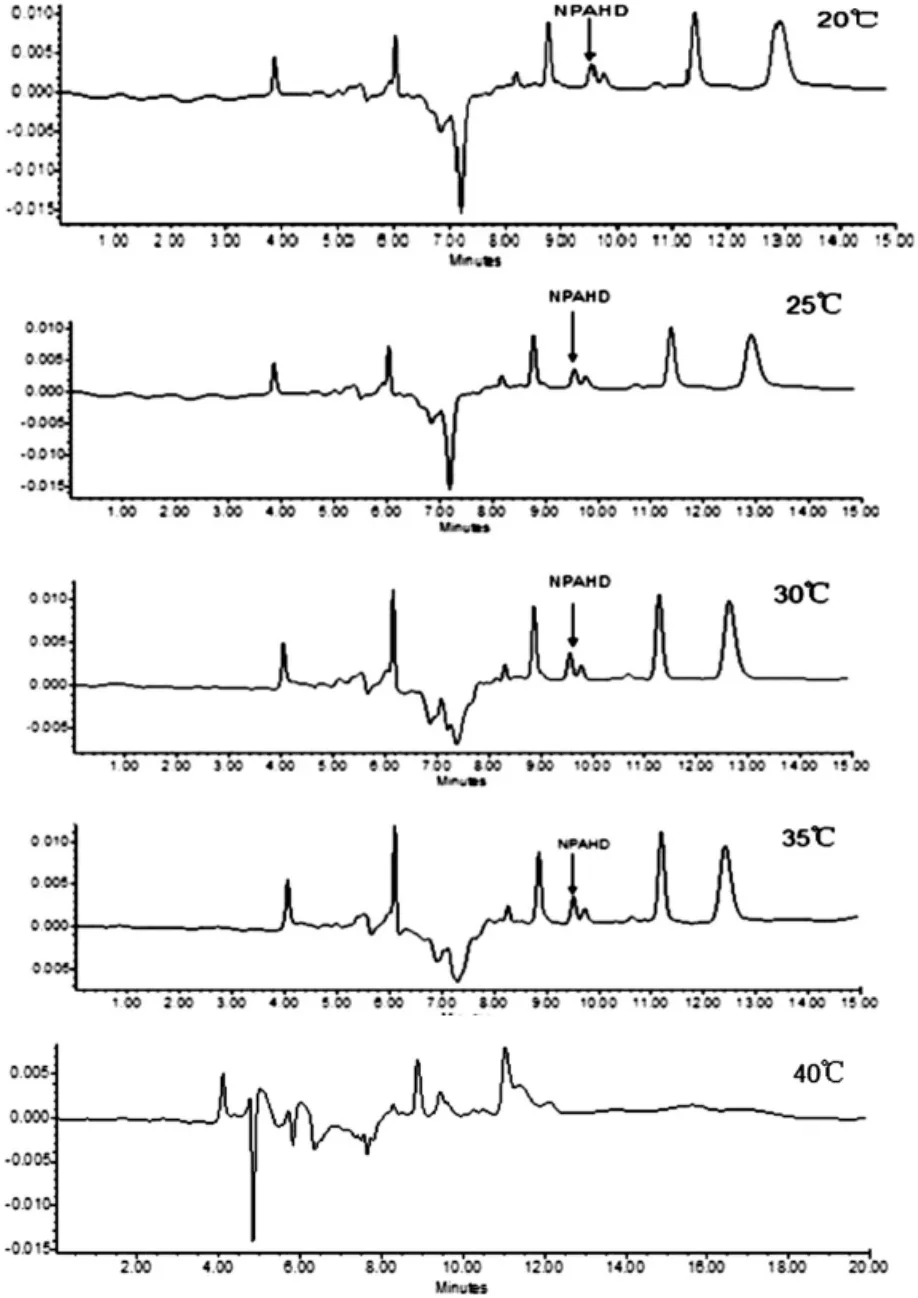
图1 不同柱温对NPAHD分离效果的影响
本实验设置了40℃,35℃,30℃,25℃,20℃五个柱温进行高效液相色谱测定,结果如图1所示。从图1可知柱温为40℃时峰型和分离效果都不是很好,而35℃,30℃,25℃,20℃时的柱温图形都差不多,但NPAHD都没有完全拉开,因为柱温较高时影响色谱柱的寿命,所以最终选择30℃作为色谱柱温的条件,通过改变其他色谱条件来使NPAHD达到分离。
3.1.2 流速的选择(见图2)
流速对于出峰时间和色谱峰分离效果影响较 大,本 实 验 设 置 了0.2mL/min、0.4mL/min、0.5 mL/min、0.6mL/min、0.8mL/min5个流速梯度进行实验,结果如图2所示。从图2可以看出流速越慢,出峰时间也越慢,流速加大,出峰时间缩短,当流速在0.2和0.4mL/min时NPAHD峰没有分开,流速在0.5mL/min时峰型和分离效果最好,流速在0.8mL/min时NPAHD峰虽然也分开了,但峰形不好且在0.8mL/min流速时柱压偏大,综合考虑以上因素,选择了0.5mL/min作为最佳流速进行后续实验。
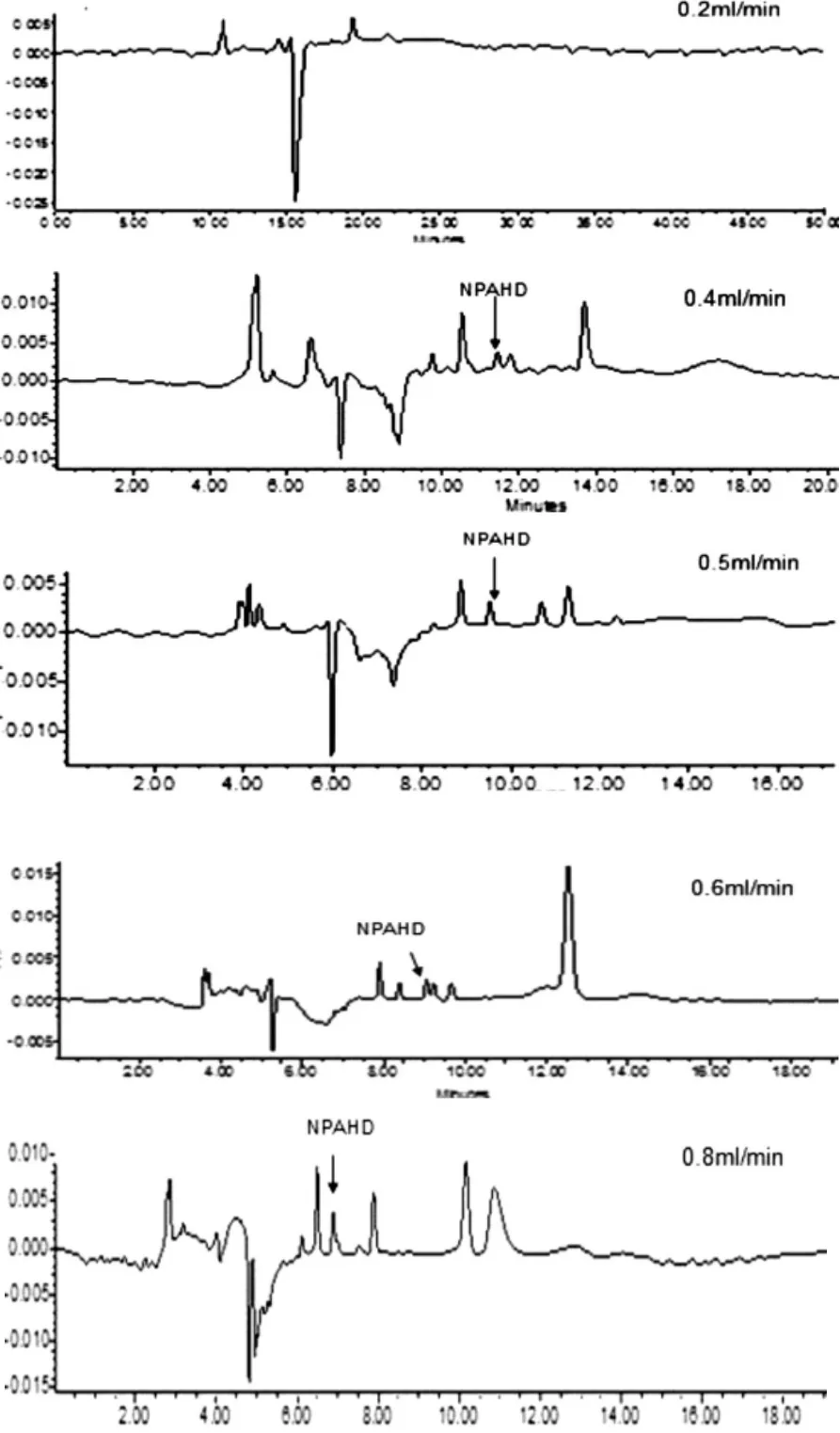
图2 不同流速对NPAHD分离效果的影响
3.1.3 流动相乙酸水pH的选择(见图3)
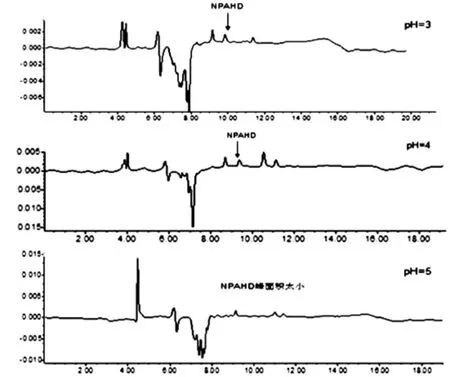
图3 不同流动相pH对NPAHD分离效果的影响
根据参考文献,其所用的乙酸水流动相pH在3左右,本实验考虑到高酸性的流动相对实验仪器和色谱柱有一定的腐蚀作用,且用参考流动相做预实验时发现分离效果也不好,所以设置了pH=3,pH=4,pH=5的三个酸度梯度,结果如图3所示。由图3可知,pH=5时,NPAHD峰完全没有和其它峰分开,pH=3和pH=4时,峰型和分离效果都较好,因为考虑到流动相低酸度时有利于保护色谱仪和色谱柱,所以本实验选择了乙酸水pH=4作为最佳流动相pH。
3.2 样品前处理条件的优选
3.2.1 甲醇水处理对NPAHD提取效果的影响(见图4)
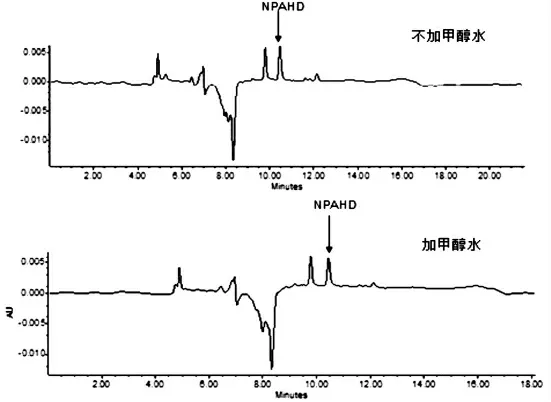
图4 样品加酸水解前加甲醇水对NPAHD提取分离效果的影响
从彭涛等人[10]实验中了解到,样品在酸解前加入甲醇水,并离心去除上清液,能够除去样品中的一些杂质,让结果更加准确,但根据本试验图4结果可知加入甲醇水后的色谱图与没加甲醇水的色谱图型基本一样,NPAHD峰面积差别不大,没有什么效果,所以为了简化实验步骤,我们选择不加甲醇水处理样品,而是直接进行酸解并离心,然后进行后续实验。
3.2.2 衍生液pH的选择(见图5)
样品经过酸解衍生16h后用磷酸二氢钾和氢氧化钠对样品pH进行调节,衍生液不同pH对后续NPAHD的提取有一定的影响,所以本实验设置了4个pH梯度6.0,6.5,7.0,7.5来进行优选,结果如图5所示。从图5结果发现pH在7.0时的峰面积、峰型和分离效果较其他pH更好,所以本实验选择了将衍生液pH调至7.0时做为最优衍生液pH进行后续实验。
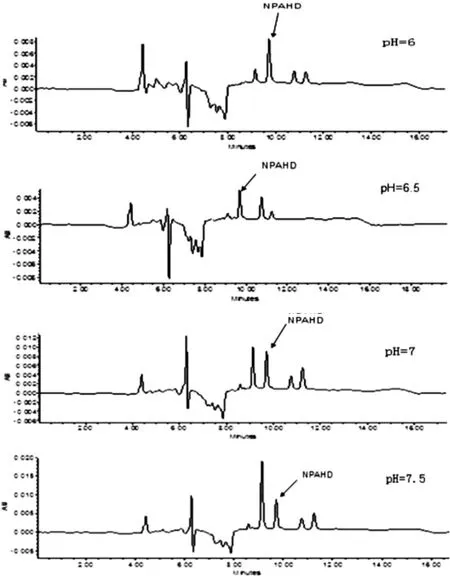
图5 衍生液不同pH对乙酸乙酯提取NPAHD效果的影响
3.3 NPAHD标准曲线(见图6)
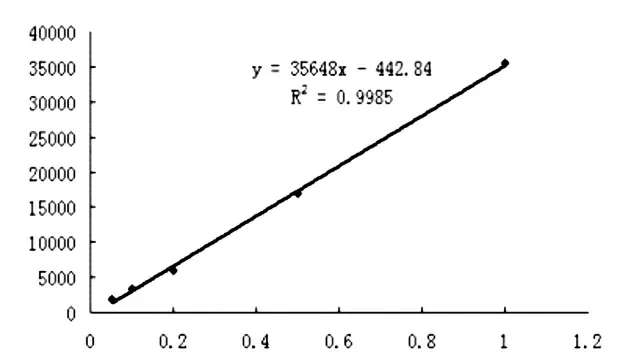
图6 NPAHD标准曲线
以NPAHD浓度为横坐标,峰面积为纵坐标绘制的标准曲线,得到的标准曲线见图6,线性回归方程为y=35648x-442.84,相关系数R2=0.9985。
3.4 精密度试验(见表2)
由表2知,本实验的变异系数均小于6%,说明本实验建立的高效液相色谱法精密度较好。
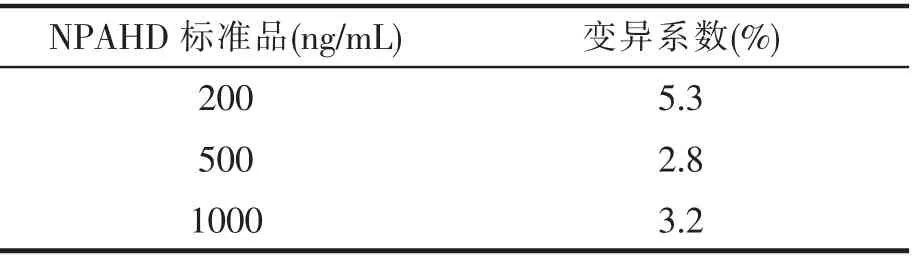
表2 高效液相色谱法的精密度
3.5 添加回收试验
采用本实验建立的高效液相色谱法进行猪肉样品添加AHD标样的添加回收实验,计算4个浓度加标样品中的标准偏差(CV)和本方法的添加回收率,对本实验建立的高效液相色谱法检测实际样品的能力进行评价。从表3可知,高效液相色谱法的加标回收率范围为81%~95%,符合方法建立的加标回收率要求。
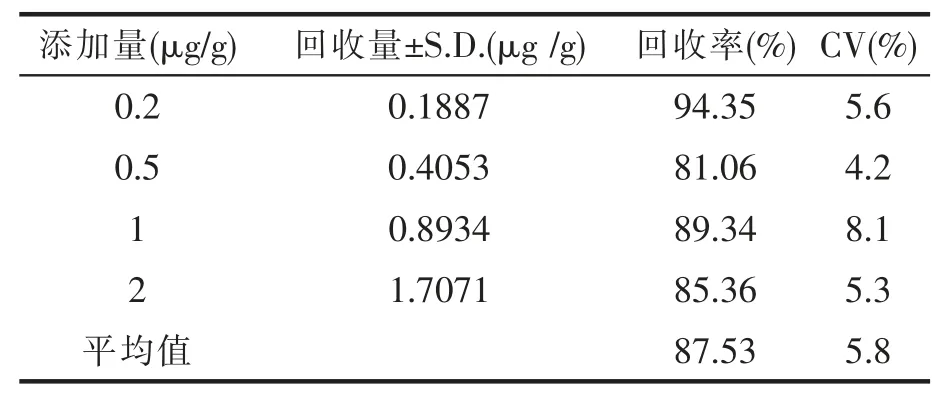
表3 高效液相色谱法对猪肉中AHD添加回收率(n=2)
4 讨论
本实验使用的色谱柱和国标GB/T 20752-2006所用的色谱柱的型号不同,在预实验中发现参考的国标的色谱条件对此色谱柱不合适,需要对柱温,流速,流动相等色谱条件重新进行优化,使得NPAHD能得到良好分离,从而得到在此色谱柱条件下测定呋喃妥因代谢物的衍生物NPAHD残留的最佳色谱测定条件。从色谱条件优选实验结果可知,色谱柱温在40℃时峰型和分离效果最差,其它温度条件下效果相差不大,也没有完全分开,流速过高或过低都影响了NPAHD出峰效果,流速在0.5mL/min时峰型和分离效果最好,流动相乙酸水的pH不同对结果也产生了较大的影响,在其pH=4时,效果最好。所以本实验选择了柱温30℃,流速0.5mL/min,pH=4的乙酸水-乙腈流动相作为最佳色谱条件。
在上述优选确定了的色谱条件下再对样品前处理的一些条件进行优选。由于样品酸解前甲醇水处理和样品酸解衍生16h后的衍生液pH对NPAHD提取有一定影响,所以本实验针对这两个前处理条件进行优选。结果发现样品经甲醇水处理后,NPAHD的提取效果并没有得到提高,而衍生液pH为7的样品经高效液相检测出的NPAHD的峰型、分离效果和峰面积最好。所以我们将甲醇水处理这一操作步骤去除,简化实验,并且将衍生液pH调至7作为样品前处理的优选。
然后在最佳的前处理和最佳的色谱条件下对精密度和添加回收率进行测定,通过精密度和添加回收率的数据来评价本实验建立的NPAHD高效液相色谱测定方法。精密度实验变异系数均小于6%,添加回收实验回收率范围为81%~95%,可知精密度和添加回收率实验结果都符合要求,说明建立的高效液相色谱法可以用于猪肉中呋喃妥因代谢物AHD残留的检测。
从本试验我们得到的经验是在借鉴相关文献和方法时切忌盲目搬抄,应该具体问题具体分析。本实验因为色谱柱型号和参考文献不一致,所以需要对所用的色谱条件和前处理条件重新进行优选,得出最适合自己的色谱条件和前处理条件来建立合理可靠的高效液相色谱检测方法。
5 结论
(1)本试验优化的色谱条件为柱温30℃,流速0.5mL/min,流动相为pH=4.0的乙酸水溶液(A)和乙腈(B),梯度洗脱时间、乙酸水溶液和乙腈配比参考国标(见表1),提高了测定结果的准确度。
(2)本试验优化的前处理条件为加酸酸解衍生前不加甲醇水,乙酸乙酯提取前调衍生液pH=7.0,提高了前处理的效率。
(3)在优化的色谱条件和预处理条件下建立测定NPAHD的标准曲线,计算得到其线性回归方程为y=35648x-442.84,相关系数R2=0.9985;本试验建立的高效液相色谱法精密度实验的平均相对标准偏差均小于6%;高效液相色谱法添加回收率范围为81%~95%,说明建立的高效液相色谱法可用于猪肉中呋喃妥因代谢物AHD残留的检测。

