基于UPLC-Q-Orbitrap-MS整合网络药理学研究藏药大三果化学成分及作用机制*
张秋楠,常子豪,叶 婷,梁林金,梁文仪,张兰珍
(北京中医药大学中药学院 北京100102)
藏药大三果(Triphala)由诃子Terminalia ChebulaRetz.,毛诃子Terminalia Billerica(Gaertn.)Roxb.与余甘子Phyllanthus emblicaL.的成熟果实按比例组成,以它们为主药配伍为三果汤散,三果汤等剂型,简称大三果[1-2]。1995年版藏药部颁标准将其收载,具有清热、调和气血、化解坏血的功效[3],临床上多用于治疗咽喉肿痛、咳嗽哮喘、消化不良、贫血、肝功能障碍和心血管疾病等,为藏药众多方剂的基础方[4]。近年来国内外学者对大三果及其单味药余甘子、诃子、毛诃子进行了化学成分、药理作用和临床应用方面的研究,结果表明大三果富含鞣质、酚酸、皂苷、脂质、萜类化合物、黄酮类、谷甾醇、强心苷和各种碳水化合物[5],在抗疲劳、抗氧化、抗肿瘤、抗菌、抗炎等方面均表现出一定的治疗和预防保健作用[6-9],但对其成分、靶点、疾病、通路之间的相互联系还未见报道。因此,本研究在鉴定大三果化学成分的基础上,首次对其进行系统药理学的机制作用研究,为该药的临床合理用药、质量控制以及新药研发提供科学依据和有力保障[10]。
本研究采用超高效液相色谱-四极杆-静电场轨道阱高分辨质谱联用技术(UHPLC-Q-Orbitrap-MS)对大三果醇提取中主要化学成分进行鉴定与表征分析。同时,利用生物信息学等方法构建和分析多元生物网络,以网络靶点为切入点进一步探讨其主要作用机制,为该药的临床合理用药、质量控制提供依据[10]。
1 材料
1.1 仪器与软件
UPLC-Q-Orbitrap液质联用系统:Ultimate 3000型超高效液相色谱仪(Dionex公司)串联Thermo Q Exactive型高分辨质谱(Thermo FisherScientific公司);Xcalibar 3.0工作站(Thermo Fisher Scientific公司);Compound Discovery 3.0化合物分析鉴定软件(Thermo Fisher Scientific公司;https://www.thermofisher.com/);电子天平(北京赛多利斯仪器系统有限公司);KQ 5200E型超声清洗器(昆山市超声仪器有限公司);Cytoscape 3.7.2软 件(Cytoscape Consortium;https://cytoscape.org/);R语言4.0.2程序包(The R Foundation;https://www.r-project.org/);Chembiodraw Ultra 14.0软件(PerkinElmer公司;https://www.chemdraw.com.cn/)等。
1.2 试剂
没食子酸(批号MUST-17022801)、柯里拉京(批号MUST-17052603)、鞣花酸(批号MUST-17052603),以上对照品纯度≥98%,均购于成都曼斯特生物科技有限公司;没食子酸甲酯(批号TN1127CA14,纯度≥98%),购于上海源叶生物科技有限公司;色谱级甲醇和乙酸购于Fisher公司;纯净水购于杭州娃哈哈集团有限公司。
余甘子、诃子和毛诃子药材均购于北京藏医院(产地尼泊尔),经北京中医药大学中药鉴定系刘春生教授鉴定,分别为大戟科植物余甘子Phyllanthus emblicaL.、使君子科植物诃子Terminalia chebulaRetz.及毛诃子Terminalia bellirica(Gaertn.)Rox.的干燥成熟果实。
2 方法
2.1 色谱和质谱条件
2.1.1 色谱条件
色谱柱:ACQUITY UPLC HSS T3 1.8 μm(2.1×100 mm,Column;Part No:186003539;Serial No:0246325825758);保护柱:ACQUITY HSS T3 1.8 μm VANGUARD Pre-Col(Part No:186003976;Serial No:0210382710);柱温:30℃;流动相:0.1%乙酸(A)-甲醇(B);流速:0.3 mL·min-1;波长:260 nm、270 nm;流动相梯度如下:0-2 min,3% B;2-10 min,3-13% B;10-15 min,13-25% B;15-22 min,25-30% B;22-32 min,30-60%B;32-45 min,60-95%B;45-55 min,95%B。
2.1.2 质谱条件
ESI:负离子模式;雾化气流:1.5 L·min-1;离子源温度:320℃;干燥气压力:100 kPa;质量扫描范围:m/z100-1500。毛细管温度为350℃;鞘气(氮)流量为30 arb;辅助气体(氮气)流量为10 arb;源电压为4.0 kV;毛细管电压为-35 V;管透镜电压为-110 V。轨道阱质量分析仪的分辨率设定为30000。隔离宽度为2 amu,归一化碰撞能量(CE)设定为35%。碰撞诱导解离(CID)在LTQ中进行,活化q为0.25,活化时间为30 ms。
2.2 大三果醇提物供试品和对照品溶液制备
精密称取余甘子、诃子以及毛诃子药材粉末(过50目筛)各100 mg置于100 mL锥形瓶中,加入50%甲醇60 mL,称重,100 MHz超声60 min,补足原重量,过0.22 μm微孔滤膜过滤,取上清液,即得供试品溶液。
分别精密称取没食子酸、柯里拉京和没食子酸甲酯对照品2.5 mg置于容量瓶中,用甲醇溶解后定容配制成0.5 mg·mL-1的对照品溶液。称取鞣花酸标准品2.5 mg于5 mL容量瓶中,加入少量DMSO溶解后甲醇定容,配制成0.5 mg·mL-1的鞣花酸对照品溶液。分别取1 mL各对照品溶液,配制成的0.125 mg·mL-1混合对照品溶液,混匀,过0.22 μm微孔滤膜过滤,取上清液,即得混合对照品溶液。
2.3 化合物鉴定解析
进样后,根据高分辨质谱提供的准分子离子等信息推测并得到一级质谱的精确相对分子质量,经Xcalibar 3.0软件进行峰提取、峰匹配等处理并与Compound Discovery 3.0软件匹配,依据对照品、参考文献、Mass Bank数据库(https://massbank.eu/MassBank/)提供的相对保留时间及碎片离子信息进一步确认定性化学成分[11]。
2.4 活性成分筛选
采用中药系统药理数据库(TCMSP)[12](http://lsp.nwu.edu.cn/index.php)分析平台,检索液质鉴定出的化合物。以口服生物利用度(oral bioavailability,OB)≥30%,化合物类药性(drug-like,DL)≥0.18为指标,筛选得到大三果中的活性成分[13]。
2.5 活性成分-靶点网络构建
运用TCMSP数据库(http://lsp.nwu.edu.cn/index.php)和Swiss Target Prediction平 台(http://www.swisstargetprediction.ch/)搜索活性成分靶点,采用UniProt[14]数据库(http://www.uniprot.org/)进行标准化,建立化合物靶点数据库。再将化合物及相应基因导入Cytoscape软件[15],构建活性成分-疾病靶点网络图(Component-Target network,C-T network)。
2.6 蛋白相互作用(PPI)网络构建
将筛选出的潜在靶点全部导入STRING网络平台(https://string-db.org/),设置蛋白种类为“Homo sapiens”,最低相互作用阈值设为高等置信度0.9“high confidence”,隐藏没有相互作用的蛋白,进行蛋白相互作用分析[16]。采用Cytoscape软件进行可视化分析,采用CytoHubba插件采取最大集团中心性(Maximal clique centrality,MCC)的拓扑算法筛选核心基因(hub gene)。
2.7 GO功能富集分析与KEGG信号通路富集分析
采用人类基因组注释数据库DAVID6.8[17](http://david.ncifcrf.gov/)对大三果醇提取的全部潜在靶点进行京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)信号通路富集分析和基因本体论(Gene ontology,GO)功能富集分析,以P<0.01进行筛选,研究药物靶点主要信号通路。
3 结果与分析
3.1 大三果醇提物化学成分分析
因大三果成分主要为酚酸和鞣质类化合物,提取液呈酸性,因此选用负离子模式进行分析,得到总离子流图,综合表征出了85个化合物,包括酚酸类、简单没食子酰酯类、鞣质类(分为没食子鞣质、逆没食子鞣质)、脂肪酸类、黄酮类、萜类及其他,结果见表1。
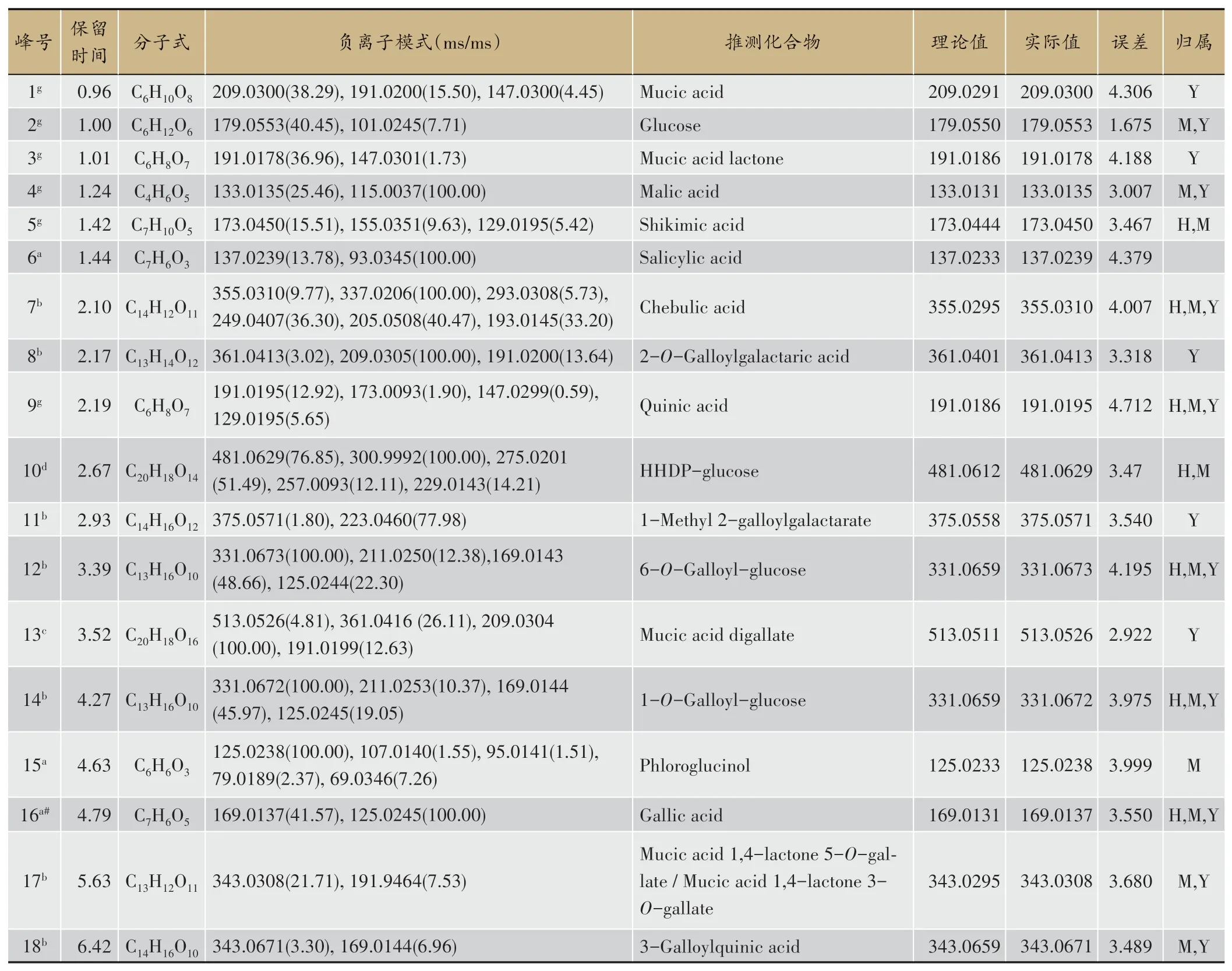
表1 大三果醇提取中化学成分UPLC-Q-Orbitrap-MS鉴定

续表
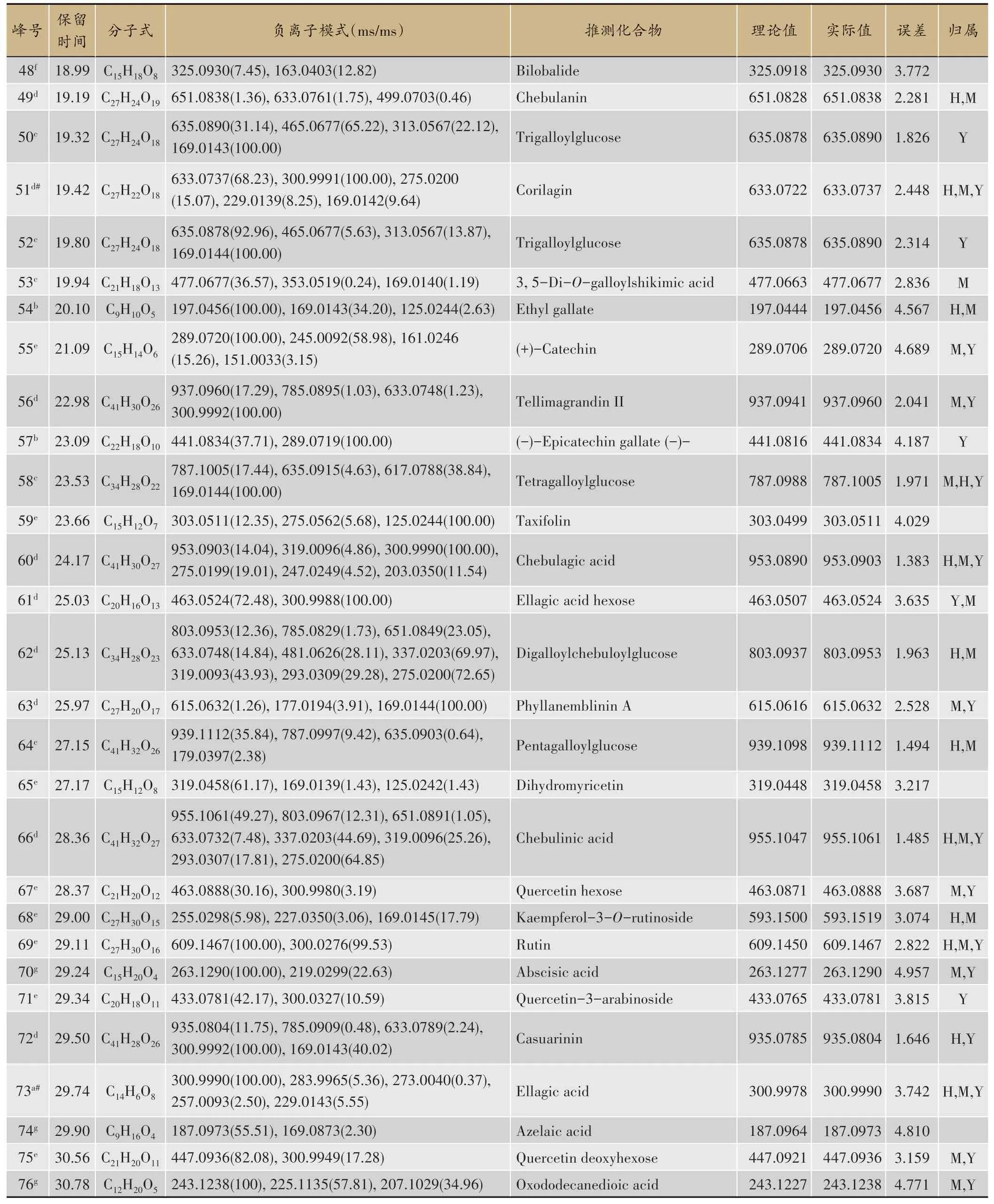
续表

续表
此类化合物共鉴定出8个,含有较多的酚羟基和羧基,在裂解时易失去H2O、CO、CO2及CH2等基团[18]。Ellagic acid(化合物73,鞣花酸)的保留时间是29.74 min,分子离子峰为m/z300.999 0[M-H]-,经碰撞解离,失去一个中性碎片CO(28 u)产生碎片m/z273.004 0[M-H-CO]-,再失去一个CO(28 u)产生碎片m/z245.009 1[M-H-2CO]-;失去一个中性碎片CO(244 u)产生碎片m/z257.009 3[M-H-CO2]-,再失去一个CO(28 u)产生碎片m/z229.014 3[M-H-CO2-CO]-;失去一个中性碎片H2O(18 u)产生碎片离子m/z283.996 5[M-H-H2O]-,推测分子式为C14H6O8[19]。
3.1.2 简单没食子酰酯类化合物分析
此类化合物共鉴定出16个,主要含有没食子酰基,在裂解时易失去没食子酰基(galloyl,152 u)而产生特征碎片。Ethyl gallate(化合物54,没食子酸乙酯)的保留时间是20.10 min,分子离子峰为m/z197.045 6[M-H]-,经碰撞解离,失去一个2CH2(48 u)产生碎片m/z169.014 3[M-H-2CH2]-,再失去一个CO2(44 u)产生碎片m/z125.024 4[M-H-C2H4-CO2]-,推测分子式为C9H10O5[20]。
3.1.3 没食子鞣质类化合物分析
此类化合物共鉴定出5个,水解后能生成没食子酸和糖或多元醇,多为一取代或多取代的没食子糖苷,因取代的位置不同具有多个同分异构体,在裂解时易失去一系列没食子酰基(galloyl,152 u)。Tetra⁃galloylglucose(化合物58)的保留时间是23.53 min,分子离子峰为m/z787.100 5[M-H]-,经碰撞解离,可接连丢失没食子酰基galloyl(152 u)产生碎片m/z635.091 5[M-H-galloyl]-和碎片m/z331.056 9[MH-3galloyl]-;丢失一个没食子酸(170 u)产生碎片m/z617.078 8[M-H-gallic]-,再丢失一个没食子酸(170 u)产生碎片m/z447.057 3[M-H-2gallic]-,再丢失一个没食子酰基galloyl(152 u)产生碎片m/z465.068 0[M-H-gallic-galloyl]-,推测分子式为C34H28O22[21]。
3.1.4 逆没食子鞣质类化合物分析
所使用的日降水量数据来源于2001—2016年临安国家基本站观测数据,以20时为日界,日降水量≥50 mm为一个暴雨雨日。本文中的季节划分方式如下:春季为3—5月,夏季为6—8月,秋季为9—11月,冬季为12月—次年2月。
此类化合物共鉴定出23个,由六羟基联苯二酸或与其生源关系的酚羧酸与葡萄糖形成酯,水解后可产生逆没食子酸(鞣花酸),主要分为鞣花鞣酸鞣质类成分和诃子次酸鞣质类成分。
鞣花鞣质类化合物的特征碎片是m/z301,这是由于结构中含有六羟基二苯甲酰基(HHDP),其在负离子模式下失去1个H产生的[22]。Punicalagin A(化合物22)和Punicalagin B(化合物30)的保留时间分别为10.67 min和13.85 min,分子离子峰为m/z1083.059 5[M-H]-,失去一个鞣花酸单元HHDP(302 u)产生碎片离子m/z781.053 6[M-H-ellagic acid]-,继续失去一个葡萄糖(180 u)产生碎片离子m/z600.990 1[M-H-ellagic acid-glu]-,结合特征碎片离子m/z300.998 8,推测其分子式为C48H28O30,化合物22和30被推测为Punicalagin。反相色谱中,Punicalagin A比Punicalagin B先出峰,因此化合物22被推测为Punicalagin A,化合物30被推测为Punicalagin B[23]。
诃子次酸鞣质类化合物结构中含有HHDP存在生源关系的诃子酰基(chebuloyl,Che)。由诃子次鞣质的基本结构单元诃子次酸(Chebulic acid)分子内失去一个H2O、CO2基团产生碎片m/z337[Chebulic acid-H-H2O]-、m/z293[Chebulic acid-H-H2O-CO2]-是诃子次鞣质类化合物的特征碎片。Chebulanin(化合物49,诃子宁)的保留时间是19.19 min,分子离子峰为m/z651.083 8[M-H]-,经碰撞解离,可丢失一个没食子酸(170 u)产生碎片m/z481.063 7[M-H-gallic]-;可丢失一个没食子酰基galloyl(152 u)产生碎片m/z499.070 3[M-H-galloyl]-;可丢失一个没食子酰葡萄糖galloylglusoce(332 u)产生碎片m/z319.009 1[MH-galloyglusoce]-,再丢失CO(244 u)产生碎片m/z275.019 7[M-H-galloyglusoce-CO2]-和碎片m/z231.029 8[M-H-galloyglusoce-2CO2]-,再丢失一个CO(28 u)产生碎片m/z203.035 1[M-H-galloyglusoce-2CO2-CO]-,推测分子式为C27H24O19[24]。
3.1.5 黄酮类化合物分析
此类化合物共鉴定出12个。Rutin(化合物69,芦丁)的保留时间是29.11 min,分子离子峰为m/z609.146 7[M-H]-,经碰撞解离,可丢失一个芸香糖(308 u)形成碎片m/z301.033 4[M-H–C12H20O9]-,再丢失一个H(1 u)产生碎片m/z300.027 6[M-2HC12H20O9]-,或失去一个中性碎片H2CO(30 u)产生碎片m/z271.02 4[M-H-C12H20O9-H2CO]-。碎片m/z301.033 4通过RDA裂解形成碎片m/z151.003 6特征碎片离子,推测分子式为C27H30O16[25]。
3.1.6 萜类化合物分析
此类化合物共鉴定出4个。Arjungenin(化合物85,阿江榄仁素)的保留时间是37.22 min,分子离子峰为m/z503.338 6[M-H]-,经碰撞解离,可丢失一个H2O(18 u)基团产生碎片m/z485.328 6[M-H-H2O]-,再丢失一个COOH(45 u)和CH2OH(31 u)基团产生碎片m/z409.312 0[M-H-H2O-COOH-CH2OH]-;可丢失两个CH(315 u)基团产生碎片m/z473.327 6[MH-2CH3]-,推测分子式为C30H48O6[26]。
3.1.7 其他化合物分析
此他类化合物共鉴定出的17个。Mucic acid(化合物1,粘酸)的保留时间为0.96 min,分子离子峰为m/z209.030 0[M-H]-,经碰撞解离,可失去一个H2O(18 u)基团产生碎片离子m/z191.020 0[M-H2O-H]-,也可失去一个CO(244 u)基团产生碎片离子m/z147.030 0[M-CO2-H]-,推测分子式为C30H48O61[27]。
3.2 大三果醇提物网络药理学分析
3.2.1 大三果醇提物活性成分和靶点筛选分析
根据TCMSP数据库ADME过筛标准,共筛选出12个符合条件的潜在活性成分,具体信息见表2。

表2 根据ADME筛选的12个成分
采用TCMSP数据库和Swiss Target Prediction平台搜索以上12个化合物的相关靶点,得到303个靶点。
3.2.2 主要活性成分-靶点网络图构建
构建大三果化合物-靶点网络图(图1)。该网络由315个节点(12个蓝色节点代表大三果的活性成分,303个橙色节点代表相关靶点)与797条边(代表化学成分与靶点的相互作用)组成,节点的大小表示Degree值的大小,节点越大对应得Degree值越大。其中,Quercetin(Degree=231)、Kaempferol(Degree=155)、Luteolin(Degree=148)、Morin(Degree=116)、Ellagic acid(Degree=81)、Digallate(Degree=20)、3,6-Digalloylglucose(Degree=18)、Taxifolin(Degree=14)、Mucic acid 1,4-lactone 5-O-gallate(Degree=9)、(+)-Catechin(Degree=9)、Phyllanemblinin A(De⁃gree=8)和Chebulic acid(Degree=5)。每个潜在活性成分均能作用于多个靶点,体现了大三果的多成分、多靶点作用。

图1 大三果化合物-靶点网络图
3.2.3 蛋白质-蛋白质相互作用的网络构建与hub基因筛选
将303个药物相关靶点构建蛋白相互作用关系绘制PPI网络(图2)。该网络由258个节点和1276条相互作用连线构成关联网络,节点的大小表示Degree值的大小,节点越大对应得Degree值越大。MCC算法计算前10个关键基因(CXCL8,APP,CHRM2,CXCL2,CXCL10,ADCY2,CXCR1,CXCL11,PTGER3,ADO⁃RA1),提示这些关键基因在大三果药理机制中发挥关键作用(图3)。

图2 蛋白互作网络(PPI)分析

图3 蛋白相互作用网络中关键基因(hub)基因筛选
3.2.4 GO生物过程富集分析
将303个药物相关靶点通过DAVID数据库进行GO生物过程富集分析(P<0.01),共得到524条生物过程。结果显示,生物过程(Molecular function,MF)共富集得到386条,主要涉及对药物的反应、细胞凋亡的负调控、蛋白的自磷酸化与磷酸化和细胞增殖的正调控;细胞组分(Cellular components,CC)共富集得到48条,主要涉及胞浆、细胞外间隙、质膜、胞外体和核浆;分子生物(Biological process,BP)共富集得到90条,主要涉及酶结合、碳酸盐脱水酶活性、蛋白激酶活性与结合和与蛋白质结合(图4)。

图4 生物学过程(GO)富集分析
3.2.5 KEGG信号通路富集结果
将303个药物相关靶点通过DAVID数据库进行KEGG生物过程富集分析(P<0.01),共得到103条信号通路,进一步筛选出前20条,分别为癌症相关途径,乙型肝炎,膀胱癌,前列腺癌,胰腺癌,非小细胞肺癌,胶质瘤,HIF-1信号通路,PI3K-Akt信号通路,慢性粒细胞白血病,TNF信号通路,小细胞肺癌,FoxO信号通路,黑色素瘤,氮代谢,癌症中的蛋白多糖,p53信号通路,ErbB信号通路和孕酮介导的卵母细胞成熟通路(图5)。由此可见,在药物成分对应的靶基因下,富集的信号通路主要集中在对炎症、癌症、免疫等方面,其与大三果的清热、调和气血、化解坏血的主要功效高度吻合,表明了本研究的科学性和合理性。

图5 KEGG信号通路富集
4 讨论
大三果最初记录在阿育吠陀文本《Charaka Samhita》中,并已被用于各种疾病数千年[28]。在隋唐时期经印度传入我国,最早见于藏医药《四部医典》,主治瘟疫、紊乱热症、新旧热症、促使热症成型[29]。至唐朝,大三果的单味药诃子、毛诃子和余甘子均被录入我国首部古药典《唐·新修本草》[30]。在藏医临床中,用药多以成方制剂或不同藏药制剂进行配伍使用,而在药品标准所收载的藏药制剂中,毛诃子与余甘子、诃子所组成的藏药大三果约占19%[4]。大三果具有清热、祛湿、调和气血的功效,并常与其他清热温中、活血行气的药物配伍使用,用以治疗热性、疼痛性或血液性疾病[31]。近年来科学研究验证了其自由基清除,抗氧化,抗炎,抗菌以及潜在抗肿瘤的作用[32]。目前,大三果体内外实验以及临床研究证明可以调节多种细胞信号通路,包 括ERK、MAPK、NF-κB、Akt、c-Myc、VEGFR、mTOR、p53、cyclin D1,促凋亡和抗凋亡蛋白等[33],但物质基础、作用靶点和作用机制仍然不清楚。因此本研究以网络药理学为切入点,探讨大三果的药效物质基础以及主要作用靶点与机制。
网络药理学整合系统生物学、生物信息学等新兴的交叉学科,从“疾病-基因-靶标-药物”生物网络的角度全面分析,进而阐述药物与机体的功能关系[34]。这与中医“整体观”、“辨证论治”的概念理论和中药及其复方多成分、多通路、多靶点协同作用的原理相一致。数据库是网络药理学的前提和基础,此外,通过组学技术或中药化学成分分析等实验方法获得的数据也是生物网络数据的重要来源,具有真实性和可靠性等优点,广泛地应用在中医药现代化的研究。
本实验中大三果三个单味药的配比采用印度传统医药1:1:1比例进行分析,为了更大程度提取主要成分,根据主要化合物极性采用70%乙醇提取样品,定性了85个化学成分,主要成分是鞣质类化合物和黄酮化合物。进一步得到12个活性成分进行网络药理学分析,其中,Chebulic acid(诃子次酸、Ellagic acid(鞣花酸)和Morin(桑色素)主要具有抗炎作用;Taxifolin(花旗松素)具有抗炎与保护心血管作用;Quercetin(槲皮素)、Kaempferol(山奈酚)和Luteolin(木犀草素)具有抗炎与免疫调节作用;(+)-Catechin((+)-儿茶素)同时具有抗炎、免疫调节和保护心血管的作用。Chebulic acid(诃子次酸)具有抗氧化活性和对内皮细胞功能障碍的保护作用[35],可以通过改善晚期糖基化产物诱导的炎症和氧化应激,增强ERK/Nrf2的解毒防御通路,减轻了血管功能障碍[36]。Quercetin(槲皮素)可抑制白血病细胞生长而不抑制正常的造血功能[37],还可通过Nrf2/HO-1通路抑制H2O2诱导人肝细胞LO2凋亡和损伤[38]。(+)-Catechin(儿茶素)可减少氧化应激物的产生,预防血管炎性和血栓生成[39],此外,还可抑制多种癌症细胞[30]。这些成分之间相互配合、相互作用共同发挥大三果“清热、调和气血、化解坏血”的功效,为快速确定大三果药效物质基础研究奠定基础。
首先,12个活性成分作用于303个靶点,依据PPI分析得到的前10位核心靶点中,发现关键靶点主要归属于炎症因子(CXCL8、CXCL2、CXCL10、CXCL11),免疫相关靶点(CXCR1、ADORA1),心血管相关靶点(CHRM2,PTGER3),膜受体靶点(ADCY2)等。其中,CXCL8、CXCL2、CXCL10、CXCL11是炎症细胞因子家族中的趋化因子,主要参与免疫反应、造血功能和炎症反应的调节,对炎症性疾病的发生发展产生了重要作用[40-41]。CXCR1和ADORA1都可以通过提高免疫活性来发挥对机体的保护作用[42]。PTGER3主要参与了水盐代谢、血压的调节以及诱发发热、痛觉、炎症等机体活动[43]。CHRM2是调节心脏活动的主要受体,其失衡与心脏结构和功能的病理改变有关[44]。ADCY2是一种膜相关酶,催化环腺苷单磷酸的形成,有研究表明该基因是肝细胞癌5年生存期有关的关键基因[45]。由此可见,大三果的治疗作用主要是通过以上基因发挥抗炎、抗癌、免疫调节的功能实现的。
KEGG富集分析显示,信号通路主要包括与癌症有关的PI3K-Akt信号通路,TNF信号通路和p53信号通路和HIF-1信号通路。PI3K/Akt信号通路作为细胞内外信号转导的重要纽带,影响着肿瘤细胞的增殖分化、代谢、凋亡、血管生成等,有研究表明该通路中的PI3K和AKT基因在肝癌、结肠癌、胃癌及乳腺癌等恶性肿瘤中常常出现基因突变或基因增殖[46-48]。据报道,Akt下游有40多个靶点,其中p53是迄今发现与人类肿瘤相关性最高的抑癌基因,超过50%的癌症伴有p53基因的突变[49]。突变型p53将降低细胞对有丝分裂、细胞周期、糖酵解、核酸和脂质合成的严格控制,从而促进肿瘤细胞的增殖[50]。目前有研究表明,大三果在SKOV-3、HeLa和HEC-1B细胞,异种斑马鱼移植模型和胰腺癌Capan-2异种移植模型中,都可以抑制肿瘤细胞生长,减少Akt和p53的过表达,进一步证实了大三果通过抑制PI3K-Akt和p53信号通路发挥其抗肿瘤的作用[51-53]。此外,PI3K/Akt细胞核转录因子激活后,将启动和调控下游细胞因子和炎症介质如TNF-α的基因转录[54],引起或加重炎症。TNF-α作为TNF信号通路重要细胞因子,在参与细胞增殖、分化、侵袭、转移、凋亡的同时,还参与机体免疫应答及炎症反应,是许多癌症治疗的有效靶点[55]。HIF-1信号通路也是与癌症相关的重要信号通路。HIF-1由α和β两个亚基组成,参与肿瘤糖酵解、血管生成、增殖与凋亡、侵袭转移、微环境pH调节[56]。在实体肿瘤早期阶段,瘤内细胞的缺氧环境可导致HIF-1α在肿瘤组织和外周血中的表达呈上升趋势[57]。
此外,KEGG富集结果显示,大三果还涉及膀胱癌,前列腺癌,非小细胞肺癌,胶质瘤,慢性粒细胞白血病,小细胞肺癌,黑色素瘤,氮代谢,癌症中的蛋白多糖,孕酮介导的卵母细胞成熟等信号通路。这些网络药理学预测结果说明大三果可以通过这些信号通路对特定疾病具有靶向作用,对研究开发大三果新的适应证具有指导意义。
综上所述,大三果在现代医学研究下不断展现出其广泛的临床方面的应用潜力。本研究首次采用UHPLC-Q-Orbitrap-MS技术与网络药理学结合的方法,对大三果醇提取的化学表征、作用靶点及其信号通路进行了系统研究,发现大三果主要通过抗炎、抗肿瘤、免疫调节与血压调节等作用,其作用机制可能与CXCL8、CXCL2、CXCL10、CXCL11、CXCR1、ADORA1、CHRM2、PTGER3、ADCY2、PI3K/AKT信号通路,TNF信号通路和p53信号通路有关,为大三果的临床应用提供依据。

