异辛基乙二胺-TFA及TFS型质子化离子液体与水分子间氢键相互作用的研究
郑勋,花儿,2*
(1 北方民族大学化学与化学工程学院;2 国家民委化工技术基础重点实验室/宁夏太阳能化学转化技术重点实验室,宁夏 银川 750021)
离子液体(ionic liquids,ILs)是由阴阳离子组成的熔融盐类[1-3],通常分为质子化离子液体(protic ionic liquids,PILs)及非质子化离子液体(aprotic ionic liquids,AILs),ILs具有不同于传统分子溶剂的特殊性能,如熔点低、不易挥发、热稳定性高及较高的电导率[4-5],因此在化学、材料、生物等多个学科领域具有广泛的应用[6-8]。PILs的合成方法较为简单,通过酸碱中和一步合成法可获得,是由Brønsted酸的质子转移至Brønsted碱而形成的一类特殊的ILs,因此,PILs除了具有一般ILs的基本性能以外,因体系内具有能够迁移的质子而可以诱导产生氢键网络,增加其极性[9]。此外,异辛基乙二胺-三氟乙酸型(以下简称[HEtHex][TFA])及异辛基乙二胺-三氟甲磺酸型(以下简称[HEtHex][TFS])的阳离子部位为异辛基乙二胺,与单胺类PILs相比其极性较强而显示较强的亲水性,更易于吸水。
无论是亲水性还是疏水性ILs,水分对ILs的粘度、电导率等物理化学性质具有较大的影响[10]。采用量子化学计算方法研究PILs阴阳离子间、PILs与水分子间氢键相互作用,有助于理解和预测离子液体的宏观物理化学性质,从而能够为PILs的分子设计提供理论指导[9],因此,本文研究利用Gaussian 09软件包,采用DFT/M06-2X方法及6-311G(d,p)基组条件下[11],对[HEtHex][TFA]及[HEtHex][TFS]与nH2O分子间形成的氢键作用进行了研究,主要设计了[HEtHex][TFA]及[HEtHex][TFS]分别与nH2O(n=1,2,6)相结合的几种构型,并通过优化获得几种较稳定构型。另外,[HEtHex][TFA]及[HEtHex][TFS]与H2O间主要形成N—H…O、O—H…O及O—H…N型氢键,并且氢键作用的强弱对其物理化学性质具有较大的影响,因此,本文中还计算、讨论了PILs与水分子间的氢键相互作用,从而预测PILs与H2O分子结合后的物理化学性质及其应用方面具有重要的意义。
1 计算方法
本文中全部计算均采用Gaussian 09[11]软件及AIM2000[12]程序完成的。密度泛函理论(density functional theory,DFT)中M06-2X方法在描述弱相互作用时考虑了色散作用的影响,可以较好地满足对计算分子间弱相互作用的准确性和时效性的要求[13],另外,基组种类繁多,如6-31G、6-311G、def2-TZVP等,而6-311G(d,p)基组对前四周期原子有定义,可对轻原子及重原子加极化函数,故本文利用DFT/M06-2X方法,在6-311G(d,p)基组条件下对所构建的[HEtHex][TFA]-nH2O(n=1,2,6)及[HEtHex][TFS]-nH2O(n=1,2,6)(以下简称PILnH2O)的几何构型进行了优化。
1.1 相互作用能的计算
在M06-2X/6-311G(d,p)水平下对构建的PILnH2O(n=1,2,6)的几何构型进行优化,计算[HEtHex][TFA]及[HEtHex][TFS]与nH2O间的零点振动能(zero-point energy,ZPE)及基组重叠误差(basis set superposition error,BSSE)校正后的相互作用能(ΔE0BSSE)及分子振动频率(ν)。 ΔE0BSSE值采用苏现想等[14]得出的公式计算。
1.2 NBO分析
在相同计算方法和基组条件下,基于自然键轨道分析(natural bond orbital,NBO)计算[HEtHex][TFA]和[HEtHex][TFS]分子与水分子轨道相互作用的二阶微扰能E(2)[15]。E(2)值是推测电子给体-受体相互作用强度的一种表示方法,通过E(2)值的大小能够评价轨道相互作用能的强弱。
1.3 AIM分析和RDG分析
Bader的分子中原子(atoms in molecules,AIM)理论[16]是研究氢键相互作用的重要方法。通过分子结构氢键相互作用处键临界点(bond critical point,BCP)电子密度(ρc)的拓扑分析,可以鉴定[HEtHex][TFA]及[HEtHex][TFS]与nH2O间相互作用的本质。BCP处ρc值是形成化学键强弱的量度,ρc值越小,表明形成化学键越弱;ρc值越大,表明形成化学键越强。
约化密度梯度函数(reduced density gradient,RDG)方法是杨伟涛课题组[17]所提出的一种判断非共价键相互作用的方法,与Barder的AIM理论相比较,RDG分析能够对非共价键作用进行可视化分析,可以将弱相互作用的强度、类型及作用位点显示出来[18]。本文中以[HEtHex][TFA]及[HEtHex][TFS]与nH2O结合的最稳定构型(A4、A5、A8、S4、S7及S8)为例,对其进行RDG分析,探讨PIL-nH2O中氢键相互作用的强弱。
2 结果与分析
2.1 PILs-nH2O构型优化及分子间相互作用能
前期研究合成了[HEtHex][TFA]及[HEtHex][TFS]型PILs,其极性部位为乙二胺结构,具有2个氨基,极性较强而显示较强的亲水性[19-20];该PILs易溶于水,随着水分含量的增加,其粘度减小,电导率增加,即水分对其物性影响较大[20]。因此,本文研究采用DFT/M06-2X方法,在6-311G(d,p)基组条件下,从微观角度对[HEtHex][TFA]及[HEtHex][TFS]与nH2O分子间形成的氢键作用进行研究,并初步探讨与其宏观物理性质间的关系。
2.1.1 [HEtHex][TFA]-nH2O构型优化
本研究基于[HEtHex][TFA][13]及H2O的最稳定构型,设计并优化得到了[HEtHex][TFA]分别与nH2O(n=1,2,6)相结合的构型共8种(A1至A8),即[HEtHex][TFA]-H2O(A1-A4),[HEtHex][TFA]-2H2O(A5-A7)及[HEtHex][TFA]-6H2O(A8),如图1所示。从键长/nm及键角/°可初步判断[HEtHex][TFA]与nH2O间可能形成了N—H…O、O—H…N及O—H…O型氢键。
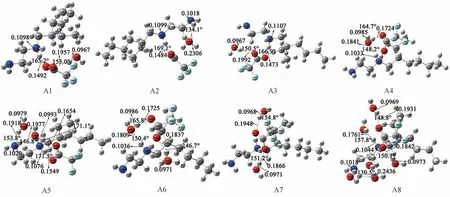
图1 [HEtHex][TFA]-nH2O(A1-A8)的较稳定构型,构型中标注了主要氢键部位的氢键键长及键角
2.1.2 [HEtHex][TFS]-nH2O构型优化
基于[HEtHex][TFS][13]及H2O的最稳定构型,设计并优化得到[HEtHex][TFS]型PIL分别与nH2O(n=1,2,6)相结合的构型共8种(S1至S8),见图2。
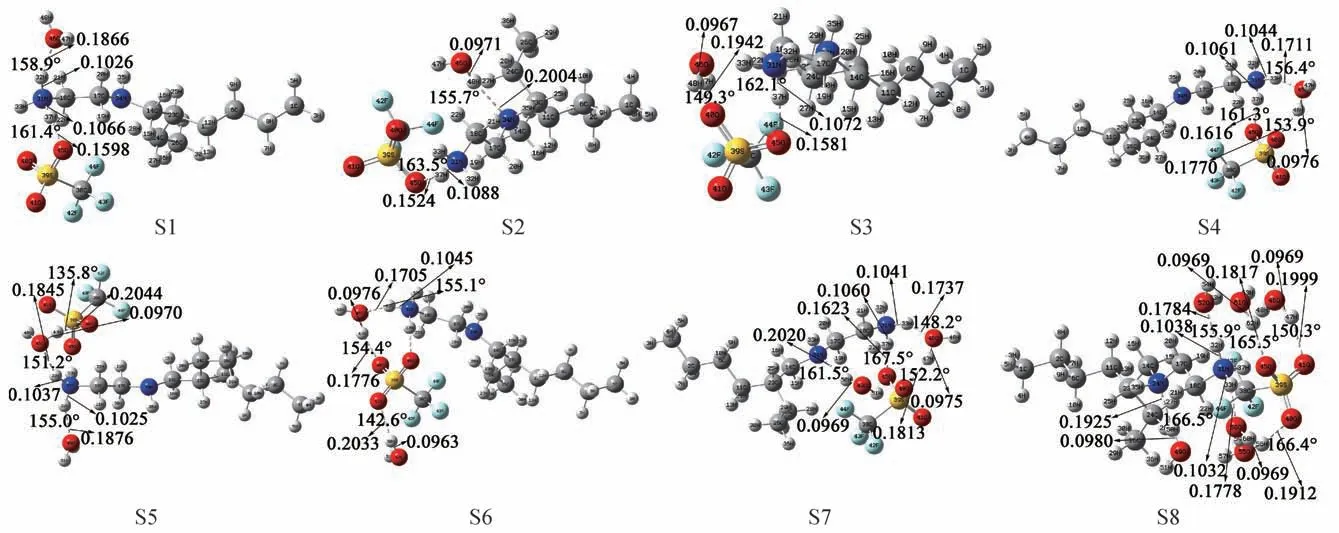
图2 [HEtHex][TFS]-nH2O(S1-S8)的较稳定构型,构型中标注了主要氢键部位的氢键键长及键角
图2中[HEtHex][TFS]-H2O(S1至S4)、[HEtHex][TFS]-2H2O(S5、S7)、[HEtHex][TFS]-6H2O(S8)。根据键长/nm及键角/°的结果显示,[HEtHex][TFS]与nH2O间形成氢键时,同样可能形成了N—H…O、O—H…N及O—H…O型氢键。
2.1.3 PILs-nH2O间相互作用能
[HEtHex][TFA]-nH2O(A1-A8)及[HEtHex][TFS]-nH2O(S1-S8)的ΔE0BSSE如表1、表2所示,BSSE是基组重叠误差(basis-set superposition error)。[HEtHex][TFA]-H2O(A1-A4)的ΔE0BSSE值分别为:-4.11~-11.69 kcal/mol(A4>A2>A1>A3),[HEtHex][TFA]-2H2O(A5-A7):-12.56~-24.61 kcal·mol-1(A5 >A6>A7),[HEtHex][TFA]-6H2O:-59.84 kcal/mol。[HEtHex][TFS]-H2O(S1-S4)的ΔE0BSSE值分别为:-4.84~-13.80 kcal/mol(S4>S1>S3>S2),[HEtHex][TFS]-2H2O(S5~S7):-16.60~-21.21 kcal/mol(S7>S5>S6),[HEtHex][TFS]-6H2O:-69.93 kcal/mol。结果显示:随着PILs与所结合的水分子数量增加,ΔE0BSSE增大。ΔE0BSSE越大,PILs与水分子间相互作用越强。即PILs与水分子间相互作用为PIL-6H2O>PIL-2H2O>PIL-H2O。

表1 [HEtHex][TFA]-nH2O的ZPE及BSSE校正后的相互作用能ΔE0BSSE

表2 [HEtHex][TFS]-nH2O的ZPE及BSSE校正后的相互作用能ΔE0BSSE
除了与2H2O结合情况以外,呈现[HEtHex][TFS]与nH2O间相互作用强于[HEtHex][TFA]与nH2O间相互作用的趋势,例如,H2O([HEtHex][TFS]-S4=-13.80 kcal/mol>[HEtHex][TFA]-A4=-11.69 kcal/mol),6H2O([HEtHex][TFS]-S8=-59.84 kcal/mol>[HEtHex][TFA]-A8=-69.93 kcal/mol)。
2.2 红外光谱分析
在[HEtHex][TFA]-nH2O(A1至A8)及[HEtHex][TFS]-nH2O(S1至S8)较稳定构型的基础上相同计算级别M06-2X/6-311G(d,p)下,计算出H2O、[HEtHex][TFA]、[HEtHex][TFS]及PILnH2O中主要氢键部位所对应的振动频率v及频率变化值Δν(“+”代表红移,“-”代表蓝移),结果见表3和4。
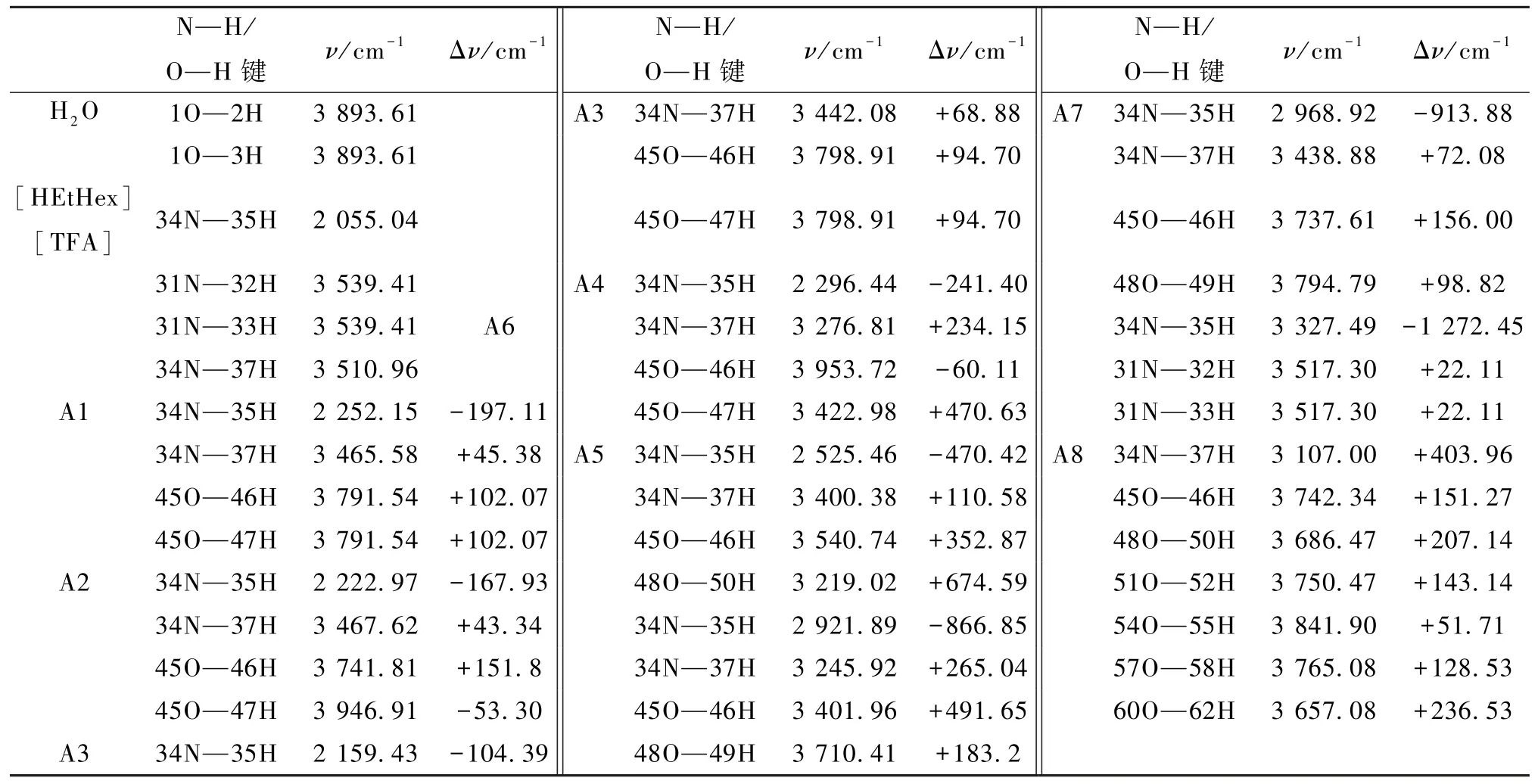
表3 H2O、PIL及[HEtHex][TFA]-nH2O较稳定构型的振动频率变化值Δν
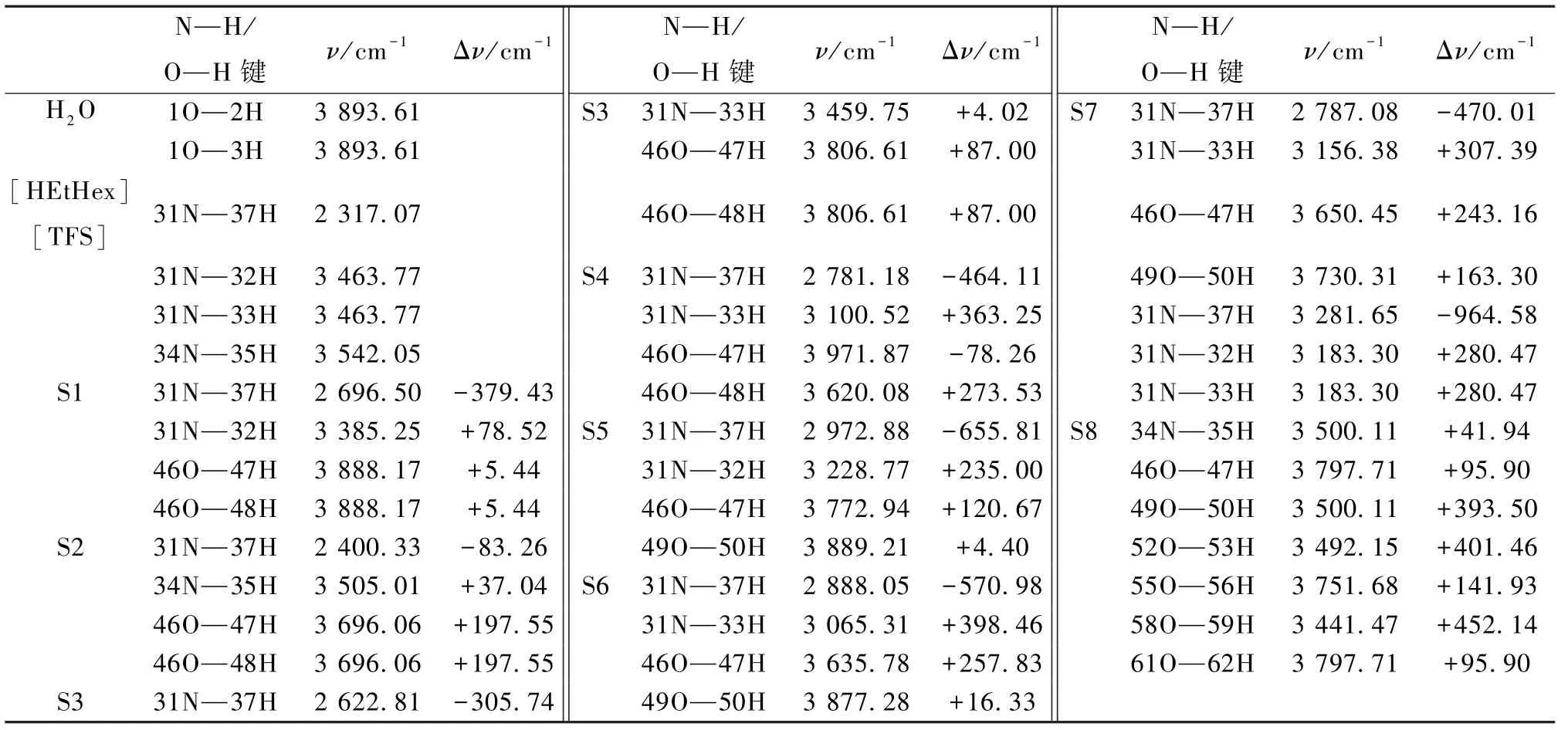
表4 H2O、PIL及[HEtHex][TFS]-nH2O较稳定构型的振动频率变化值Δν
由表3、4可知:[HEtHex][TFA]及[HEtHex][TFS]型PILs与水分子结合后,因为PILs与水分子间形成了较强的N—H…O、O—H…N及O—H…O型氢键,PILs中N—H键发生蓝移。以PIL-H2O为例:[HEtHex][TFA]-A4(34 N—35H Δν=-241.40 cm-1),[HEtHex][TFS]-S4(31 N—37H Δν=-464.11 cm-1),说明[HEtHex][TFA]及[HEtHex][TFS]与水分子结合后,[HEtHex]+[TFA]-、[HEtHex]+[TFS]-的阴阳离子间相互作用减弱。这可能是在水中因为PILs离子迁移率增大而引起其电导率增大,粘度降低[23]。
2.3 自然键轨道分析(natural bond orbital,NBO)
弥散的电荷分布对PILs的稳定性起到重要的作用,并能够更好地解释PILs的微观结构特征[13]。为了更加深入地研究PIL-nH2O分子间电荷分布、电荷转移对分子结构及相互作用能,在相同级别M06-2X/6-311G(d,p)水平下,对[HEtHex][TFA]-nH2O(A1-A8)及[HEtHex][TFS]-nH2O(S1至S8)的共16种较稳定几何构型进行NPA分析。表5、表6是电荷变化较为明显的原子的电荷分布值,可以看出:在氢键相互作用较强部位的原子电荷变化较为明显,其它部位原子上的电荷值没有明显变化。例如,H2O及[HEtHex][TFA]单体中45O、43O、44O的电荷值分别为-0.899、-0.732、-0.621e,形成[HEtHex][TFA]-nH2O后,[HEtHex][TFA]-A4中分别为-0.988、-0.770、-0.735e,电荷变化值为45O(+0.089e)、43O(+0.038e)、44O(+0.114e);H2O及[HEtHex][TFS]单体中46O、40O、41O、45O的电荷分别为-0.899、-1.016、-0.919及-1.029e,形成[HEtHex][TFS]-nH2O后,[HEtHex][TFS]-S4中分别为-0.972、-1.045、-0.921及-1.035e,电荷变化值为45O(+0.073e)、43O(+0.029e)、44O(+0.006e)。“+”表示电荷增加,“-”表示电荷减小。
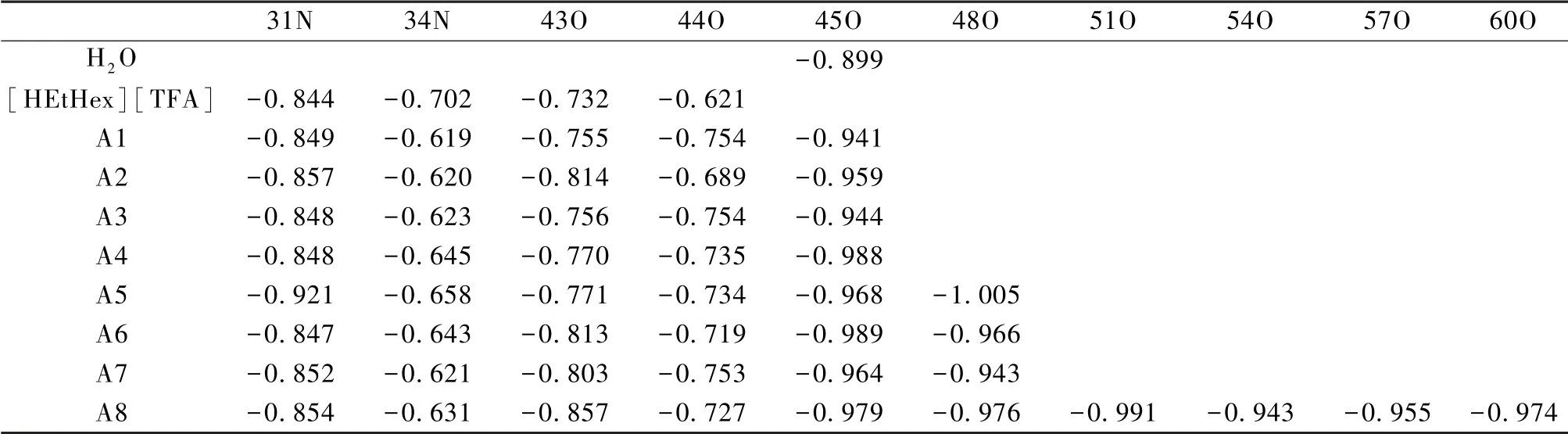
表5 NBO计算得到的[HEtHex][TFA]-nH2O(A1至A8)构型中主要氢键部位的电荷分布值 单位:e
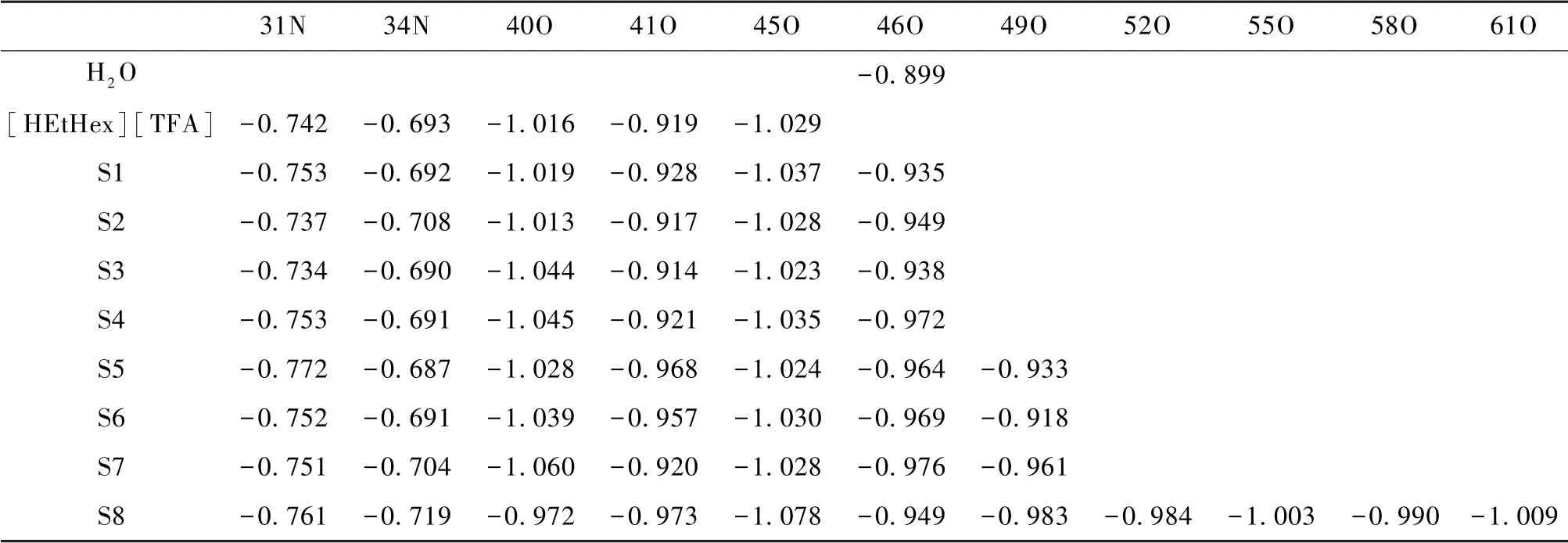
表6 NBO计算得到的[HEtHex][TFS]-nH2O(S1至S8)构型中主要氢键部位的电荷分布值 单位:e
在M06-2X/6-311G(d,p)水平下,通过NBO计算PIL-nH2O主要氢键部位BCPs的E(2)值,值为PIL-nH2O中主要形成氢键的E(2)值之和(表7、表8),结果显示:稳定化能主要来源于[HEtHex][TFA]及[HEtHex][TFS]中N、O原子的孤对电子与nH2O间的O—H反键轨道之间的相互作用力。[HEtHex][TFA]-nH2O(A1-A8)的值 (kcal/mol)为[HEtHex][TFA]-H2O(A4=30.92)<[HEtHex][TFA]-2H2O(A5=41.75)<[HEtHex][TFA]-6H2O(A8=61.25);[HEtHex][TFS]-nH2O(S1-S8)的值(kcal/mol)为[HEtHex][TFS]-H2O(S4=36.17)<[HEtHex][TFS]-2H2O(S7=44.60)<[HEtHex][TFS]-6H2O(S8=77.82)。说明随着与PILs所结合水分子数量的增加,增加,即分子间氢键相互作用增强。
表7 [HEtHex][TFA]-nH2O主要氢键部位BCPs的二阶微扰能单位:kcal/mol

表7 [HEtHex][TFA]-nH2O主要氢键部位BCPs的二阶微扰能单位:kcal/mol
电荷转移 E(2)sum 电荷转移 E(2)sum 电荷转移 E(2)sum A1LP(44O)→BD*(45O—47H)5.69 A5LP(48O)→BD*(31N—33H) A8LP(44O)→BD*(45O—46H)61.25 A2LP(43O)→BD*(45O—47H)11.60 LP(44O)→BD*(48O—50H) LP(43O)→BD*(48O—50H)LP(45O)→BD*(31N—32H) LP(48O)→BD*(34N—37H) LP(44O)→BD*(57O—58H)A3LP(44O)→BD*(45O—46H)3.52 A6LP(45O)→BD*(34N—37H)31.96 LP(43O)→BD*(60O—62H)A4LP(44O)→BD*(45O—47H)30.92 LP(44O)→BD*(45O—46H) LP(45O)→BD*(34N—37H)LP(45O)→BD*(34N—37H) LP(43O)→BD*(48O—50H) LP(48O)→BD*(34N—35H)A5LP(31N)→BD*(45O—46H)41.75A7LP(43O)→BD*(45O—46H)15.14 LP(51O)→BD*(31N—32H)LP(45O)→BD*(34N—37H) LP(44O)→BD*(48O—49H) LP(54O)→BD*(31N—33H)
表8 [HEtHex][TFS]-nH2O主要氢键部位BCPs的二阶微扰能单位:kcal/mol

表8 [HEtHex][TFS]-nH2O主要氢键部位BCPs的二阶微扰能单位:kcal/mol
电荷转移 E(2)sum 电荷转移 E(2)sum 电荷转移 E(2)sum S1LP(46O)→BD*(31N—32H)11.08 S5LP(41O)→BD*(46O—48H) S8LP(34N)→BD*(49O—50H)77.82 S2LP(34N)→BD*(46O—47H)9.69 S6LP(41O)→BD*(49O—50H)40.62 LP(40O)→BD*(55O—56H)S3LP(40O)→BD*(46O—48H)6.78 LP(40O)→BD*(46O—47H) LP(41O)→BD*(46O—47H)S4LP(46O)→BD*(31N—33H)36.17 LP(41O)→BD*(31N—33H) LP(45O)→BD*(61O—62H)LP(40O)→BD*(46O—48H) S7LP(34N)→BD*(49O—50H)44.60 LP(52O)→BD*(31N—32H)S5LP(49O)→BD*(31N—32H)30.89 LP(40O)→BD*(46O—47H) LP(58O)→BD*(31N—33H)LP(46O)→BD*(31N—33H) LP(40O)→BD*(49O—51H)LP(40O)→BD*(46O—47H) LP(46O)→BD*(31N—33H)
经比较可知:[HEtHex][TFS]-nH2O的值大于[HEtHex][TFA]-nH2O的值。
2.4 AIM分析和RDG分析
从表9、表10可以看出:[HEtHex][TFA]及[HEtHex][TFS]与nH2O结合后,主要形成N—H…O、N…O—H及O—H…O型氢键,[HEtHex][TFA]-nH2O氢键作用部位的ρc值(0.009 3~0.040 3 a.u.)与[HEtHex][TFS]-nH2O氢键作用部位的ρc值(ρc=0.010 9~0.043 2 a.u.),约在典型氢键的ρc值(ρc=0.002~0.040 a.u.)范围内,并且ρc值较大,这说明PILs与nH2O间形成了较强的氢键作用。
ρc及ρc(sum)(分子中ρc之和)值见表9、表10所示,结果表明:随着[HEtHex][TFA]和[HEtHex][TFA]与所结合水分子数量的增加,ρc(sum)值增大,表示氢键相互作用增强。[HEtHex][TFA]-nH2O中ρc(sum)值(a.u.)呈以下趋势,例如,[HEtHex][TFA]-6H2O-A8(0.1486)>[HEtHex][TFA]-2H2OA5(0.1146)>[HEtHex][TFA]-H2O-A4(0.0719);[HEtHex][TFS]-nH2O中ρc(sum)值(a.u.)呈以下趋势,例如,[HEtHex][TFS]-6H2O-S8(0.1961)>[HEtHex][TFS]-2H2O-S7(0.1174)>[HEtHex][TFS]-H2O-S4(ρc(sum)= 0.0770)。 [HEtHex][TFA]-nH2O与[HEtHex][TFS]-nH2O的ρc(sum)值相比较,[HEtHex][TFS]-nH2O的ρc(sum)值大于[HEtHex][TFA]-nH2O的ρc(sum)值(a.u.),例如,[HEtHex][TFS]-H2O-S4(0.0770)>[HEtHex][TFA]-H2O-A4(0.0719),[HEtHex][TFS]-2H2OS7(0.1174)>[HEtHex][TFA]-2H2O-A5(0.1146),[HEtHex][TFS]-6H2O-S8(0.1961)>[HEtHex][TFA]-6H2O-A8(0.1486)。说明[HEtHex][TFS]-nH2O间形成的氢键作用强于[HEtHex][TFA]-nH2O间形成的氢键作用。
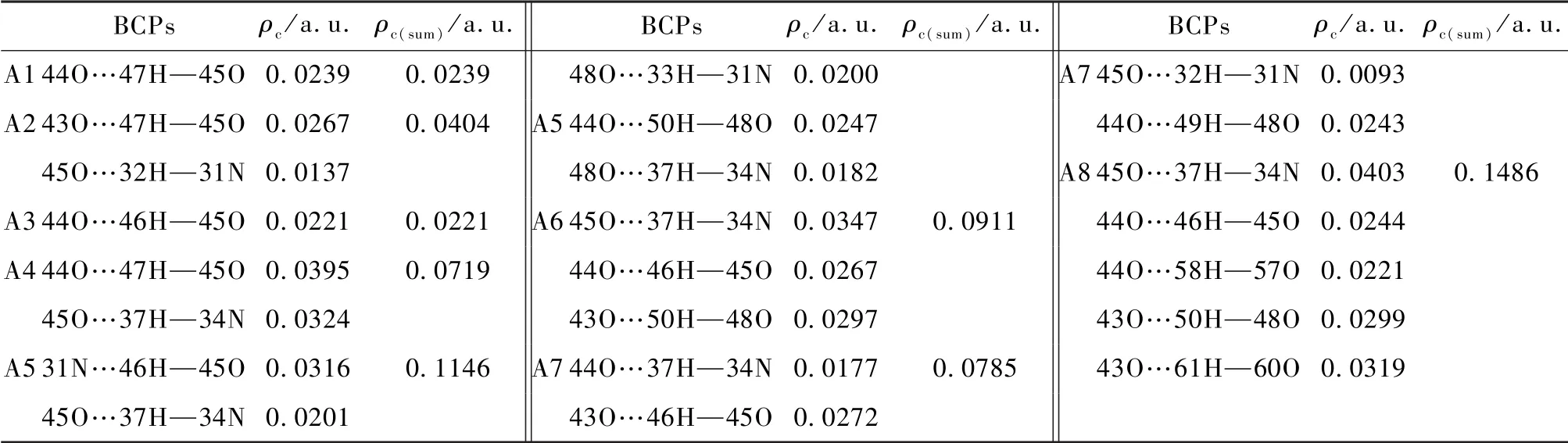
表9 [HEtHex][TFA]-nH2O主要氢键部位BCPs处电子密度

表10 [HEtHex][TFS]-nH2O主要氢键部位BCPs处的电子密度
为了更直观地说明所形成氢键的强弱,根据杨伟涛提出的RDG分析方法[17],相对应地绘制其散点图和填色RDG等值面图。图3为PIL-nH2O最稳定构型的RDG分析结果,其中图3a对应sign(λ2)ρc散点图,其左侧的“突刺”对应图3b、c图中的蓝色区域,表示氢键作用;右侧“突刺”对应图3b、c中的红色区域,表示强互斥作用;图3a中的中间“突刺”对应图3b、c中的绿色区域,表示范德华力作用。本文研究主要通过左侧“突刺”区域的分布密度分析氢键相互作用强弱,结果显示:随着[HEtHex][TFA]及[HEtHex][TFS]与所结合水分子数量的增加,图3a中左侧“突刺”增多,说明氢键作用增强。
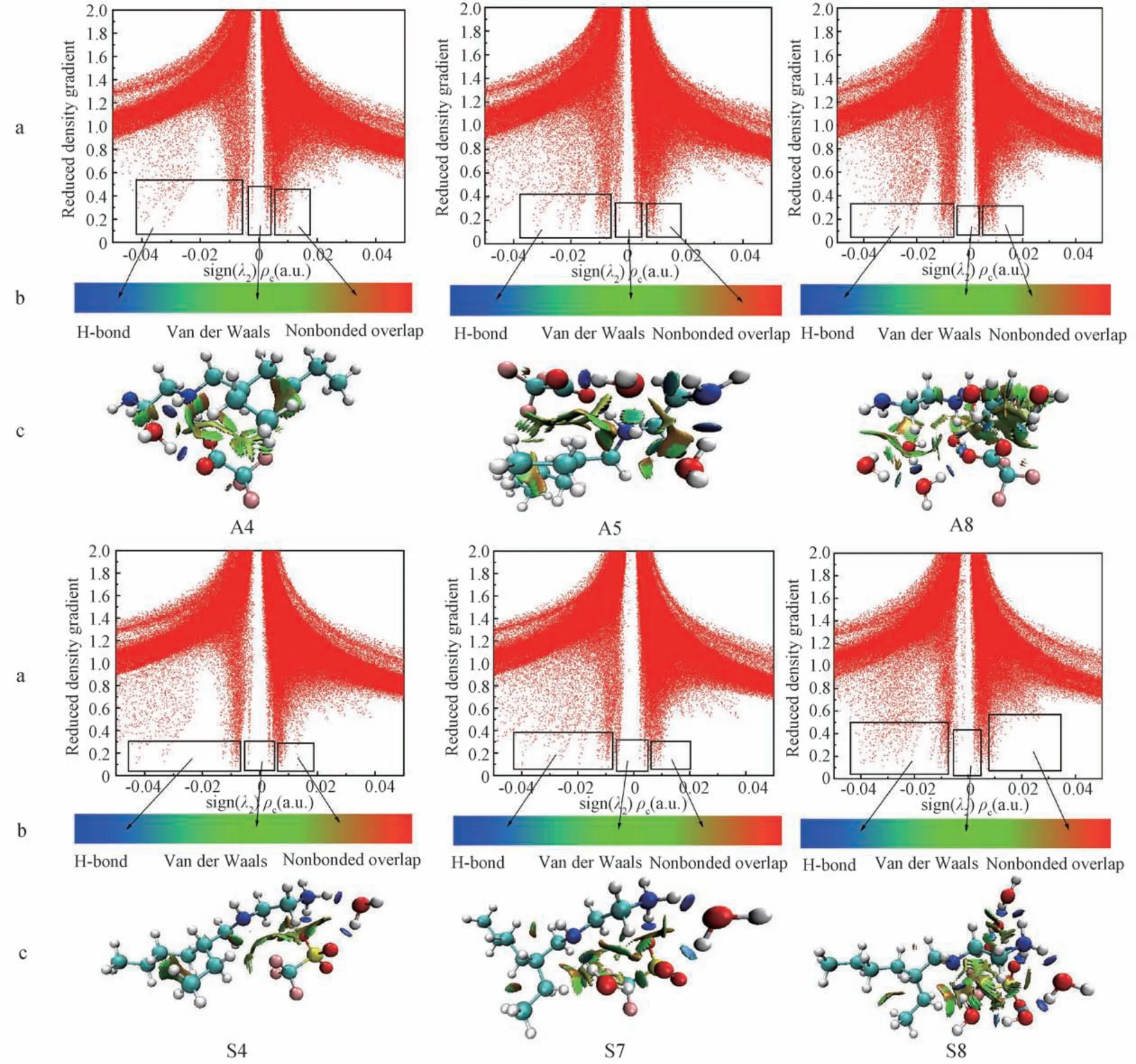
图3 PILs-nH2O在M06-2X/6-311G(d,p)水平下的散点图和填色RDG等值面图
3 讨论
(1)本文采用DFT理论中M06-2X计算方法,并考虑色散作用的影响,与大多数方法(DFT/B3LYP)相比,对于计算分子间弱相互作用的研究更准确,但是由于计算级别较高,所以计算耗时比较长。
(2)本文通过PILs-nH2O分子间相互作用能、电荷分布值、拉普拉斯值及二阶微扰能的计算,研究分析了PILs-nH2O分子间氢键相互作用,可以从微观结构分析水分含量对PILs粘度和电导率等宏观物性的影响;另外,为了更加直观地描述PILs-nH2O间氢键相互作用的强弱、作用位点,本文通过RDG图进行了可视化分析。
4 结论
随着与PILs结合的H2O数量增加,PILs-nH2O间氢键作用增强,PILs的阴阳离子间作用力减弱,离子解离度及迁移率增大,这可能是引起电导率增大、粘度降低的原因;并且[HEtHex][TFS]-nH2O间氢键作用强于[HEtHex][TFA]-nH2O间氢键作用,这表明当阳离子部位相同([HEtHex]+)、阴离子部位为TFS型PIL与水分子间氢键作用大于TFA型PIL。

