TBHP氧化烯丙位sp3C-H键制备其官能团化衍生物
潘馨慧,戴鹏宇,孙兰兰,宋佳星,彭雅,张舒婷,王航宇,赵文彬*,王金辉
(1 石河子大学药学院/新疆植物药资源利用教育部重点实验室,新疆 石河子 832002;2 北京大学天然药物及仿生药物国家重点实验室,北京 100191)
烯丙位碳-碳键的形成是药物合成过程中重要的研究内容之一,传统烯丙基官能团化反应使用的是含有离去基团的化合物,比如烯丙基卤化物、烯丙基醇、烯丙基酯和烯丙基胺等,通过官能团之间的相互转化来获得预期的目标产物,而直接活化烯丙位碳氢键免去引入离去基团的步骤,即直接利用不同反应底物中的C-H键在氧化催化的条件下交叉脱氢直接形成C-C键(图1),有效地提高合成的效率。近年来,过渡金属催化碳-氢键的直接官能团化反应被认为是药物合成中强大的工具[1],这系列反应可以衍生出用于构建碳-碳键的有机分子惰性位点[2];在过渡金属如钯、镍和铜的参与下,经历氧化加成-转金属-还原消除的循环这三个关键步骤,实现不同亲核试剂与芳基亲电试剂的偶联反应,在合成天然和非天然有机化合物中扮演着非常重要的角色[3]。在这些研究过程中,比较突出的是钯催化碳-氢键的官能化反应[4]。然而想要活化简单的烯丙位碳氢键实际上是非常困难的,现有的方法主要是Pd催化氧化的交叉脱氢偶联反应[5-7],也就是Pd既作催化剂又作氧化剂,Pd的用量很大,特别是大规模工业生产过程中需要高催化剂负载的情况下,成本负担尤为沉重,并且环境不友好。李朝军[8]课题组于2006年发展一种由叔丁基过氧化氢(TBHP)(~5.5 mol·L-1正癸烷溶液,4Å分子筛)氧化的金属铜与钴联合催化的活化烯丙位碳氢键的新方法,即以TBHP代替Pd作为氧化剂,且金属仅为催化量,优于Pd催化氧化的交叉脱氢偶联反应。
TBHP是一种挥发性、微黄色透明液体,易溶于醇、酯、醚、烃类有机溶剂和氢氧化钠水溶液,稍溶于水,近年来被广泛应用在实现碳氢键活化的反应中[9-12]。然而李朝军课题组使用的TBHP正癸烷溶液成本仍然较高(100 mL,~5.5 mol·L-1正癸烷溶液,4Å分子筛,萨恩化学技术有限公司,845元),为进一步改善实验条件,本课题组尝试使用更加经济的TBHP水溶液(100 mL,70%水溶液,萨恩化学技术有限公司,55元)作为氧化剂,催化剂选用Cu+[13-15],Co2+[16],以期采用更经济的方式实现烯丙位碳氢键的官能团化(图1)。

图1 交叉脱氢偶联反应
1 材料与方法
1.1 材料
仪器:旋转蒸发仪(上海爱朗仪器有限公司)、循环水式多用真空泵(郑州长城科工贸有限公司)、电子天平(北京赛多利斯仪器系统有限公司)、紫外分析仪(上海顾村电光仪器厂)、加热磁力搅拌仪(金坛市医疗仪器厂)、 Bruker-DMX 400 型核磁共振仪(以TMS为内标,DMSO或CDCl3为溶剂测试);
试剂:柱层析硅胶(200-300目,青岛海洋化工有限公司)、薄层硅胶GF254(青岛海洋化工有限公司)、氯化钴(CoCl2.6H2O,盛奥化学试剂有限公司)、乙酸乙酯(天津永晟精细化工有限公司)、石油醚(天津永晟精细化工有限公司)、二氯甲烷(天津市富宇精细化工有限公司),乙腈(天津市富宇精细化工有限公司)、TBHP(70%水溶液,萨恩化学技术有限公司)、TBHP(5.0-6.0 mol·L-1正癸烷溶液,萨恩化学技术有限公司)、TBHP(~5.5 mol·L-1正癸烷溶液,4Å分子筛,萨恩化学技术有限公司),其它化学试剂均为分析纯或化学纯,购买于阿拉丁化学试剂公司;所有溶剂严格按照溶剂处理手册标准进行处理。
1.2 方法
分别量取环己烯101.4 μL;乙酰丙酮20.4 μL;TBHP 40.2 μL;用分析天平称取氯化亚铜0.004 9 g;氯化钴0.002 6 g;量取溶剂乙腈1.5 mL于反应管中,加入磁子置于磁力搅拌仪上,预热到80 ℃,700转速条件下反应,期间TLC点板监测反应(展开剂 PE∶EA=10∶1),反应结束后,旋转蒸发仪浓缩反应液,硅胶柱层析纯化产物(流动相 石油醚:乙酸乙酯=10∶1),洗脱液用旋转蒸发仪浓缩蒸干,称重计算产率。
1.3 化合物结构表征
3-(环己-2-烯基)-2,4-戊二酮(3a):淡黄色油状物,1H NMR (400 MHz,DMSO) δ 5.71 (ddd,J=9.9,5.9,3.6 Hz,1H),5.36 (ddd,J=10.1,4.2,2.1 Hz,1H),3.82 (d,J=9.5 Hz,1H),2.84 (dtd,J=8.0,5.4,2.6 Hz,1H),2.17 (s,3H),2.15 (s,3H),1.93 (tdd,J=4.3,3.3,1.4 Hz,2H),1.62(dddd,J=14.5,12.4,7.1,4.8 Hz,2H),1.54-1.38(m,1H),1.22-1.09 (m,1H).HRMS calcd for C11H16O2:180.1204;found:180.2400.已知化合物,波谱数据参见相关文献[8]。
2-(环己-2-烯基)-3-氧代丁酸甲酯(3b):淡黄色油状物,1H NMR (400 MHz,CDCl3) δ 5.87-5.68 (m,1H),5.55-5.35 (m,1H),3.73 (t,J=1.7 Hz,3H),3.39 (dd,J=9.9,7.7 Hz,1H),2.95 (dtd,J=12.7,5.0,2.7 Hz,1H),2.25-2.23 (m,3H),1.99 (dd,J=4.4,1.9 Hz,2H),1.72 (ddd,J=12.1,5.8,2.5 Hz,2H),1.25-1.15 (m,2H).HRMS calcd for C11H16O3:196.1100;found:196.1102.已知化合物,波谱数据参见相关文献[8]。
1-苯基-2-(环己-2-烯基)-1,3-丁二酮(3c):淡黄色油状物,1H NMR (400 MHz,CDCl3) δ 8.05-7.95 (m,2H),7.62-7.54 (m,1H),7.52-7.38 (m,2H),5.85-5.62 (m,1H),5.50-5.36(m,1H),4.43 (dd,J=10.7,7.5 Hz,1H),3.26(tdd,J=10.5,5.3,2.6 Hz,1H),2.21-2.12 (m,3H),2.03-1.93 (m,2H),1.80-1.68 (m,2H),1.63-1.50 (m,1H),1.40-1.11 (m,1H).HRMS calcd for C16H18O2:242.1307;found:242.1300.已知化合物,波谱数据参见相关文献[8]。
2-(环己-2-烯基)3-氧代-4-氯丁酸乙酯(3 d):淡黄色油状物,1H NMR (400 MHz,CDCl3) δ 5.85-5.74 (m,1H),5.56-5.34 (m,1H),4.20 (ddd,J=12.6,8.5,6.6 Hz,4H),3.64 (dd,J=9.3,4.7 Hz,1H),2.99 (ttd,J=7.8,5.1,2.4 Hz,1H),2.04-1.93 (m,2H),1.81-1.50 (m,4H),1.26 (t,J=7.1 Hz,3H).HRMS calcd for C12H17O335Cl:244.0866;found:244.0862;C12H17O3Cl:246.083 7;found:246.0843.已知化合物,波谱数据参见相关文献[8]。
3-(环戊-2-烯基)-2,4-戊二酮(3e):淡黄色油状 物,1H NMR (400 MHz,CDCl3) δ 5.86-5.82(m,1H),5.54 (dt,J=5.7,2.1 Hz,1H),3.55 (d,J=10.6 Hz,1H),3.52-3.44 (m,1H),2.33 (d,J=2.7 Hz,2H),2.21-2.19 (m,6H),2.14-2.04 (m,2H).HRMS calcd for C7H7O2(M-43):123.0446;found:123.0447.已知化合物,波谱数据参见相关文献[8]。
3-(环辛-2-烯基)-2,4-戊二酮(3f):淡黄色油状物,1H NMR (400 MHz,CDCl3) δ 5.77 (dt,J=9.9,8.0 Hz,1H),5.16-5.04 (m,1H),3.67 (d,J=10.7 Hz,1H),3.40 (dd,J=21.4,10.3 Hz,1H),2.22 (s,3H),2.11 (s,3H),1.75-1.68 (m,2H),1.51 (dddd,J=22.7,14.9,9.6,5.7 Hz,7H),1.13~1.05 (m,1H).HRMS calcd for C13H20O2:208.1463;found:208.1457.已知化合物,波谱数据参见相关文献[8]。
2 结果
本研究选择经济易得且对香草醛试剂敏感的环己烯作为底物和与乙酰丙酮为亲核试剂,建立烯丙位官能团化的反应模型,优化反应的最佳条件,以期得到最高的产率,并且探究其应用的广泛性(图2)。

图2 环己烯与乙酰丙酮的模型反应
2.1 TBHP氧化烯丙位Sp3C-H键官能团化反应条件的优化
采用控制单一变量的方法,通过改变上述反应模型的反应条件,从溶剂、氧化剂、催化剂和添加剂四个方面进行条件筛选,通过对所测得的产率进行比较以获得高效、经济的快速实现烯丙位碳-氢键官能团化的反应条件。
首先在溶剂筛选中发现,极性相对较小的四氢呋喃、乙酸乙酯作为溶剂时,反应几乎不能发生。极性相对较大的N,N-二甲基乙酰胺、乙腈、水作为溶剂时,反应可以顺利进行,其中以乙腈作溶剂,产率最高为44%,故采用乙腈作溶剂,见产物1-5(表1)。
在乙腈作溶剂的基础上,进一步筛选反应使用的催化剂,CuCl、CoCl2的联合催化效果胜于单独使用其中一种催化剂,或其它催化剂。当CuCl的量为0.25eq(0.004 9 g),CoCl2的量为0.1eq(0.002 6 g)时产率最高为68%,见产物4、6-13(表1),故采用CuCl(0.25eq),CoCl2(0.1eq)作为催化剂,继续优化反应条件。
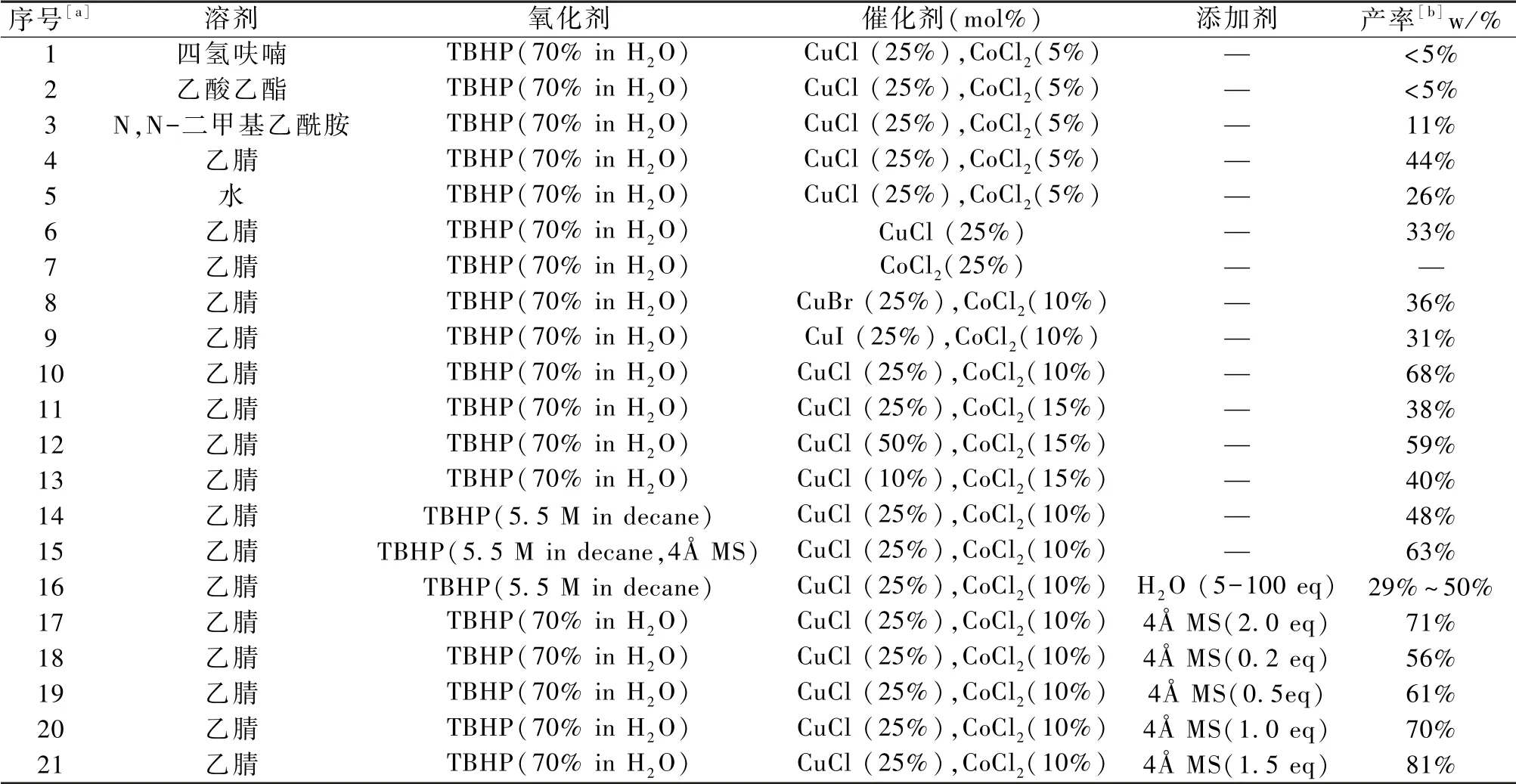
表1 溶剂对产率的影响
在最优的溶剂、催化剂基础上,进一步筛选氧化剂TBHP规格,见产物10、14-15(表1)。目前市售的TBHP主要有3种规格,分别是70% 水溶液、5.0~6.0 mol·L-1正癸烷溶液和~5.5 mol·L-1正癸烷溶液(含4Å分子筛),其中以TBHP(70% 水溶液)作氧化剂能得到较高的产率68%,推测反应体系中加入适量的水,可能催化反应发生。
在表1的16号反应中,课题组尝试通过向反应体系加入5~100 不等当量的水,考察水作为添加剂对反应的影响。遗憾的是,产率徘徊在29%~50%,且不论加入微量或大量的水,都不能进一步提高反应产率。
结合表1的1-2号反应对反应溶剂的筛选结果,小极性的溶剂不能很好地促进反应发生的结果,课题组认为,通过加入不同当量的水不能提高反应产率的原因,可能是TBHP中存在的正癸烷本身会降低反应产率。然而市售的TBHP(水溶液)仅有70%的规格,因此,课题组继续使用70% 水溶液的TBHP。
为进一步考察水对该反应的影响,本课题组利用药物合成反应中常用的干燥剂:分子筛[17],控制反应体系中的水含量。初步选择加入2 eq 粉末状4Å分子筛除水,令人兴奋的是,反应得到了更高的产率71%,产物17(表1)。
进一步筛选分子筛的用量,当4Å分子筛的用量为1.5eq时得到产物的产率最高为81%(表1,产物17-21),因此,在反应体系中加入添加剂1.5eq分子筛(0.018 g)。
由此最终确定的最优反应条件为:以乙腈作为溶剂,以0.25 当量CuCl、0.1 当量CoCl2作为催化剂,以2当量70%水溶液TBHP作为氧化剂,以1.5当量粉末状4Å分子筛作为干燥剂,环己烯为5当量,反应温度为80 ℃,反应时间为2 h。
2.2 底物和亲核试剂扩充
在确定最优条件的基础上,继续进行底物扩充实验,验证该实验条件应用范围的广泛性。由表2可知,在原有的反应条件下更换底物和亲核试剂,均能实现烯丙位碳氢键的官能团化,得到相应产物,且产率均较高。

图3 环己烯与乙酰丙酮的反应
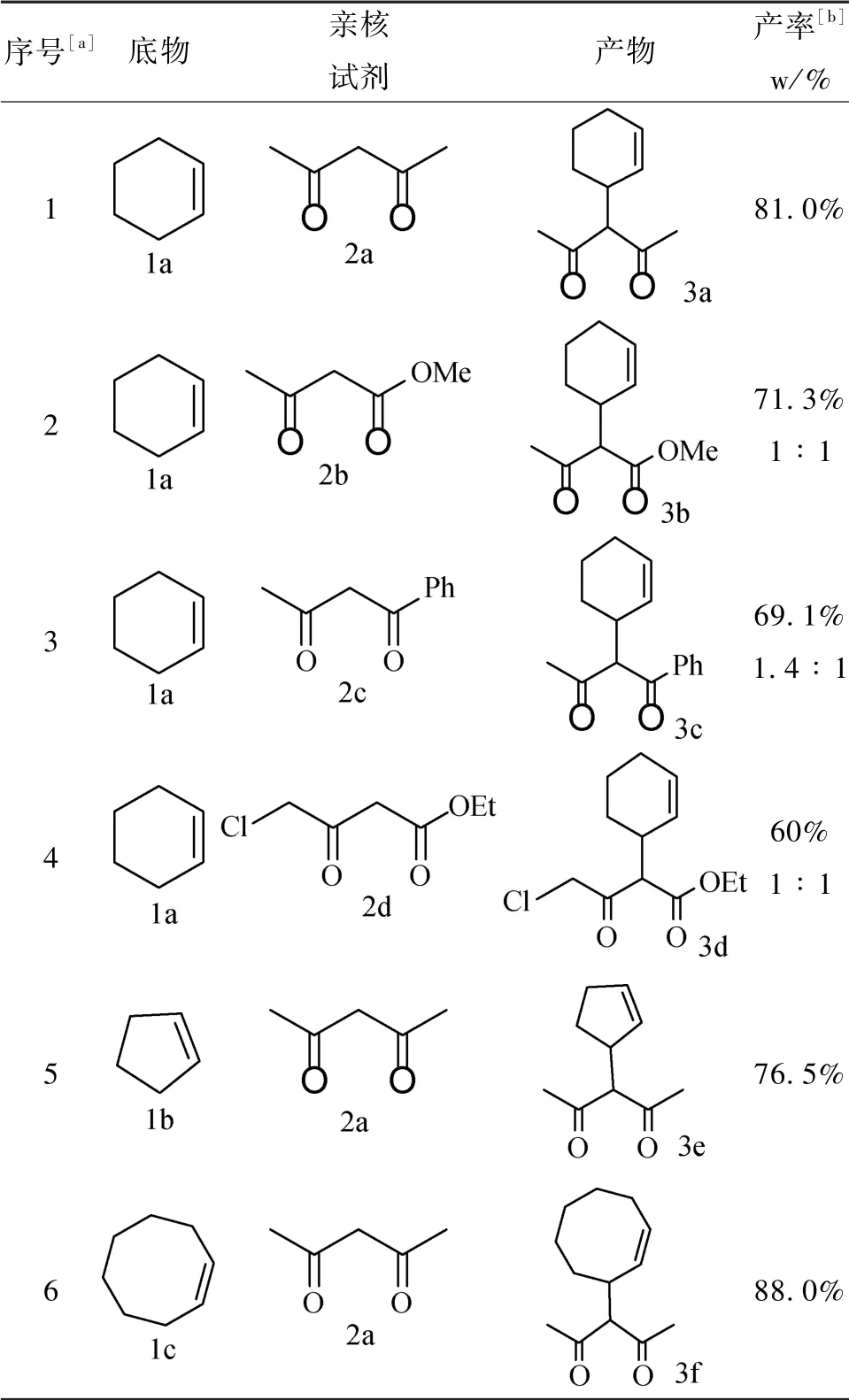
表2 底物和亲核试剂的扩充
3 讨论
(1)本文以铜盐、钴盐为催化剂,以TBHP(70%水溶液)为氧化剂,加入4Å分子筛可以有效地促进环己烯烯丙位C-H键的活化,进而完成与乙酰丙酮直接反应,实现把碳-氢键直接转换成碳-碳键,同时该体系也适用于其他与环己烯结构相似的环状烯烃的烯丙位C-H键活化反应,应用范围广泛。与传统方法(如以过渡金属Pd做氧化剂)相比较,利用叔丁基过氧化氢(简称TBHP)作为氧化剂实现烯丙位碳-氢键官能团化反应,一定程度上节省了合成所需成本且污染小,避免了在制药和电子材料行业中所产生的“过渡金属残留问题”[18]。
(2)本文首次使用TBHP(70%水溶液)作为氧化剂,提高反应效率,并解决TBHP正癸烷溶液价格较贵且具有一定毒性的难题,在合成过程中降低成本,提高了实验的安全性,在已有的基础上为实现交叉脱氢偶联反应提供了一种更为节能,安全且高效的反应条件。同时本文通过对氧化剂所处溶液体系的改变进行实验得到具有不同显著差异的效果为进行交叉脱氢偶联反应所需条件的探索提供思路。
(3)探索以及发展不依赖于过渡金属的合成方案,提供实现交叉脱氢偶联反应的新策略,有效地从根源上消除过量金属催化剂带来的相关问题显得尤为重要,本实验基于这一绿色化学的理念,环境友好,成本低,易操作,污染小,原子经济性高。本实验原理亦可应用于其他的含烯丙位碳氢键官能团的化合物,有良好的市场应用前景。
(4)交叉脱氢偶联反应作为高效高选择性的合成反应,在有机合成化学反应中发挥了巨大的作用,提供了一种新的思路;同时作为一种绿色环保的新反应,实现更加高效和绿色的氧化催化体系及其反应机理需要更加广泛地探索和发现。

