SLC26A3在结直肠癌中的表达、功能及影响机制探讨
陈向金,杨柳,李变利,彭颖,黄俊凯,徐丽红
(1 石河子大学医学院,新疆 石河子 832000;2 内江市第一人民医院,四川 内江 641000;3 成都市第五人民医院消化内科,四川 成都 611130;4 石河子大学医学院第一附属医院,新疆 石河子 832000)
结直肠癌(Colorectal cancer)是常见的消化道肿瘤,在我国结直肠癌的发病率和死亡率均保持上升趋势,发病率为376.3/10万,死亡率为191.0/10万[1],其临床表现主要有腹痛、黏液血便、排便习惯改变等,其中排便习惯改变最常见[2]。
SLC26A3(又称DRA)最早通过基因消减杂交技术对比匹配正常结肠组织和结肠癌组织的cDNA基因文库后被确定为结肠癌的抑癌基因[3]。该基因主要表达在结肠正常黏膜组织,在结肠癌组织和结肠癌细胞系中表达明显降低,故其蛋白质产物最开始被命名为DRA(downregulated in adenoma),既往研究认为DRA的下调与结肠癌的进展具有相关性[4]。研究表明[5],DRA是位于结肠上皮顶端细胞膜上阴离子交换体,主要负责Cl-跨膜吸收和HCO3-的分泌,并参与维持肠黏液层的通透性及稳定性[6],PI3K/ AKT信号通路的活化是SLC26A3从细胞内向细胞膜转移定位的条件之一,通过调控PI3K/AKT信号通路可提高细胞顶端膜SLC26A3的蛋白表达和Cl-/OH-离子交换活性[7]。既往研究提示,结肠癌患者中,肠道PI3K/AKT信号通路存在异常活跃[8]。那么,在结直肠癌患者中,SLC26A3的表达改变对其远期预后和临床特征是否有影响?PI3K/AKT信号通路活跃对SLC26A3蛋白表达最终是发挥了何种作用?本研究欲对这些问题进行探索和分析。
1 材料与方法
1.1 材料
Caco-2人结直肠腺癌细胞,购自中国科学院细胞库。MEM培养基购自美国Gibco公司,胎牛血清、胰蛋白酶(Trypsin-EDTA)购自美国Hyclone公司,IGF-1购自美国Peprotech公司,LY294002购自美国APExBIO公司,兔抗人p-PI3K、p-AKT抗体购自美国 Cell Signaling Technology公司,兔抗人SLC26A3抗体购自英国Abcam公司,小鼠抗β-actin、GAPDH单克隆抗体、山羊抗兔、小鼠IgG/辣根酶标记二抗购自北京中杉金桥生物科技有限公司,SuperSignal Western Blot Enhancer发光试剂购自美国Thermo Fisher公司。
1.2 方法
1.2.1 数据库信息挖掘
通过对Oncomine,GEPIA,cBioportal,Genecards数据库进行数据挖掘,我们探索了SLC26A3在肿瘤疾病尤其是结直肠腺癌及相应正常组织细胞中的表达情况,并分析了调控SLC26A3的相关因素。此外,我们还对SLC26A3与结直肠腺癌患者的临床特征和预后的关系进行了探索以及通过分析单细胞测序数据库CancerSEA研究SLC26A3在结直肠癌中的功能。
1.2.2 Caco-2细胞培养
Caco-2细胞培养于含20%FBS胎牛血清的MEM完全培养基中培养,MEM培养基(GIBCO,货号41500034,添加NaHCO3 1.5 g·L-1,Sodium Pyruvate 0.11 g·L-1),80%;优质胎牛血清,20%。气相:空气,95%;二氧化碳,5%。温度:37摄氏度。细胞融合度为80%~90%时传代,传代后细胞贴壁较慢,48 h内不要换液;细胞形态不均一,有一些含有液泡的巨大细胞,属正常现象;消化时间3~5 min。
1.2.3 Western Blot法检测Caco-2细胞中p-PI3K、p-AKT与SLC26A3的表达
Caco-2细胞经PI3K激动剂或抑制剂处理12 h后,使用细胞裂解液抽提细胞总蛋白,经BCA法测蛋白浓度。SDS-PAGE凝胶电泳(80 V,2 h),半干法转膜(20 V,90 min)后室温下5%脱脂奶粉溶液封闭2~4 h,使用5%BSA溶液稀释p-PI3K(1∶1 000)与p-AKT(1∶1 000)一抗,5%脱脂牛奶稀释SLC26A3(1∶1 000)与GAPDH(1∶1 000)一抗,山羊抗兔、鼠二抗稀释比例均为(1∶20 000)。一抗免疫反应4 ℃过夜,洗膜后二抗免疫反应2-4 h,经TBST洗膜后暗室显色、胶片曝光,采图后经Image J图像软件分析灰度值。
1.3 统计学处理
采用SPSS 19.0统计软件进行分析,Western Blot灰度值以(±S)表示,采用单因素方差分析(One-Way ANOVA)比较各组间差异,P<0.05差异具有统计学意义。
2 结果与分析
2.1 SLC26A3在结直肠肿瘤中的表达情况
SLC26A3在结直肠肿瘤组织中的表达相较正常组织均呈现出较低的表达水平。通过检索Oncomine数据库,有12项结直肠癌研究结果发现SLC26A3在肿瘤组织中的表达水平低于正常组织(图1A)。通过CCLE数据库,对SLC26A3在不同肿瘤细胞系中的mRNA表达情况进行分析发现:SLC26A3在所有肿瘤细胞系中均呈低表达水平,但SLC26A3在结直肠癌细胞系中的mRNA表达水平位居全部肿瘤细胞系之首(图1B)。通过检索GEPIA数据库,我们发现SLC26A3在结肠腺癌(COAD)和直肠腺癌(READ)中的表达水平均高于其在其他肿瘤组织中的表达水平。与Oncomine数据库中的发现相似,GEPIA数据库的结果同样提示SLC26A3在结直肠腺癌中的转录水平均低于其在正常结直肠组织中的表达水平(图1C)。

图1 SLC26A3在各类肿瘤中的表达情况
2.2 SLC26A3在结直肠腺癌中的分子与临床特征(图2)
基于前述SLC26A3在所有肿瘤类型中的表达情况,我们选取结肠腺癌和直肠腺癌进行进一步分析。通过cBioportal数据库,我们发现约10%的结肠腺癌存在SLC26A3相关的基因突变或拷贝数变化;有近5%的直肠腺癌存在SLC26A3相关的基因突变或拷贝数变化。值得注意的是,结肠腺癌的SLC26A3 mRNA低表达水平是其分子学水平最主要的改变(图2A)。随后,我们对SLC26A3在结直肠腺癌中具体的基因突变和拷贝数变异类型进行探索,发现对于基因突变,错义突变(Missense)是最主要的类型;对于拷贝数变异,拷贝数增加(Gain)是最主要的类型(图2B)。在SLC26A3的临床特征方面,GEPIA数据库中并未提示结直肠腺癌的肿瘤组织(红色:TCGA来源)与相应正常组织(灰色:TCGA+GTex来源)相比存在统计学差异。SLC26A3在不同分期的结直肠腺癌间亦未发现明显差异(P>0.05)(图2C、2D)。
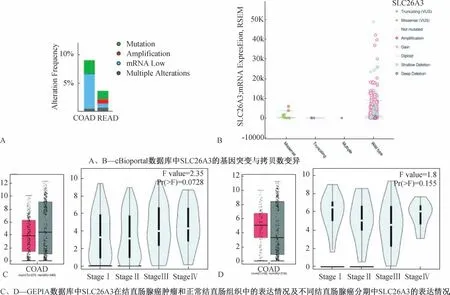
图2 SLC26A3在结直肠腺癌中的分子学特征
2.3 SLC26A3对结直肠腺癌病人预后的影响
通过GEPIA数据库,我们对SLC26A3高表达水平和低表达水平的病人之间的生存差异进行探索。对于结肠腺癌病人(图3A、B),SLC26A3的表达水平对总生存期(P=0.097)和无病生存期(P=0.61)均无影响,但对于总生存期在50个月内结肠腺癌病人,高表达SLC26A3的病人生存率更高。
对于直肠腺癌病人(图3C、D),SLC26A3的表达水平与总生存期(P=0.36)和无病生存期(P=0.79)亦无明显相关性,但对于总生存期在40个月内直肠腺癌病人,高表达SLC26A3的病人生存率更高。

图3 SLC26A3对结肠腺癌病人的总生存率、无病生存率直肠腺癌病人的总生存率、无病生存率的影响
2.4 SLC26A3在结直肠癌中的功能
通过对单细胞测序数据库CancerSEA进行分析,我们发现SLC26A3的表达与结直肠癌细胞的增殖(P<0.01)、细胞周期(P<0.01)以及DNA修复(P<0.05)呈负相关(图4)。

图4 CancerSEA单细胞测序数据库中SLC26A3在结直肠癌中的功能
2.5 Caco-2细胞中PI3K/AKT信号通路对SLC26A3蛋白表达的影响
利用Caco-2细胞给予不同浓度的IGF-1试剂,加药浓度依次为0.1、0.2、0.4、1、2、3 μg·mL-1。
结果提示当激活PI3K/AKT信号通路时,SLC26A3蛋白表达量随着IGF-1浓度的增加而增加,增加至0.4 μg·mL-1时达高峰,当IGF-1浓度大于0.4 μg·mL-1后,SLC26A3蛋白表达量呈降低趋势(N:0.427±0.011,0.1∶0.613±0.003,0.2∶0.676±0.001,0.4∶0.976±0.001,1∶0.827±0.001,2∶0.729±0.002,3∶0.497±0.001,P<0.05)(图5A)。利用Caco-2细胞,分别给予不同浓度的LY294002试剂,加药浓度依次为1、2、3、4、5、6 μg·mL-1。
SLC26A3表达量随着LY294002浓度的增加而减少(N:0.605±0.001,1∶0.787±0.005,2∶0.958±0.002,3∶0.698±0.001,4∶0.756±0.002,5∶0.629±0.007,6∶0.598±0.003,P<0.05)(图5B)。
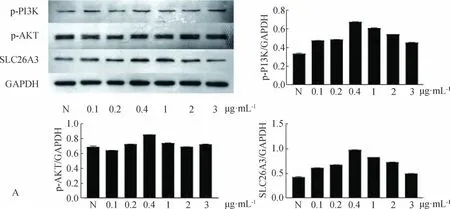

图5 PI3K/AKT信号通路对SLC26A3的影响
3 讨论
SLC26A3最早被发现在结肠癌中低表达,并且是结肠癌的抑癌基因[3]。本研究在Oncomine、GEPIA、CCLE数据库中发现其主要表达在结直肠组织和结直肠癌细胞中,与先前研究一致。ANTALIS等人[4]发现SLC26A3 mRNA在所有结肠肿瘤中的表达水平均低于匹配的正常黏膜,其表达下调与结肠肿瘤的Dukes分期呈正相关,在正常黏膜向息肉到腺癌的早期转变中尤为显著,SLC26A3的表达缺失和下调分别与隐窝上皮的增殖成分和肿瘤转化有关。本研究在GEPIA数据库发现Ⅲ期、Ⅳ期结肠癌患者中SLC26A3表达高于Ⅰ期、Ⅱ期患者但其差异无统计学意义,Ⅰ期直肠癌患者中SLC26A3的表达水平明显高于Ⅱ期、Ⅲ期和Ⅳ期患者,Ⅲ期最低但其差异无统计学意义。此结果中直肠癌与ANTALIS等[4]研究结果相似,但结肠癌结果与其结果相反,这可能提示SLC26A3在直肠癌中的功能改变和结肠癌不同。
已有研究证实在结肠上皮细胞SLC26A3作为膜蛋白主要分布在面向肠腔的刷膜一侧[9],SLC26A3的突变可引起先天性失氯性腹泻,确定SLC26A3是位于肠上皮细胞顶端膜与Cl-跨膜吸收和HCO3-的分泌有关的溶质运载体家族(SLC)26成员之一[10],提示SLC26A3不仅具有调节肠黏液层水、电解质的功能,而且还参与维持肠黏液层的通透性及稳定性[6]。因此,推测SLC26A3的异常表达可能是结直肠癌患者出现排便习惯改变的原因之一。
CHAPMAN等[11]研究发现,SLC26A3在结肠癌、乳腺癌、肾癌和宫颈癌细胞系中低表达,过表达SLC26A3基因后可抑制细胞的生长,表明SLC26A3在肿瘤中发挥着抑癌基因的作用。我们通过单细胞测序数据库CancerSEA发现SLC26A3的表达与结直肠癌细胞的增殖、细胞周期以及DNA修复呈负相关,提示SLC26A3可能通过影响肠癌细胞增殖、细胞周期和/或DNA损伤修复而发挥抑癌作用。研究表明[6],在小鼠中敲除SLC26A3可促进肿瘤的进展。SLC26A3-/-小鼠在症状上与先天性失氯性腹泻而导致的腹泻类似,这与SLC26A3的功能缺失相关,但敲除SLC26A3后促进了结肠隐窝上皮细胞的增殖。尽管机制尚不清楚,但研究表明SLC26A3在结肠癌发展中存在着潜在作用。虽然SLC26A3集中表达在结直肠组织中并且具有重要的生理和病理生理学意义,但是本研究并未发现其对于结直肠腺癌的肿瘤分期和病人对于提示病人预后具有显著意义。SLC26A3可能通过影响肠癌细胞增殖、细胞周期和DNA损伤修复发挥抑癌作用的机制也有待后续分子生物学实验进一步证实。在40个月生存患者中SLC26A3高表达率较高,提示,SLC26A3可能是一个改善患者生存的保护性因素。
既往研究表明磷酯酰肌醇-3激酶(phosphoinosotode 3-kinase),PI3K)/蛋白激酶B(protein kinase,PKB/AKT)信号通路具有调节细胞生长、代谢、凋亡、癌症等广泛的生物学作用[12]。结肠癌的发生发展与PI3K/AKT信号通路密切相关,抑制该通路可能是目前治疗结肠癌的一种方法[8,13]。而与此同时,已有研究证实通过PI3K/AKT信号通路可提高细胞顶端膜SLC26A3的蛋白表达和Cl-/OH-离子交换活性[14-15],这其中,PI3K/AKT信号通路对SLC26A3的功能与SLC26A3在结直肠腺癌中的低表达似乎存在理论上的不一致。为此本研究进行的相关的实验研究,并首次发现,激活PI3K后,SLC26A3蛋白表达量先随着PI3K信号通路激动剂浓度的增加而升高,此结果与既往研究结果相同,但当PI3K信号通路激动剂浓度持续增加,即PI3K信号通路持续过度激活后,SLC26A3蛋白表达量呈下降趋势,提示PI3K/AKT通路对SLC26A3的蛋白表达发挥着双向作用。这一研究结果可为PI3K/AKT信号通路抑制剂在结直肠癌治疗中的合理使用提供借鉴。
通过对SLC26A3在结直肠癌中的数据库信息挖掘及细胞学实验,我们推测SLC26A3可能会影响结肠癌患者的远期生存率,且SLC26A3的表达改变可能与结直肠患者的排便习惯改变这一临床特征有关,并发现PI3K/AKT通路对SLC26A3的表达调控可能发挥着双向调节的作用。本研究结果为利用PI3K/AKT信号通路来减轻结直肠癌患者的临床症状和改善其远期预后提供了初步的实验数据。

