血管生成素样蛋白3与2型糖尿病及其并发症的相关性研究进展
张扬,胡雪剑,任建功
(兰州大学第二医院内分泌与代谢病科,兰州 730030)
随着肥胖儿童人数的增加,儿童和青少年的糖代谢异常(包括空腹血糖受损、糖耐量受损和糖尿病)逐渐增多[1]。青年人群因超重肥胖引发的2型糖尿病(type 2 diabetes mellitus,T2DM)越来越常见,我国新诊断的糖尿病中早发型T2DM(年龄30~43岁)约占1/5,三酰甘油、胰岛素抵抗指数水平较高与早发型T2DM诊断独立相关[2]。与晚发型T2DM相比,早发型T2DM更早出现微血管和大血管并发症(提前13~20年)[3],糖尿病并发症的年轻化趋势引起人们的广泛关注。T2DM不再是老年性疾病,其所致的体内长期代谢紊乱状态被认为是许多疾病的独立危险因素,我国的T2DM及其并发症的发生风险较高,心血管疾病、视力丧失、肾衰竭和截肢等糖尿病慢性并发症严重威胁患者生命。
目前关于T2DM的发病机制仍不明确,尽管糖代谢异常定义并解释了糖尿病及其症状和并发症,但对T2DM发病机制的理解越来越集中于脂质代谢紊乱。血管生成素样蛋白(angiopoietin-like protein,ANGPTL)3被认为在调节脂质代谢中有显著作用,近来发现ANGPTL3有多重生物学功能,在糖尿病、动脉粥样硬化、造血干细胞增殖、癌细胞侵袭、肝纤维化和风湿性疾病等的发生发展中发挥作用[4]。现就ANGPTL3与T2DM及其并发症的相关性研究进展予以综述,以探讨ANGPTL3在T2DM治疗中的意义。
1 ANGPTL3的结构与作用
1.1ANGPTL3的结构 ANGPTL家族在结构上与血管生成素相似,其家族成员包括ANGPTL1~8,各家族成员具有相似的结构与功能。人ANGPTL3位于1p31区,包含460个氨基酸,是一种肝特异性分泌蛋白[5],在病变视网膜及肾组织也有表达。其结构包含1个N端螺旋结构域(coiled-coil domain,CCD)、连接域和1个C端纤维蛋白原样结构域(fibrinogen like domain,FLD)。CCD内的16~210氨基酸特别是32~55氨基酸结构域是脂蛋白酶(lipoprotein lipase,LPL)参与脂代谢调节的特异性位点,FLD的237~460氨基酸与整合素αVβ3受体结合调节血管生成[6]。肝脏前蛋白转化酶、ANGPTL8作用于连接域的221~222氨基酸和224~225氨基酸位点,使ANGPTL3裂解释放CCD和FLD,这种裂解对体内ANGPTL3的激活起重要作用[7]。见图1。
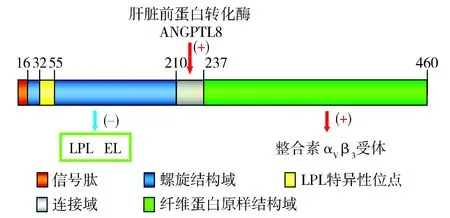
ANGPTL:血管生成素样蛋白;LPL:脂蛋白酶;EL:内皮脂肪酶
1.2ANGPTL3在脂质代谢调节中的作用 ANGPTL3可通过多种作用机制调节各类脂蛋白代谢,被视为人类脂蛋白代谢的关键调节因子,尤其是对三酰甘油和高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)的调节。研究普遍认为ANGPTL3裂解产生的CCD可抑制LPL的活性,LPL可附着于血管内皮细胞表面并催化乳糜微粒和极低密度脂蛋白中的三酰甘油水解,去除三酰甘油后乳糜微粒和极低密度脂蛋白残体可通过特定的肝脏受体清除,高ANGPTL3循环可引起富含三酰甘油的脂蛋白水平升高[7]。ANGPTL3还可通过其CCD的肝因子结合位点抑制内皮脂肪酶的活性来调节HDL-C,内皮脂肪酶可通过其磷脂酶活性水解HDL-C颗粒中的磷脂酰胆碱的Sn-1酯键,通过释放溶血磷脂酰胆碱降低HDL-C[8]。另外,在调节低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)时,ANGPTL3不仅依赖脂蛋白酶的作用,其表达缺失可降低LDL-C中载脂蛋白B-100的分泌、增加肝脏及氧化组织LDL-C受体的表达,通过增加LDL-C摄取降低LDL-C水平[9]。
1.3ANGPTL3在糖代谢调节中的作用 ANGPTL3与胰岛素敏感性密切相关,并可进一步影响糖代谢调节。高糖饮食可诱导ANGPTL3的表达,经1~3个月高糖喂养恒河猴的血浆ANGPTL3水平增加30%~40%[10]。研究认为,ANGPTL3启动子区域存在肝X受体α作用位点,高糖可能通过增加人肝细胞的脂质含量激活肝X受体α,进而引起ANGPTL3基因转录和表达[11]。胰岛素是体内调节糖代谢的主要因子,胰岛素信号可直接对ANGPTL3表达产生抑制作用[12]。临床研究发现,血浆ANGPTL3水平与胰岛素水平及胰岛素抵抗指数呈正相关[13],故推测ANGPTL3有影响胰岛素敏感性的作用。ANGPTL3可直接与脂肪细胞表面结合并触发游离脂肪酸释放,游离脂肪酸水平过高会导致骨骼肌对胰岛素产生抵抗作用[14]。而ANGPTL3的缺失与胰岛素敏感性增强有关[15]。研究发现,ANGPTL3可促进极低密度脂蛋白-三酰甘油在进食状态小鼠的白色脂肪组织中沉积,而不沉积于氧化组织(骨骼肌、心脏褐色脂肪等组织),在未进食情况下,ANGPTL3缺失小鼠的肝脏、脂肪组织、心脏的脂肪含量并未减少,但葡萄糖摄取量却增加10倍,故认为ANGPTL3失活时白色脂肪组织代偿性摄取葡萄糖,以供应脂肪生成所需热量,从而增加胰岛素敏感性[16]。
2 ANGPTL3与T2DM
T2DM往往与胰岛素分泌及作用缺陷有关,这种缺陷可能与T2DM患者体内代谢紊乱、低度炎症状态、肠道菌群结构和功能异常等密切相关。而ANGPTL3与脂质代谢、胰岛素敏感性密切相关,且普遍认为T2DM人群的血浆ANGPTL3水平升高[17]。ANGPTL3可能通过以下机制促进T2DM进展:①循环ANGPTL3水平升高可抑制脂肪酶活性,减少脂质水解,从而升高血脂,高脂血症和胰岛素抵抗之间的联系被广泛认可,二酰甘油和神经酰胺被认为是脂质诱导胰岛素抵抗的介质,高脂血症时,二酰甘油和神经酰胺含量增高,激活新型蛋白激酶C、蛋白磷酸酶2A及下游信号传导通路来损伤肌肉对胰岛素敏感性引起糖耐量异常[18]。T2DM往往伴随肥胖,下丘脑作为能量代谢中枢参与调节与肥胖密切相关的摄食行为。ANGPTL3也可通过下丘脑脂质维持能量平衡,不同于外周ANGPTL3对LPL的抑制作用,下丘脑中的ANGPTL3可激活LPL活性,引起下丘脑神经元对脂质的摄取增加,下丘脑发出的能量过剩信号导致小鼠摄食减少、体重减轻,这种调节与厌食和肥胖密切相关[19]。②低度炎症状态已成为T2DM病因学的一个突出因素,流行病学研究表明,C反应蛋白、白细胞介素等炎症因子是T2DM的重要预测因子[20],且循环ANGPTL3与炎症独立正相关[21],ANGPTL3可能通过作用于整合素αVβ3促进炎症信号引起各类靶器官损害。③肠道微生物群调节葡萄糖的作用与T2DM和肥胖有关,ANGPTL4可通过调节肠道细菌影响葡萄糖耐量,与野生小鼠相比,缺乏ANGPTL4小鼠的糖耐量有所改善,但当肠道菌群被抗生素抑制后,上述葡萄糖耐量的改善被消除[22]。ANTPTL3与ANGPTL4有高度同源性,故推测ANGPTL3可能与肠道菌群相互作用并影响血糖,仍需进一步探索。综上所述,ANGPTL3可能通过诱导高脂血症、调节摄食行为、激活炎症信号、调节肠道菌群等作用机制参与T2DM的发生发展。
3 ANGPTL3与T2DM并发症
3.1ANGPTL3在糖尿病视网膜病变(diabetic retinopathy,DR)中的作用 DR作为成人失明的主要原因之一,其进行性加重常常与糖尿病病程、血脂异常、高血压、肥胖等因素相关。ANGPTL3可能通过以下作用促进DR进展:①高脂血症与DR呈正相关,尤其在硬性渗出和糖尿病性黄斑水肿中,其机制可能为脂蛋白通过引起系膜细胞增殖、上调内皮素、减少内皮细胞数量和减少一氧化氮等方式影响血管活性来调节DR的发展[23]。②高糖可刺激人视网膜微血管内皮细胞中ANGPTL3的表达[24],DR患者血清ANGPTL3和血管内皮生长因子水平较健康人群升高,且其表达水平随视网膜病变的严重程度的增加而升高[25]。高糖刺激或ANGPTL3过表达后,糖尿病大鼠视网膜上的炎症因子和凋亡因子的表达水平也相应升高,用靶向ANGPTL3的干扰小RNA降低糖尿病大鼠ANGPTL3的表达后,上述因子的表达均较前降低,故推测ANGPTL3可能通过刺激炎症因子和凋亡因子的表达促进DR进展。③整合素是由α和β亚单位独特组合的膜蛋白,通过调节内皮细胞的黏附、迁移、增殖、凋亡等方式参与炎症介导的癌症微血管形成[26]。ANGPTL3与整合素αVβ3受体结合可刺激蛋白激酶B磷酸化,上调内皮祖细胞miR-126的表达,从而促进视网膜内皮祖细胞的促血管生成能力,导致视网膜新生血管形成,抑制整合素αVβ3受体后,ANGPTL3的血管生成作用被阻断[27]。综上,ANGPTL3可能通过诱导高脂血症、刺激炎症因子和凋亡因子以及促进新生血管形成等作用促进DR进展。
3.2ANGPTL3在糖尿病肾病中的作用 糖尿病肾病的发生与T2DM病程关系尚不确切,在新诊断T2DM时就可出现,大多以微量白蛋白尿为早期临床表现,随着尿蛋白逐渐增多而出现血清肌酐升高,最终进展为肾衰竭[28]。ANGPTL3可能通过以下作用损伤肾小球并促进糖尿病肾病进展:①高脂血症可导致肾小球硬化和肾小管间质纤维化,高甘油三酯血症和高胆固醇血症可导致大鼠足细胞损伤和肾小球局灶节段性硬化,LDL-C被系膜细胞氧化后可刺激促炎因子、促纤维化细胞因子和血管活性物质释放,引起肾单位结构功能改变[29],故推测ANGPTL3通过诱导高脂血症在糖尿病肾病中发挥致病作用。此外,ANGPTL4亦被认为是诱导糖尿病肾病的潜在作用因子,与单纯T2DM患者相比,糖尿病肾病患者的ANGPTL4水平显著升高,且ANGPTL4与白蛋白/肌酐比值和血清肌酐呈正相关,可见糖尿病肾病中ANGPTL4的致病作用可能与其抑制LPL活性的作用有关[30]。②原发性肾病综合征以大量蛋白尿为特征,原发性肾病综合征患儿肾小球和肾小管中ANGPTL3的表达程度不同,微小病变肾病综合征(以足细胞损害突出的病理类型)患儿肾脏中ANGPTL3的表达显著增加,并与其蛋白尿程度呈正相关[31]。ANGPTL3可通过损伤足细胞参与蛋白尿的生成,其机制可能为ANGPTL3的FLD结合并激活整合素αVβ3及下游黏附斑激酶/磷脂酰肌醇-3-激酶信号通路,诱发足细胞肌动蛋白重排,使足细胞之间的宽度增加,促进尿蛋白形成[32]。胰岛素样生长因子1可用于预测早期糖尿病肾病,其通过与整合素αvβ3和纤维连接蛋白相互作用诱导系膜细胞迁移,引起糖尿病肾病的病理改变[33],故推测ANGPTL3的FLD端结合并激活整合素αVβ3诱导系膜细胞迁移,参与糖尿病肾病病理改变。总之,ANGPTL3可通过以上多种作用机制引起足细胞损伤、系膜细胞迁移、肾小球纤维化等病理变化,诱导糖尿病肾病发生发展。
3.3ANGPTL3在糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)中的作用 DPN作为神经退行性病变常因累及周围感觉运动神经和自主神经而出现不同的临床差异性表现,严重时可引起无痛性心肌梗死、糖尿病足溃疡、坏疽,甚至导致截肢[28]。ANGPTL3可能与DPN发病相关的作用机制为:①高脂血症在糖尿病前期就开始诱导神经髓鞘脂质的缺失,这种神经的破坏作用早于高糖血症、高胰岛素血症或胰岛素抵抗所诱发的神经病变[34]。研究显示,神经元中胆固醇氧化为氧化甾醇可介导组织损伤,LDL被活性氧类氧化后与氧化低密度脂蛋白受体1、Toll样受体4等结合,激活一系列信号级联反应,引起炎症和活性氧类积累;高脂血症还可通过β氧化生成过量游离脂肪酸,引发全身和局部炎症[35],高脂血症通过上述多重作用损伤施万细胞及外周神经系统,参与DPN的发生与发展。②骨桥蛋白通过与细胞表面受体αVβ3结合,通过蛋白激酶Cα信号转导通路促进神经前体细胞、小胶质细胞、施万细胞的增殖并抑制其凋亡,从而起保护性作用[36]。目前尚缺乏ANGPTL3与DPN相关性的临床研究,ANGPTL3是否通过引起高脂血症、胰岛素抵抗和激活骨桥蛋白-αVβ3-蛋白激酶Cα信号通路参与DPN进展还需要进一步研究的证实。
3.4ANGPTL3在糖尿病大血管病变中的作用 T2DM患者往往存在动脉粥样硬化性大血管病变,如颈股动脉粥样硬化、冠心病、脑卒中等糖尿病慢性并发症。研究发现,血浆ANGPTL3与颈动脉和股动脉内膜-中膜厚度、冠状动脉狭窄程度呈正相关[37-38],且高水平ANGPTL3与急性心肌梗死、缺血性脑梗死的风险密切相关,被认为是发生心血管事件的独立危险因素[39]。ANGPTL3通过脂质和非脂质作用促进动脉粥样硬化,在脂质作用方面,富含三酰甘油的脂蛋白生成的残余脂蛋白颗粒更易致动脉粥样硬化,而残余脂蛋白颗粒水平往往与体质指数、空腹血糖水平、糖化血红蛋白水平呈正相关[40],因此高残余脂蛋白颗粒水平更易损伤T2DM患者的血管内皮细胞;且ANGPTL3高表达抑制LPL激活,引起富含三酰甘油的脂蛋白和残余脂蛋白颗粒的清除减少,进而促进动脉粥样硬化[41]。在非脂质作用方面,ANGPTL3的FLD激活整合素αVβ3,αVβ3的一些配体(如骨桥蛋白)可以刺激平滑肌细胞向血管内膜迁移并聚集,巨噬细胞表达αVβ3可抑制清除受体A和CD36的表达,从而导致泡沫细胞形成。ANGPTL3通过αVβ3介导的炎症、泡沫细胞和新生斑块形成的作用,促进动脉粥样硬化斑块进展[42]。综上,ANGPTL3通过诱导高脂血症、促进炎症、介导泡沫细胞形成等方式引起T2DM患者的大血管病变。
4 抗ANGPTL3治疗
一项前瞻性队列研究发现,携带ANGPTL3基因单核苷酸多态性中rs11207997基因人群的糖尿病患病风险降低,可能与血清总胆固醇和三酰甘油水平长期降低有关[43]。研究表明,ANGPTL3水平降低可以改善胰岛素敏感性,Vupanorsen是一种反义寡核苷酸类药物,通过与肝ANGPTL3信使RNA片段结合而灭活,以降低循环ANGPTL3水平,用反义寡核苷酸类药物治疗肥胖小鼠的腹膜葡萄糖及胰岛素水平均较未治疗肥胖小鼠降低[44]。虽然反义寡核苷酸类药物可显著降低T2DM患者的ANGPTL3及脂蛋白的水平[45],但治疗后6个月的血糖参数变化不明显,可能与ANGPTL3没有完全灭活或观察周期有限有关。通过降低ANGPTL3水平改善高糖血症及炎症状态仍有待进一步研究,这可能与T2DM的长期获益有关。
单克隆抗体类药物Evinacumab能特异性阻断或干扰循环ANGPTL3的活性[46],注射分子靶向药Evinacumab和Vupanorsen后,可剂量依赖性地降低血脂异常健康志愿者的三酰甘油和胆固醇水平,认为ANGPTL3可作为治疗混合型高脂血症的潜在靶点。除明显的降脂作用外,Evinacumab和Vupanorsen均能缩小动脉斑块的面积、延缓动脉粥样硬化进展、降低心血管疾病的发生率。在糖尿病肾病方面,Dai等[47]认为,ANGPTL3基因敲除可通过挽救足细胞解离和凋亡来减轻足细胞的丢失,有效延缓肾小球硬化的形成。现已有抗血管内皮生长因子药物用于DR的临床治疗[48],鉴于ANGPTL3与血管内皮生长因子都具有促血管形成作用,推测ANGPTL3将成为治疗糖尿病肾病和DR的新靶点。
5 小结与展望
ANGPTL3与T2DM及并发症的发生发展密切相关,T2DM患者的高血糖、高血脂状态刺激循环ANGPTL3水平升高,进而引起体内能量代谢紊乱及胰岛素抵抗加重,并激活炎症通路损伤各靶器官,该恶性循环通过脂质与非脂质作用促进糖尿病及血管并发症的恶化,因此抗ANGPTL3治疗对于糖尿病治疗具有多重获益。抗ANGPTL3治疗具有明显的降脂、心血管保护作用,但降糖及改善胰岛素敏感性的作用相对不明显,还仍需进一步长期实验观察。另外,由于糖尿病肾病、DR等并发症的发病机制较复杂,T2DM患者抗ANGPTL3治疗的获益仍需进一步探索。靶向药物Vupanorsen和Evinacumab治疗T2DM具有高效、方便、不良反应小等特点。因此,抗ANGPTL3治疗将为临床T2DM代谢紊乱及并发症的治疗带来新思路。

