离子色谱法测定硫酸阿米卡星注射剂中抗氧剂和硫酸盐的含量
袁力,梅芊,刘英(河南省食品药品检验所,郑州 450018)
阿米卡星(amikacin)又称丁胺卡那霉素,属于半合成氨基糖苷类抗菌药物。由Hamao Umezawa于1957年发现,1972年由日本Bristol-Banyu 公司合成制得[1],1981年开始在国内生产[2-3]。
硫酸阿米卡星和硫酸阿米卡星注射液均收载于《中国药典》2020年版[4]、美国药典USP43[5]、英国药典BP2020[6-7]、欧洲药典EP10.0[8]与日本药典JP17[9],注射用硫酸阿米卡星收载于《中国药典》2020年版[4]与日本药典JP17[9]。现行版各国药典均未对硫酸阿米卡星注射剂中抗氧剂和硫酸盐的含量进行检查与控制,仅美国药典会编组起草的亚硫酸氢钠质量标准草案中采用离子色谱法对硫酸根离子、其他单杂及总杂进行了考察[10]。阿米卡星分子中含有多个氨基与羟基,易被氧化,在制剂生产过程中除需充氮灌装外,还需加入抗氧剂进行保护。《中国药典》2020年版规定[11]配制注射剂时,可根据需要加入适宜的附加剂,常用的抗氧剂有亚硫酸钠、亚硫酸氢钠和焦亚硫酸钠等。由于该类抗氧剂可诱发接触性皮炎、抑制尿激酶纤溶蛋白活性及转氨酶升高等不良反应[12],因此有必要对硫酸阿米卡星注射剂中抗氧剂的加入量进行考察。另外,通过对比发现,国内外质量标准对硫酸阿米卡星分子式中硫酸个数n的规定不同:《中国药典》2020年版为1.8[4],USP43[5]、BP2020[6]、EP10.0[8]和JP17[9]为2, 故有必要对国内硫酸阿米卡星注射剂中硫酸根离子含量进行检测,进而计算出硫酸摩尔数,并与原研制剂相比较,探讨硫酸盐个数的合理性。
1 仪器与试药
1.1 仪器
Dionex ICS-5000+离子色谱仪(美国赛默飞世尔科技有限公司),XPE205电子天平[梅特勒-托利多仪器(上海)有限公司],Milli-Q 去离子水发生装置(美国Millipore 公司)。
1.2 试药
焦亚硫酸钠(批号:SLCB1169,纯度≥99%)、无水亚硫酸钠(批号:MKCL1969,纯度≥98.0%)、亚硫酸氢钠(批号:MKCF8714,以SO2计,纯度≥58.5%)、无水硫酸钠(批号:SLCF5860,纯度≥99.0%)(Sigma-Aldrich);40%乙醛(天津市大茂化学试剂厂,批号:20191116),经标定的硫酸滴定液(0.051 21 mol·L-1)。
1.3 样品
2020年国家药品评价性抽验代表性样品:77批次硫酸阿米卡星注射液,涉及28 个生产企业,规格均为2 mL/0.2 g(20 万单位);10 批次注射用硫酸阿米卡星,涉及4 个生产企业,规格均为0.2 g/支(20 万单位)。
调研收集硫酸阿米卡星原料8 批次,涉及3个生产企业。
原研制剂:硫酸阿米卡星注射液(日医工株式会社,规格为2 mL/200 mg,批号:220800),注射用硫酸阿米卡星(日医工株式会社,规格:200 mg/支,批号:221000)。
2 方法与结果
2.1 色谱条件
色谱柱:Dionex IonPac AS11-HC(4 mm×250 mm,9 μm)和预柱Dionex IonPac AG11-HC(4 mm×50 mm,13 μm),抑制器:Dionex ADRS 600(4 mm),抑制电流:179 mA,电导检测器,流速:1.2 mL·min-1,进样量:25 μL,柱温:30℃,检测器温度:35℃,抑制器温度:25℃,淋洗液:氢氧化钾溶液,采用表1的程序进行梯度洗脱。

表1 梯度洗脱程序Tab 1 Gradient elution
2.2 溶液的配制
2.2.1 稀释剂(空白溶剂) 量取40%乙醛溶液2 mL,置1000 mL 量瓶中,加水稀释至刻度,摇匀,即得。
2.2.2 空白辅料溶液 综合各企业提供的制剂处方比例,除不加入焦亚硫酸钠、亚硫酸氢钠与无水亚硫酸钠外,分别称取辅料适量,用稀释剂溶解制得。
2.2.3 系统适用性溶液 称取亚硫酸氢钠和无水硫酸钠适量,置100 mL 量瓶中,用稀释剂溶解并定容至刻度,摇匀,即得。
2.2.4 供试品溶液 精密称取硫酸阿米卡星原料、注射用硫酸阿米卡星,量取硫酸阿米卡星注射液适量,分别用稀释剂稀释制成约含阿米卡星0.5 mg·mL-1的溶液。
2.2.5 对照品储备液 精密称取焦亚硫酸钠、亚硫酸氢钠与无水亚硫酸钠各适量,分别用稀释剂溶解并制成约0.18 mg·mL-1的溶液,作为各抗氧剂的对照品储备液;4.9203 mg·mL-1的硫酸滴定液(以SO42-计)作为硫酸盐的对照品储备液。
2.3 专属性
取“2.2”项下各溶液按“2.1”项下条件测定,结果空白辅料和稀释剂均不干扰抗氧剂及硫酸根的测定,亚硫酸根与硫酸根分离度为2.2,分离良好,典型离子色谱图见图1。

图1 阿米卡星典型离子色谱图Fig 1 Typical ion chromatogram of amikacin
2.4 线性关系与检测限、定量限
精密量取“2.2.5”项下各对照品储备液适量,分别加稀释剂制成系列对照品溶液进样,以峰面积对分析物质量浓度用最小二乘法进行线性回归。结果表明,各分析物在其线性范围内与峰面积线性关系均良好。取上述各系列对照品溶液用稀释剂分别逐级稀释,进样25 μL,以信噪比(S/N)为10∶1 时的浓度作为定量限,S/N为3∶1时的浓度作为检测限。结果见表2。
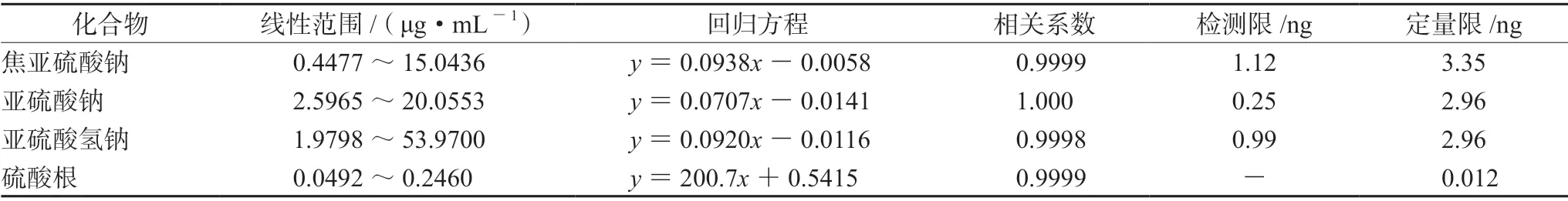
表2 阿米卡星线性关系、检测限和定量限Tab 2 Regression equation and the limit of detection and quantitation of amikacin
2.5 精密度试验
2.5.1 进样精密度 取质量浓度约9 μg·mL-1的3 种抗氧剂和质量浓度约0.16 mg·mL-1的硫酸根对照品溶液,分别连续进样6 次,记录峰面积,结果焦亚硫酸钠、亚硫酸钠、亚硫酸氢钠、硫酸根峰面积的RSD分别为0.97%、0.70%、1.2%、0.15%,表明方法的精密度良好。
2.5.2 重复性 取同一批号硫酸阿米卡星注射液6 支,精密量取适量,用稀释剂稀释,制成约含阿米卡星0.5 mg·mL-1的溶液;取同一批号注射用硫酸阿米卡星6 瓶,各精密称取适量,用稀释剂稀释成约含阿米卡星0.5 mg·mL-1的溶液。分别进样,测定峰面积,计算含量,结果见表3,表明方法重复性良好。

表3 重复性试验结果(n =6)Tab 3 Repeatability test (n =6)
2.6 回收试验
2.6.1 抗氧剂回收率 综合各企业处方比例,除3 种抗氧剂外,称取硫酸阿米卡星原料和其他辅料,置500 mL 量瓶中,加稀释剂溶解并稀释至刻度,作为回收率底液。分别精密称取焦亚硫酸、无水亚硫酸钠、亚硫酸氢钠,用上述回收率底液溶解并稀释制成高、中、低3 个水平的样品,平行3 份,测定并计算其回收率,结果焦亚硫酸钠的高、中、低浓度的平均回收率为98.0%、99.5%和99.7%,RSD为0.47%、1.3%和1.3%(n=3);亚硫酸钠的高、中、低浓度的平均回收率为101.5%、98.9%和100.3%,RSD为0.46%、0.40%和0.38%(n=3);亚硫酸氢钠的高、中、低浓度的平均回收率为99.3%、98.9%和99.1%,RSD为1.4%、0.55%和1.4%(n=3),表明方法回收率均良好。
2.6.2 硫酸根回收率 综合各企业处方比例,称取硫酸阿米卡星原料和辅料,置25 mL 量瓶中,加稀释剂溶解并稀释至刻度,作为回收率母液。精密量取硫酸滴定液适量,用上述回收率母液稀释制成高、中、低3 个水平的样品,平行3 份,将测得峰面积代入其线性回归方程中,结果高、中、低浓度的平均回收率分别为99.3%、100.7%和99.6%,RSD分别为0.66%、0.17%和0.15%(n=3),表明方法回收率良好。
2.7 溶液稳定性
取“3.3.2”项下溶液,在室温下放置0、2、4、6、8、10、12 h,测定峰面积,结果焦亚硫酸钠、亚硫酸钠、亚硫酸氢钠、硫酸根的峰面积RSD分别为0.90%、1.2%、1.6%和0.40%,表明本方法测定的供试品溶液在室温下放置12 h 稳定。
2.8 样品测定
取“2.2.4”项下供试品溶液进样测定,计算含量。结果样品中焦亚硫酸钠、亚硫酸钠、亚硫酸氢钠、硫酸盐含量分别为0.67 ~8.54 μg·mL-1,2.51 ~18.06 μg·mL-1,2.10 ~26.76 μg·mL-1和0.15 ~0.19 mg·mL-1。
3 讨论
3.1 方法学研究
本研究收集的国产硫酸阿米卡星注射液涉及28 个生产企业,共含有3 种抗氧剂,且不同企业的处方中仅包含其中一种抗氧剂,故方法学研究根据添加抗氧剂的不同,各选择一个企业的样品作为代表性的供试品溶液;国产注射用硫酸阿米卡星涉及4 个生产企业,硫酸阿米卡星原料涉及3 个生产企业,其中“3.3.2”项下表中列举企业4的注射用硫酸阿米卡星属于原料直接分装,且该原料来源于上述3 个原料企业之一,故企业4 的产品既作为原料的代表,又作为制剂的代表,未另外选择原料进行方法学研究。目前,离子色谱法已广泛应用于医药食品行业中,对离子型化合物的测定快速、准确、灵敏[13-14]。本文建立了离子色谱法测定硫酸阿米卡星注射剂中抗氧剂和硫酸盐的含量,与比色法和碘量法相比,操作简便,准确度、灵敏度高,为药品质量标准的完善提供了基础,并能够对企业在生产过程中违规添加抗氧剂进行有效监督。
3.2 稀释剂的选择
亚硫酸氢根、亚硫酸根在水溶液中不稳定,极易氧化为硫酸根[15]。试验发现,亚硫酸根水溶液的峰面积在2 h 内约降低8%,说明需要添加有效且不干扰测定的稳定剂进行保护。文献中多使用甲醛的稀水溶液[16-18],经试验对比,最终选择安全有效的0.08%乙醛(V/V)作为稳定剂。
3.3 硫酸根的检测限
因本实验室的去离子水中含有微量硫酸根离子,无法去除,导致稀释剂中检出硫酸根,浓度约为检测限水平,故“3.2”项下硫酸根的检测限未进行计算。由于样品中硫酸根含量较高,稀释剂中所含的微量硫酸根离子不影响样品的测定。
3.4 系统适用性溶液的选择
综合各企业处方,硫酸阿米卡星注射剂共含有3 种抗氧剂(焦亚硫酸钠、亚硫酸氢钠与无水亚硫酸钠),三者在水溶液中均以亚硫酸根的形式存在,且不同企业的处方中仅包含其中一种抗氧剂。故系统适用性溶液仅选择一种在水溶液中可形成亚硫酸根的化合物与硫酸钠进行制备,以考察SO32-峰与SO42-峰的分离度。
3.5 抗氧剂含量结果分析
抗氧剂对制剂稳定性的保护作用表明其使用的必要性,但出于安全性考虑,《中国药典》2020年版通则规定注射剂中抗氧剂浓度的上限为0.2%(W/V)[11],WHO 亦将焦亚硫酸钠和其他亚硫酸盐的每日可接受摄入量定为7.0 mg·kg-1(以SO2计)[19]。采用建立的方法测得本次收集的硫酸阿米卡星注射剂样品中抗氧剂的含量均低于其处方量,亦低于WHO 的规定,表明产品使用抗氧剂无违规添加现象,但对于该产品中添加抗氧剂合理处方量的评估有待进一步研究,最终达到既能保证制剂的稳定性,又可将抗氧剂的用量降至最低[18],以最大限度地减少其对人体健康所产生的损害。
3.6 硫酸盐个数的合理性
硫酸的个数会影响产品的pH 值,从而可能影响产品的质量。国内外质量标准对硫酸阿米卡星分子式中硫酸个数n的规定不同,采用建立的方法测定硫酸阿米卡星原料和注射用硫酸阿米卡星中的硫酸盐,结果国内原料和制剂中硫酸的个数n为1.8 ~2.1,日本原研制剂中硫酸的个数n为1.7。在pH 值的标准设置方面,《中国药典》2020年版规定应为3.5 ~5.5,属于偏酸性,而日本药典JP17规定应为6.0 ~7.5,略偏中性,故pH 值规定的范围不同导致了中国和日本的硫酸阿米卡星制剂中硫酸的个数差异。一般来说,药品溶液接近中性,临床使用时顺应性更好,刺激性小。另外在试验中发现,硫酸阿米卡星在偏酸性条件下会引起降解杂质的增加。因此,对于硫酸阿米卡星中的硫酸个数的规定合理性、硫酸个数与pH 值相关性以及对产品质量的关联影响均有待进一步深入研究。

