基于网络药理学的福建野鸦椿果三萜抗肝纤维化的药效机制研究
蒋佩佳,洪译,谭洋,周峰,肖锦仁*,裴刚,2*(.湖南中医药大学药学院,长沙 40208;2.湖南省中药饮片标准化与功能工程技术中心,长沙 40208)
肝纤维化(liver fibrosis)是肝脏对各种病因所致慢性肝损伤的过度修复反应,是以胶原为主的细胞外基质(extra cellular matrix,ECM)在肝内的过度沉积,导致的肝脏结构改变和肝功能丧失[1]。据报道,肝纤维化的发病率和病死率在全世界范围内居高不下,并呈逐年增高的趋势[1]。在医学上肝纤维化被认为是可逆性病变,因此,有效控制肝纤维化环节对预防肝硬化及肝癌的发生有重要的意义[2-3]。
福建野鸦椿果(Euscaphis fukienensisHsu.)为省沽油科野鸦椿属福建野鸦椿的成熟果实,在我国南方大部分地区都可采集,主要分布于福建,常作为园林绿化植物大面积种植,资源十分丰富[4]。在我国南方地区,福建野鸦椿果的水提物经常被用来治疗肝炎和肝纤维化[5-6],但是其物质基础和作用机制尚未明确。本课题组前期从福建野鸦椿果中分离得到了多个化合物[3,7],其中齐墩果酸、熊果酸等三萜类成分有大量关于抗肝纤维化的活性报道[8-15],推测三萜可能是其抗肝纤维化的有效成分。因此本实验研究福建野鸦椿果三萜类(EFT)化合物对肝纤维化小鼠的影响。
网络药理学基于系统生物学和经典药理学等多学科理论,提供了一种多角度分析药物干预疾病作用靶点及机制的系统方法[16-17]。故本研究应用网络药理学分析方法,对EFT 抗肝纤维化的药效机制进行分析和预测,为该药物抗肝纤维化药效和机制的研究提供了依据。
1 材料
1.1 仪器
电热恒温鼓风干燥箱(DHG-9030A,上海一恒科技有限公司);超声波清洗器(SB25-12D,宁波心芝科技股份有限公司);旋转蒸发仪(RE-501A)、循环水式真空泵(SHZ-D)(巩义市予华有限责任公司);电子分析天平(AY220,日本SHIMADZU);超级生化分析仪(日本日立);超级化学发光免疫分析仪(美国Thermo)。
1.2 试药
福建野鸦椿果于2016年采集于福建省三明市,经湖南中医药大学药学院中药鉴定教研室周小江教授鉴定为省沽油科野鸦椿属福建野鸦椿的成熟果实。阳离子交换树脂、大孔吸附树脂D101(长沙承禹化工有限公司);有机试剂(EtOH、CHCl3等,AR,天津恒兴试剂有限公司);蒸馏水为自制;血清谷丙转氨酶(ALT)测定试剂盒(批号:C052-a)、谷草转氨酶(AST)测定试剂盒(批号:B014)、白蛋白(ALB)测定试剂盒(批号:C008-a)、总胆红素(TBIL)测定试剂盒(批号:C004-g)(中国长春汇利生物技术有限公司);血清透明质酸(HA)定量评估试剂盒(批号:CSB-E04805h)、层粘连蛋白(LN)定量评估试剂盒(批号:CSB-E04644h)(美国CUSABIO)。
1.3 实验动物
SPF 级昆明小鼠(14.0 ~18.0 g),雌雄各半[湖南斯莱克景达实验动物有限公司,许可证编号:SCXK(湘)2011-0005]。饲养于湖南中医药大学实验动物中心[许可证编号:SYXK(湘)2013-0003]。
1.4 数据库及软件
通用蛋白质数据库UniProt(https://www.uniprot.org/),有机小分子生物活性数据库Pubchem(https://pubchem.ncbi.nlm.nih.gov/),Swiss Target Prediction 数据库(http://www.swisstargetprediction.ch/),治疗靶标数据库TTD(http://bidd.nus.edu.sg/BIDD-Databases/TTD/TTD.asp),HPO 数据库(https://hpo.jax.org/),药物银行数据库DRUGBANK(https://www.drugbank.ca/),在线人类孟德尔遗传数据库OMIM(https://omim.org/),蛋白质互作平台STRING V 11.0(https://string-db.org/),生物学信息注释数据库DAVID V 6.8(https://david.ncifcrf.gov/),网络拓扑属性分析软件Cytoscape 3.7.2(http://cytoscape.org/)。
2 方法
2.1 动物实验方法
2.1.1 EFT 的制备 取干燥福建野鸦椿果1000 g,粉碎,加2000 mL 95%乙醇加热回流提取60 min,提取3 次,合并提取液,回收乙醇,得浓缩液。将浓缩液过大孔树脂D-101 色谱柱(柱体积约2000 mL),水洗后依次用50%和70%乙醇梯度洗脱,收集70%乙醇的洗脱部分,减压回收溶剂,蒸至浸膏,得EFT 14.0 g,于4 ℃保存备用。取适量EFT 溶解,参照杨洁等[18]的方法,利用紫外分光光度计测定EFT 中三萜的含量。
2.1.2 动物造模及给药处理 小鼠适应性喂养1 周后,参照文献方法诱导肝纤维化的生成进行[5-6]。具体操作如下:除空白组外,其余各组小鼠腹腔皮下注射40% 四氯化碳(CCl4)溶液(溶于花生油)0.1 mL/10 g,每5日干预一次,共6周,首次干预剂量加倍。空白组于相同时间点,采用相同给药方式注射等剂量花生油。
造模结束后,空白组和模型组中的小鼠按照体重,每日灌胃生理盐水0.1 mL·10 g-1。阳性组每日灌胃秋水仙碱0.1 mg·kg-1。EFT 组每日灌胃EFT 5.12 mg·10 g-1。每只小鼠的给药体积为0.2 mL/10 g,共给药6 周。最后一次给药后,各组小鼠禁食不禁水24 h,眼眶取血分离血清,用于肝功能指标和纤维化因子的检测。取血后将小鼠颈部脱臼处死,沿腹部正中线剪开小鼠腹部,取出肝脏,用于病理切片的检测。
2.1.3 肝组织病理学观察 肝组织经10%甲醛固定,蜡块包埋,切成4 μm 厚的切片,HE 染色,100 倍光学显微镜下DMR +Q550 图像分析仪观察肝纤维化形成情况。
2.1.4 肝功能及纤维化生化指标的检测 在室温下凝结20 min 后,将血液离心10 min(3000 r·min-1),并收集上清液。检测ALT、AST、ALB 和TBIL 水平。用ELISA 法检测血清HA 和LN。将含有40 μL 稀释剂的10 μL 样品添加到平板中,振动30 s,37℃孵育30 min,用洗液洗涤5 次,添加100 μL 酶标记液,重复孵育和洗涤操作,添加发光底物,并按说明书通过超级化学发光免疫分析仪进行检测。
2.1.5 统计分析方法 实验数据以均数±标准差(±s)表示,采用SPSS 19.0 软件处理数据,各项指标多组间比较采用单因素方差分析(One-way ANOVA)并继以最小显著差(LSD-t)检验比较组间差异,以P<0.05 为差异具有统计学意义。
2.2 网络药理学方法
2.2.1 药物和疾病靶点的筛选 查阅野鸦椿属相关文献[7],以目前福建野鸦椿果中分离并鉴定结构的三萜化合物为对象,在Pubchem 数据库中获取这些成分的SMILE 式。将三萜活性成分的SMILE 式输入SWISS 数据库中获取其作用靶点,并将靶点数据进行去重整合[16-17,19]。经过去重整合后,将靶点名称输入UniProt 数据库,获得其相应靶点的人源的靶点基因名称及其ID。在HPO、DRUGBANK、OMIM 数据库中,以“liver fibrosis”和“hepatic fibrosis”为关键词对肝纤维化相关靶点进行检索[20]。
2.2.2 交互网络的构建和分析 将EFT 成分、药物靶点、疾病靶点输入STRING 数据库,选定物种为人,进行蛋白互作分析。将蛋白互作分析结果(tsv 格式)导入Cytoscape 3.7.2 绘制相互作用网络,运用软件自带的Tools 分析功能,分析得到度值(degree centrality,DC)、介度中心性(betweenness centrality,BC)、接近中心性(closeness centrality,CC),将DC ≥2 倍中位数、BC和CC ≥1 倍中位数的靶点作为重要靶点[19,21]。
2.2.3 生物过程与通路分析 在DAVID 数据库中输入“2.2.2”项所得的重要靶点,选定物种为人,进行基因本体论(GO)分析和KEGG 通路富集分析[20,22]。设定阈值P<0.05,收集P值前列的生物过程和通路,通过GraphPadPrism8.0软件进行绘图后,然后进行解析说明[21]。
3 结果
3.1 EFT 对小鼠肝纤维化的影响
经检测,EFT 含量为(98.15±1.30)%。如表1所示,与空白组相比,模型组小鼠的血清ALT、AST、TBIL 显著升高,ALB 显著降低,说明CCl4导致了肝功能的损伤。同时,血清中的纤维化因子HA 和LN 含量均显著升高,表明模型组小鼠组织中出现了纤维化改变。肝组织病理变化如图1,空白组可见正常的肝组织结构,肝细胞排列整齐规则。模型组肝细胞高或中度浊肿变性,形成大小不等椭圆形肝细胞结缔组织构成假小叶,结节周围纤维组织沉积增生,显示出明显的纤维化特征,表明造模成功。
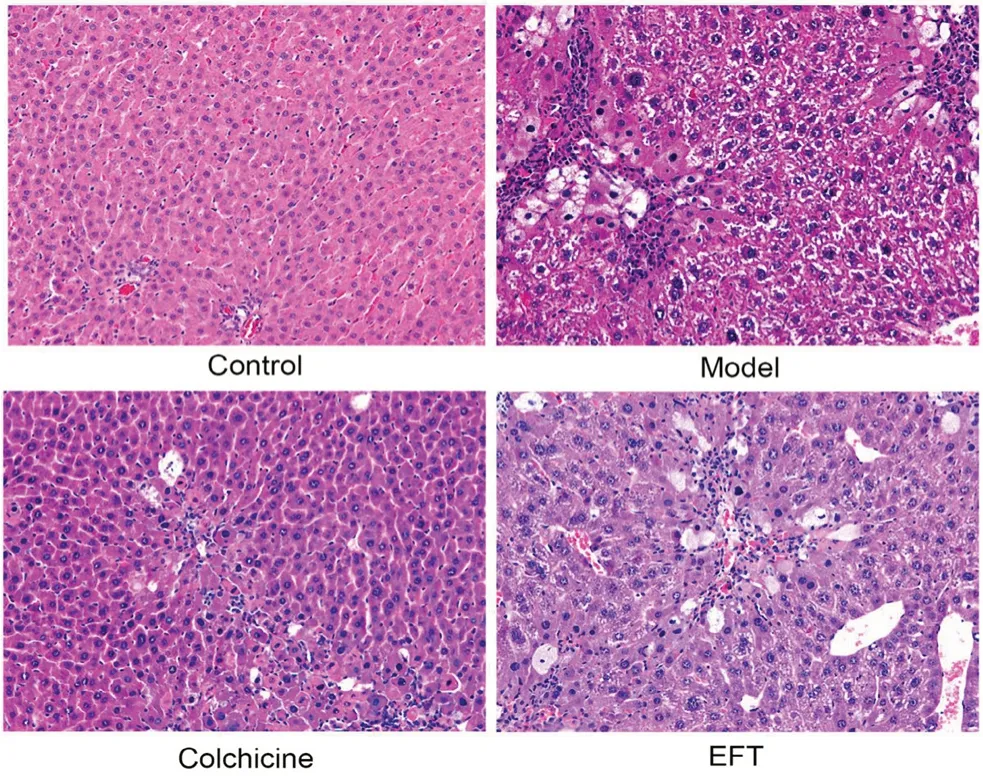
图1 HE 染色显示肝组织炎症情况(100×)Fig 1 HE stain for liver tissue inflammation(100×)

表1 EFT 对肝纤维化小鼠血清ALT,AST,ALB,TBIL,HA 及LN 的影响(Mean±SEM)Tab 1 Effect of EFT on serum ALT,AST,ALB,TBIL,HA and LN levels (Mean±SEM)
与模型组相比,阳性对照组血清中的肝功能和纤维化因子指标均明显改善;同时,肝脏病变减轻,肝小叶结构基本完整,仅有少量肝细胞轻度浊肿,纤维间隔变窄,脂肪空泡的形成明显降低。与模型组相比,EFT 组血清中的肝功能和纤维化因子指标均明显改善;从病理切片结果可知,与阳性对照组类似,经过EFT 干预后,小鼠肝脏的病变减轻,肝小叶结构基本保持完整,纤维间隔明显减少,脂肪空泡也有一定程度减少,这表明EFT 对CCl4所诱导的小鼠肝纤维化模型有良好的干预作用。
3.2 EFT 靶点和肝纤维化相关靶点的预测
福建野鸦椿果中的21 个三萜类化学成分如表2所示,共得到140 个化合物作用靶点,肝纤维化疾病相关靶点96 个。将以上获得的靶点用来构建“成分-靶点-疾病”网络[23]。

表2 EFT 编号与化合物名称对照表Tab 2 Number and compound name of EFT
3.3 EFT 活性成分-作用靶点网络构建
使用Cytoscape 3.7.2 软件构建福建野鸦椿果三萜类成分-作用靶点网络图,如图2所示,共有161 个节点,1413 条边,其中黄色代表活性成分,绿色代表作用靶点[24]。从图中可以明显看出:每个EFT 成分均可作用于多个靶点,每个作用靶点同时与多个活性成分相关;从而体现出EFT 类活性成分在发挥治疗作用的网络关系特点,并且不同成分可通过相同靶点加强治疗作用[25]。
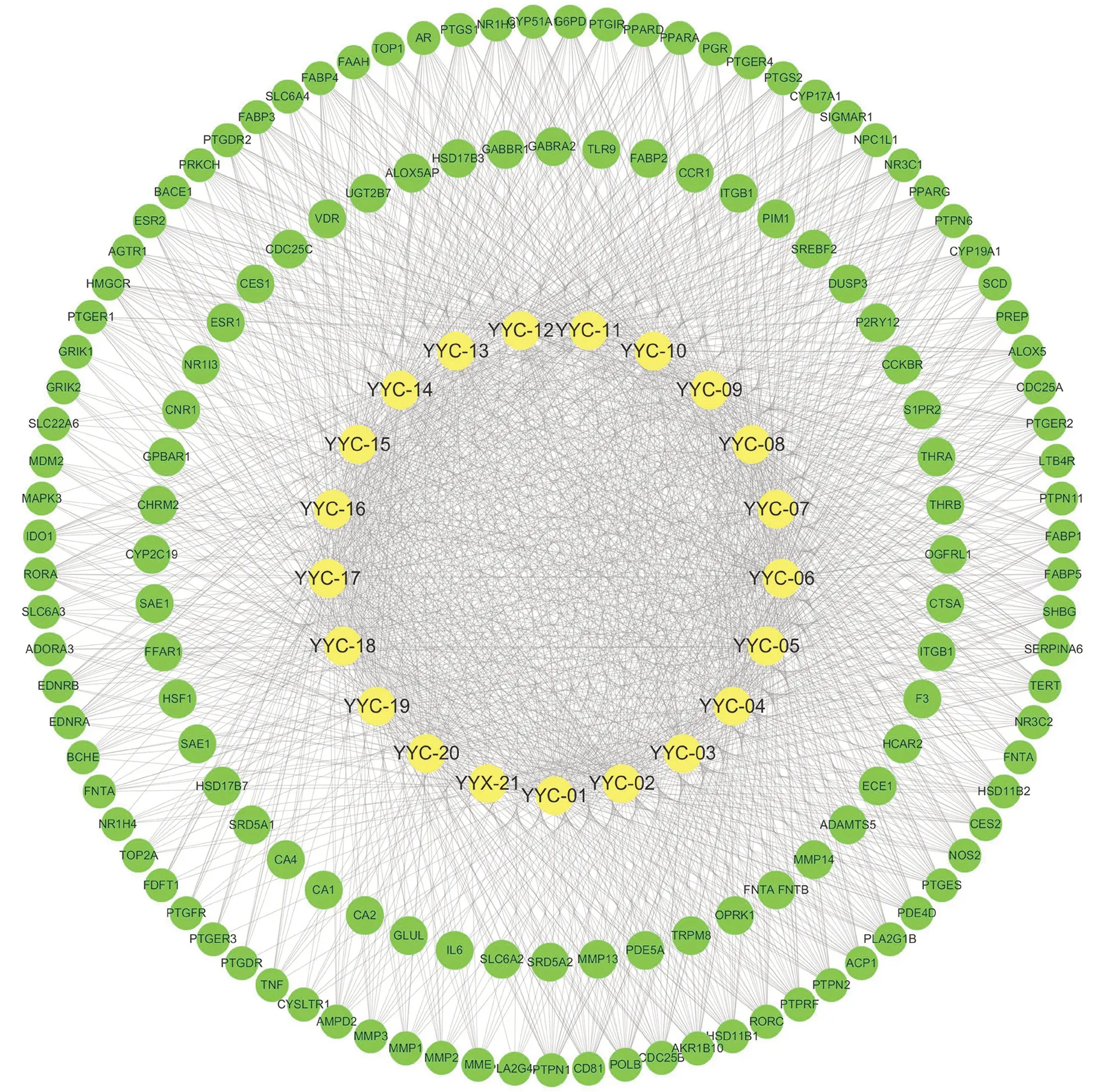
图2 EFT 活性成分-作用靶点网络图Fig 2 “Compound-target” network diagram of EFT
3.4 EFT 活性成分-靶点-肝纤维化网络构建
通过计算每个蛋白的拓扑性质寻找福建野鸦椿果治疗肝纤维化作用的关键靶点,最后获得33个主要节点,绘制其互作图[26]。图3中黄色代表EFT 类有效成分,绿色代表药物靶点,蓝色代表疾病靶点,红色代表共同靶点,连线表示靶点之间的相关性[16,21,25]。

图3 EFT 抗肝纤维化的成分-靶点-疾病交互网络Fig 3 “Compound-target-disease” network diagram of EFT against liver fibrosis
3.5 生物过程与通路分析
从生物过程(biological progress,BP)分析中可以看出与靶点相关的生物过程(见图4),涉及DNA 模板转录、RNA 聚合酶Ⅱ对转录的正调节作用、细胞对缺氧的反应、葡萄糖稳态、凋亡过程负调控、细胞对过氧化氢的反应、I-κB 激酶/NF-κB 信号转导的负调控、内皮细胞增殖的正调控、Smad 蛋白信号转导、炎症反应负调节等生物过程。
从分子功能(molecular function,MF)分析中可以看出与靶点相关的分子功能,靶点具备能和DNA 结合转录激活剂,RNA 聚合酶Ⅱ特异性、类固醇激素受体活性、RNA 聚合酶Ⅱ顺式调控区序列特异性DNA 结合、锌离子结合、DNA结合转录因子活性、核心启动子序列特异性DNA结合、染色质结合、甾体结合、序列特异性DNA结合、核受体活性等结合的分子功能。
从细胞成分(cellular component,CC)分析中可以看出与靶点相关的细胞成分,靶点主要分布于细胞中核染色质、核常染色质、细胞核、细胞器膜等部位[20,23-24]。
通过对福建野鸦椿果治疗肝纤维化的33 个关键靶点进行KEGG 通路富集分析,得到8 条主要的生物信号通路,按P值由小到大排序的前列,选取与肝纤维化相关的6 条通路:叉头转录因子信号通路(FoxO signaling pathway)、过氧化物酶体增殖物激活受体(PPAR signaling pathway)、Toll 样受体信号通路(Toll-like receptor signaling pathway)、胰岛素抵抗(insulin resistance)、血管内皮生长因子信号通路(VEGF signaling pathway)、沙门氏菌感染(Salmonellainfection)(见图5)。
4 讨论
4.1 EFT 对小鼠肝纤维化的干预作用
在前期工作中本课题组用福建野鸦椿果水提物和EFT 做了小鼠的急性毒性实验,发现在小鼠最大耐受量下,各器官实质均无明显损伤。为了将药物的治疗效果最大化,我们提高灌胃量进行给药,开展后续实验。本实验在建立CCl4诱导的小鼠肝纤维化模型后,通过观察HE 染色后的病理切片,发现EFT 能够明显抑制CCl4所造成的肝损伤和纤维化病变。血清ALT、AST、ALB 和TBIL的含量是临床评估肝功能常用的指标。在本次实验中,EFT 的干预对这些指标变化的逆转作用显著。HA、LN 是肝脏纤维组织主要基质成分,其血清中的含量可反映肝纤维化严重程度,EFT 的干预同样能够降低其含量。综上,本研究明确了EFT 对CCl4所诱导的小鼠肝纤维化的干预作用。
4.2 网络药理学预测构建EFT 活性成分-靶点-肝纤维化网络
采用网络药理学的方法对EFT 作用肝纤维化的机制进行预测,野鸦椿属植物在化学成分上有着高度的一致性[4],故本研究筛选出了野鸦椿属植物中共21 个三萜成分,构建了福建野鸦椿果“三萜活性成分-作用靶点”网络图,共获得140个靶点。福建野鸦椿果“活性成分-靶点-肝纤维化”靶点互作图分析得到33 个关键靶点,在一定程度上反映出它们之间存在复杂交错的相互关系,并非独自发挥作用。GO 分析结果表明,福建野鸦椿果治疗肝纤维化涉及细胞过程和代谢过程等生物过程,涉及核染色质、核常染色质、细胞核、细胞器膜等细胞组分,有酶、受体、蛋白质等多种物质的参与,是一个复杂的网络。从KEGG 通路分析中可以看出,福建野鸦椿果治疗肝纤维化涉及多条复杂的信号通路。
福建野鸦椿果21 种活性成分中熊果酸、齐墩果酸、山楂酸、坡模酸、常春藤皂苷元连接较多靶点数。这些成分所连接的140 个靶点中,PGR、HMGCR、CYP19A1、NR3C1、AR、PPARA、PPARG、PTGS2、MAPK3、TNF、IL-6 等度值较大,是福建野鸦椿果治疗肝纤维化的主要作用靶点。其中TNF 和IL-6 度值显著,更因其炎症因子的身份而颇受关注。TNF 和IL-6 是主要由巨噬细胞主要分泌的一类促炎因子,其产生能够促进巨噬细胞进一步向促炎型转化,损伤肝实质细胞,激活肝星状细胞,促进肝纤维化发展[2]。福建野鸦椿果中的熊果酸和齐墩果酸具有抗氧化作用,可通过提高肝损伤后的多种抗氧化酶活性,降低TNF-α、IL-6 等炎性因子水平,阻滞肝纤维化形成[8-11]。邓莉等[14]报道齐墩果酸能抑制TNF-α诱导的成纤维细胞样滑膜细胞炎症因子IL-6及IL-1β的产生。王颖等[13]发现山楂酸在CCl4诱导的炎症性肝损伤的模型中能显著降低肝组织中TNF-α和IL-1β表达。以上研究表明福建野鸦椿果的抗肝纤维化作用可能与其对巨噬细胞的作用有关。巨噬细胞是肝内最主要的免疫细胞,具有高度的可塑性和异质性,可针对不同的刺激信号作出应答,在不同微环境下可分化成表型和功能迥异的不同类型,释放促炎因子或抗炎因子[27-29]。在肝纤维化启动的早期炎性反应期,巨噬细胞在LPS、IFN-γ等诱导下,主要表现为M1 型,高表达和分泌促炎细胞因子IL-1β、IL-6、IL-12、TNF-α等,并高表达CD68、CD40 等表面抗原提呈分子,而抗炎细胞因子IL-10、IL-22 等的分泌量较低[2,30]。这些促炎因子可迅速作用于肝星状细胞(hepatic stellate cell,HSC),促进静息状态的HSC 增殖,并向肌原纤维母细胞或肌成纤维样细胞转变,合成并释放ECM,从而启动肝纤维化[28,31-32]。
4.3 EFT 抗肝纤维化作用的相关信号通路
KEGG 分析结果将EFT 抗肝纤维化作用的机制指向其对Toll 样受体(Toll-like receptor,TLR)信号传递的调控[33]。TLR 是巨噬细胞所表达多种模式识别受体之一,包括TLR2、TLR4、TLR9 等,这些受体可以对LPS 等病原体成分进行识别,并进行炎症信号的传递。TLR4 是Toll样家族中的一员,作为重要的模式识别受体,能够识别内源性的HMGB1,促进TNF-α和IL-1β的产生,从而传递炎症信号,加重肝损伤[34-35]。当TLR4 被抑制之后,下游炎症因子理论上应该会减少。通过查阅文献发现,EFT 中熊果酸、齐墩果酸等化合物能够对TLR 信号通路的传递进行抑制[28,30]。PPAR 是TLR 信号传递的重要调控因子,PPARA 与PPARG 同属于过氧化物酶体增生激活受体家族,其活化对肝纤维化具有重要的调节作用[30,36]。在生理状态下,巨噬细胞的TLR信号由于PPAR 的负调控而无法向下游传递,一系列炎症基因的表达处于抑制状态[30,37-38]。但在肝损伤过程中PPAR 会出现表达量减少和功能异常,这被认为与肝脏炎症介质的释放和纤维化的进展有关[39]。张扬武等[15]发现熊果酸能够抑制HSC-T6 细胞增殖,降低ECM 分泌,该机制可能与上调PPAR-γ表达有关。
脂肪酸结合蛋白(fatty acid-binding protein,FABP1)是药物和疾病共有的作用靶点,对肝细胞中脂类代谢和脂类链接起重要作用,其活性的改变与肝纤维化、脂肪肝、肝硬化以及肝癌的发生发展过程密切相关[40]。肝型脂肪酸结合蛋白FABP1主要表达于肝脏,对肝细胞中脂类代谢和脂类链接起重要作用,并且FABP1 的活性改变与肝纤维化、脂肪肝、肝硬化以及肝癌的发生发展过程密切相关,血液中FABP1 的浓度可预测肝损伤程度,FABP1 有望成为肝细胞损伤早期的生物标志物,当肝脏受到轻微损伤时,肝小叶中央区域的肝细胞会迅速响应,大量释放FABP1[41-43]。
叉头转录因子(forkhead box protein O,FoxO)中研究最多的是FoxO1 和FoxO3,它们广泛参与了肝纤维化病变的各个阶段[36]。研究表明,FoxO1和FoxO3 可通过诱导HSC 中p27基因的表达,使HSC 的细胞周期阻滞,抑制HSC 增殖[44-45]。此外,这两个蛋白能够抑制抗凋亡因子IL-1β-转换酶抑制蛋白(cellular homolog FLICE-like inhibitory protein,c-flip)的表达,激活caspase-8 和caspase-3,导致活化的HSC 凋亡[45-46]。机体中血管内皮生长因 子(vascular endothelial growth factor,VEGF)在正常情况下水平很低,只是维持正常的血管密度和通透性[47]。当肝纤维化发生时,局部病变组织出现缺氧,HSC 活化,引起VEGF 水平升高,VEGF 的转录激活最终会诱导血管生成[36,48]。Jaroszewicz 等[49]提出,VEGF 血清和受体水平反映了肝功能损害的程度。
本实验明确了EFT 成分的抗肝纤维化活性,并通过网络药理学的方法预测了福建野鸦椿果发挥抗肝纤维化作用可能的作用靶点及通路。将动物实验与网络药理学相结合,初步揭示了福建野鸦椿果治疗肝纤维化的作用机制,为其抗肝纤维化机制的阐明奠定基础,同时也为其他网络药理学工作的开展提供借鉴。

