砂藓RcPLD基因的抗旱功能分析
马天意,张时通,朱巍巍,张梅娟,李莹莹,彭疑芳,沙 伟
(1 抗性基因工程与寒地生物多样性保护黑龙江重点实验室, 齐齐哈尔大学 生命科学与农林学院, 黑龙江齐齐哈尔 161006; 2 东北农业大学 生命科学学院, 哈尔滨 150030)
干旱是频发的全球性自然灾害之一,严重威胁植物的生存和生长,导致粮食产量下降[1]。中国粮食生产过程中遭受到的干旱灾害尤为严重,多年来中国农业干旱受灾面积约占总自然灾害受灾面积的一半左右,干旱导致的农作物种植面积缩减问题直接制约了粮食的增产速度[2-3]。利用环境干旱胁迫已经筛选出了许多具有抗旱性的植物物种,再利用遗传学和分子生物学手段从具有抗旱能力的植物中寻找能够提高植物抗旱性的基因,借以培育新的抗旱作物品种,是使植物适应干旱环境生长的一种行之有效的方法[4]。
砂藓(Racomitriumcanescens)为紫萼藓科(Grimmiaceae)砂藓属(Racomitrium)植物,广泛分布于各种生境,是黑龙江省五大连池地区火山熔岩地貌的优势种[5],也在中国大部分地区广泛分布[6]。早在几十年前就已经证实砂藓是具有耐脱水性的藓类植物[7],干燥数年的砂藓材料可在复水后数分钟内恢复正常生长状态,在植物抗旱性和耐脱水性机制研究方面显示出较高的利用价值[8],砂藓中与强耐脱水性功能相关的基因可能具有提高植物抗旱能力的作用。在早期研究中,对正常生长的砂藓材料进行了24 h的快速脱水处理,使用转录组测序技术来寻找可能参与砂藓耐脱水性响应的功能基因,并试图探讨这些基因提高植物抗旱性的能力。对发现的多个基因进行了初步的研究,其中砂藓的ATP合酶Ⅱ亚基基因RcatpG[9]、生长素受体基因RcTIR1[10]、超氧化物歧化酶基因RcSOD[11]、丙二烯氧化物环化酶基因RcAOC1[12]、MYB转录因子基因RcMYB[13]、bZIP转录因子基因RcbZIP1[14]、过氧化氢酶基因RcCAT[15]和小G蛋白结合蛋白质基因RcRAB[16]的表达在各种脱水和复水处理中发生了变化,而且使用RcMYB构建的过表达转基因烟草获得了更强的耐旱性和复水能力[17]。这些研究结果表明砂藓中的基因资源能够用来提高植物的抗旱能力,很多基因抗旱功能有待于被发现和证实。
近期报道了砂藓中一个被注释为磷脂酶D(phospholipase D, PLD)的编码基因RcPLD能够在砂藓的不同脱水和复水处理中发生显著的差异表达,通过对该基因的编码序列克隆和序列基本特征分析[8],初步证实RcPLD可能参与砂藓的耐脱水胁迫响应。
PLD的生物化学本质是磷酸二酯酶,其根据水解磷脂时的不同作用位置被分为磷脂酶A1、A2、B、C、D等5类[18]。这些磷酸二酯酶能够将磷脂水解为二脂酰甘油、乙酰胆碱、磷脂酸和三磷酸肌醇等产物,这些水解产物都能够作为第二信使在植物细胞的各种生命活动中发挥重要的作用[19]。典型的PLD具有的保守结构域包括2个PLD家族结构域HKD(HxKxxxxD, domain)、一个C2(proteinkinase C-conserved-domain 2)结构域、一个磷脂酰肌醇二磷酸[phosphatidylinositol-(4,5)-bisphosphate, PIP2]结构域及潜在的IYIENQFF结构,少数PLD会缺少其中的某些结构域而由其他结构域代替[8]。研究发现RcPLD所编码的蛋白质序列中仅包含1个HKD,这种非典型的PLD在之前鲜有报道,其功能与典型PLD的异同也不得而知。前人发现,不同植物物种的PLD能够影响植物的冷胁迫和干旱胁迫耐受能力,并对其中的作用机制进行了相关的研究[20-21],但苔藓植物中PLD的相关研究还较为缺乏,特别是砂藓的非典型PLD(RcPLD)在环境胁迫中的具体作用尚不清楚。
因此,本研究使用已克隆得到的RcPLD编码序列构建了过表达转基因拟南芥(Arabidopsisthaliana)株系rcpld-oe,发现rcpld-oe具有强于野生型拟南芥的干旱胁迫耐受能力,对不同的拟南芥株系进行了基本的生理生化指标测定,以对RcPLD增强拟南芥抗旱性的机制进行解释。本研究结果初步证明了RcPLD可用于提高植物耐旱能力,为更多苔藓植物抗逆相关基因资源的研究、开发和利用奠定基础。
1 材料和方法
1.1 RcPLD过表达转基因拟南芥株系的构建
使用前期已连入RcPLD编码序列的pMD-19T重组质粒构建RcPLD的过量表达载体。在构建克隆载体时已在引物RcPLD-F和RcPLD-R中分别加入限制性内切酶SalⅠ和EcoR Ⅰ的酶切位点(表1),使用TaKaRa公司(大连)生产的QuickCutSalⅠ和QuickCutEcoR Ⅰ限制性内切酶对RcPLD的克隆载体和pRI101-AN空表达载体(TaKaRa,大连)进行双酶切,反应结束后使用1%琼脂糖凝胶电泳对产物进行分离,回收目的条带后使用北京索莱宝科技有限公司的DNA琼脂糖凝胶回收试剂盒对酶切后的载体和RcPLD编码序列进行回收,使用TaKaRa公司生产的T4DNA Ligase对基因和载体片段进行连接。连接产物转化至大肠杆菌(Escherichiacoli)DH5α株系感受态细胞后进行培养和筛选鉴定,方法同沙伟等[8]。根据Kong等方法,将提取后的重组质粒转化至实验室保存的根癌农杆菌(Agrobacteriumtumefaciens)EHA105后进行筛选、鉴定和培养,使用浸花法对实验室保存的columbia-0(col-0)野生型拟南芥进行侵染,使用含有50 μg/mL卡那霉素的1/2 MS培养基对侵染后获得的拟南芥种子进行筛选,筛选后获得的植株即为T1代RcPLD过表达转基因拟南芥植株(rcpld-oe)[22]。
表1 实验引物序列信息
筛选结束后将T1代rcpld-oe植株移栽至灭菌的混合土基质(蛭石∶草炭土比例为2∶1)中,放置于封闭光照培养室中进行培养(16 h光照/8 h黑暗,(25±1) ℃,空气相对湿度45%~55%)。当T1代rcpld-oe植株长出6片真叶时取1片真叶进行基因组DNA提取,以检测筛选得到的拟南芥植株中是否插入了RcPLD片段。使用TaKaRa公司生产的DNAiso Reagent试剂对rcpld-oe和野生型拟南芥植株进行DNA提取,提取后将基因组DNA稀释至100 ng/μL,每植株取100 ng基因组DNA进行PCR反应。反应体系为:基因组DNA 1 μL,RcPLD-F、RcPLD-R引物各1 μL,Premix TaqTM(Ex TaqTMVersion 2.0)反应液10 μL,无菌去离子水7 μL;PCR反应程序为:95 ℃预变性5 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共30循环,72 ℃终延伸10 min。使用等量野生型拟南芥基因组DNA作为阴性对照,无菌去离子水作为空对照,含有RcPLD编码序列的pRI101-AN重组质粒作为阳性对照。
将鉴定含有RcPLD序列的植株继续培养,单独收集每一株拟南芥植株的种子,然后播种于含有50 μg/mL卡那霉素的1/2 MS培养基中进行筛选,筛选后的植株移入混合土基质中继续培养,获得T2代rcpld-oe植株。在培养过程中,当植株生长至21 d时,每个植株剪去4片未衰老的莲座叶,迅速放入2 mL离心管中,用液氮速冻后放置于-80 ℃冰箱中保存,供后续试验中提取RNA。单独收集每株T2代rcpld-oe植株的种子,使用含有50 μg/mL卡那霉素的1/2 MS培养基对种子进行筛选,每个培养基上播种同一植株的50粒种子,每个植株播种3次,若排除自然萌发率影响后,同一植株的3次筛选中所有种子都能正常萌发生长,则认为该T2代rcpld-oe植株为RcPLD纯合体,可用于后续试验分析。当T2代rcpld-oe植株被鉴定为纯合体后,使用提前采集并保存的莲座叶材料进行RNA提取,提取方法同沙伟等[8]。用获得的RNA合成cDNA后,采用qPCR对材料中RcPLD的表达量进行检测,以拟南芥Actin1(AT2G37620)基因作为内参基因,进行独立的3次生物学重复,试验方法同沙伟等[8],所用引物序列如表1所示。
1.2 干旱和复水处理
将消毒后的rcpld-oe纯合T3代种子和野生型拟南芥种子同时播种于1/2 MS平板固体培养基中,消毒方法同Kong等[22],于4 ℃黑暗条件下春化3 d后移至光照周期为8 h光照/16 h黑暗的培养室中进行培养,待幼苗生长至具有2片莲座叶后,将幼苗移至含混合土基质的带托盘花盆中进行培养。当植株生长至播种21 d时,选取不同拟南芥株系中长势一致的足量植株进行干旱胁迫处理。将含植株花盆移至不含水的托盘中进行自然干旱处理,同时以相同培养条件下托盘中正常浇水的相同株系植株作为对照,此时设置为干旱处理的0 d(D0),随后每天对植株的生长情况进行观察和图像采集,每7 d收集一批拟南芥莲座叶材料,共收集5次(D0、D7、D14、D21、D28),干旱处理28 d后使用去离子水对拟南芥植株进行复水处理,此时记为复水0 d(R0),复水2 d后(R2)观察植株形态特征并进行图像采集。
1.3 生理生化指标测定
采集干旱处理中各株系拟南芥的莲座叶作为生理生化指标测定的材料。使用磺基水杨酸法对游离脯氨酸含量进行测定,使用蒽酮法对可溶性糖含量进行测定,使用考马斯亮蓝法对可溶性蛋白质含量进行测定,使用三氯乙酸/硫代巴比妥酸法对丙二醛进行提取和含量测定,使用丙酮提取法对总叶绿素进行提取,以上生理生化指标测定和计算方法及相对含水量测定方法如Yin等所述[23]。每个指标的每次测定中分别使用0.1 g样品材料,干旱处理和正常生长条件下的每个株系的植株均单独取样测定,测定均进行3次生物学重复。
1.4 数据统计与分析
用SPSS 20.0软件对获取的数据进行统计学计算分析,所有数据用Duncan法进行one-way ANOVA计算分析不同样品间的差异显著性。
2 结果与分析
2.1 RcPLD过表达拟南芥纯合体株系的构建
以前期成功构建的RcPLD克隆载体作为模板,构建含有RcPLD编码序列的植物过量表达载体。在成功获得RcPLD表达载体后,将重组质粒转化入根癌农杆菌EHA105株系中,对抗生素筛选后的阳性菌落进行PCR鉴定,获得含有RcPLD表达载体的农杆菌菌株(图1,A)。对筛选获得的农杆菌菌落进一步培养,并用浸花法侵染col-0野生型拟南芥,收集成熟后种子,使用含有50 μg/mL卡那霉素的1/2 MS培养基对T1代转基因植株进行筛选(图1,B)。提取筛选获得的植株基因组DNA,用RcPLD的克隆引物来鉴定RcPLD基因是否已插入筛选得到的植株基因组DNA中,最终获得3个T1代RcPLD过表达转基因拟南芥植株rcpld-oe-1、rcpld-oe-2和rcpld-oe-3(图1,C)。
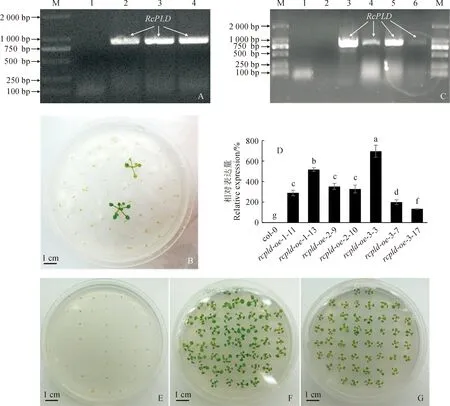
A.含有RcPLD表达载体的农杆菌菌液PCR:M.DL2000; 1. pRI101-AN(对照);2. RcPLD表达载体; 3-4. 含有RcPLD表达载体的农杆菌菌液; B. T1代rcpld-oe植株的抗生素筛选; C. T1代rcpld-oe植株基因组DNA的PCR验证: M. DL2000; 1. 水(对照); 2. 野生型拟南芥基因组DNA; 3. RcPLD表达载体; 4-6. T1代rcpld-oe植株基因组DNA; D. T2代rcpld-oe植株中RcPLD相对表达量的qRT-PCR检测, rcpld-oe-3-17植株中RcPLD的表达量被定义为100%, 误差线表示标准偏差, n=3, 误差线上不同小写字母表示在0.05水平存在显著差异(P<0.05),下同; E-G. rcpld-oe纯合体株系的筛选:E.野生型拟南芥; F. rcpld-oe-2-10; G. rcpld-oe-3-17图1 RcPLD过表达拟南芥纯合体株系的构建A. PCR with suspension of Agrobacterium containing RcPLD expression vectors: M. DL2000; 1. pRI101-AN (control); 2. RcPLD expression vector; 3-4. Agrobacterium suspension containing RcPLD expression vectors; B. Screening of T1 generation rcpld-oe plants by antibiotics; C. Genomic DNA PCR identification of T1 generation rcpld-oe plants: M. DL2000; 1. Water (control); 2. Genomic DNA of wild-type Arabidopsis; 3. RcPLD expression vector; 4-6. Genomic DNA of T1 generation rcpld-oe plants; D. qRT-PCR detection of relative expression of RcPLD, RcPLD expression of rcpld-oe-3-17 were defined as 100%, error bars indicate standard deviations, n=3, the different lowercased letters above error bars stand for significant difference among materials at 0.05 level (P<0.05), the same as below; E-G. Screening of rcpld-oe homozygotes: E. Wild-type Arabidopsis; F. rcpld-oe-2-10;G. rcpld-oe-3-17Fig.1 Construction and identification of RcPLD-overexpressed Arabidopsis thaliana homozygote lines
对3个过表达拟南芥株系继续培养,收集其成熟种子并再次进行播种和筛选,继续培养T2代拟南芥植株的同时收集莲座叶材料和种子,使用获得的T3代种子来鉴定哪些T2代rcpld-oe株系为RcPLD的纯合体株系,对鉴定为纯合体的T2代株系进行RNA提取,并对植株中RcPLD进行qPCR检测(图1,D),部分纯合体rcpld-oe株系筛选结果如图1,E-G所示。由图1,D可以看出,野生型(col-0)拟南芥中RcPLD的表达量可被认定为仪器系统误差,其他所有被检测的T2代rcpld-oe植株中都具有较高的RcPLD表达量。综合考虑基因表达量和所获T3代植株的种子数量,最终选取rcpld-oe-1-13、rcpld-oe-2-9和rcpld-oe-3-3进行后续研究。
2.2 RcPLD过表达拟南芥的耐旱性分析
将野生型(col-0)植株和过表达株系rcpld-oe-1-13、rcpld-oe-2-9和rcpld-oe-3-3植株同时进行干旱处理,检测RcPLD过量表达是否能够提高拟南芥的干旱胁迫耐受能力。图2显示,在正常浇水条件下,拟南芥3个rcpld-oe株系植株的生长速率慢于野生型植株,其相同苗龄植株的莲座叶面积明显小于野生型植株,且抽薹时间明显较晚(图2,A)。在干旱处理0~21 d,3个rcpld-oe株系的植株莲座叶片面积小于野生型植株,而野生型植株又明显小于其同龄相应的正常浇水处理植株;但3个rcpld-oe株系植株的体积在干旱处理7 d时大于其正常浇水处理的植株,而在干旱处理14~21 d时均小于其正常浇水处理的植株(图2,A、B)。在干旱处理28 d时,野生型拟南芥已全部死亡,rcpld-oe-1-13和rcpld-oe-2-9植株的生长受到较低程度的抑制,rcpld-oe-3-3植株受到较高程度干旱抑制,但好于同期野生型拟南芥;复水2 d后,3个rcpld-oe株系的植株绝大部分能够维持生存并继续生长,而野生型拟南芥植株基本无复苏征兆(图2,B)。以上结果说明RcPLD的过量表达使拟南芥的抗旱能力和旱后复水能力在一定程度上得到了提升。
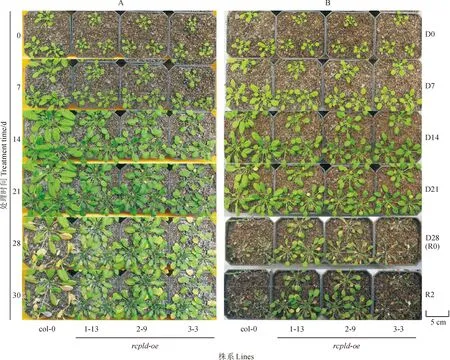
A.正常浇水处理的拟南芥植株; B.干旱胁迫处理的拟南芥植株:D0、D7、D14、D21、D28分别表示干旱处理0、7、14、21、28 d, R0、R2分别表示复水处理0、2 d;1-13、2-9、3-3分别代表RcPLD过表达株系rcpld-oe-1-13、rcpld-oe-2-9和rcpld-oe-3-3植株。下同图2 干旱和复水处理下拟南芥野生型(col-0)和rcpld-oe过表达株系的生长情况A. A. thaliana plants growing under normal watering condition; B. A. thaliana plants growing under drought stress treatments: D0, D7, D14, D21, D28 stand for drought treatment for 0, 7, 14, 21, 28 d, respectively, while R0, R2 stand for rehydration treatment for 0, 2 d, respectively; 1-13, 2-9, 3-3 are representing RcPLD overexpression plants of rcpld-oe-1-13, rcpld-oe-2-9 and rcpld-oe-3-3 lines. The same as belowFig.2 Growth condition of wild-type (col-0) and rcpld-oe Arabidopsis thaliana lines under drought and rehydration treatments
2.3 干旱胁迫过程中RcPLD过表达拟南芥的生理生化指标变化特征
RcPLD过量表达株系和野生型拟南芥植株莲座叶基本生理生化指标测定结果显示:正常浇水条件下,野生型和rcpld-oe植株莲座叶的相对含水量均能维持在95%以上;在干旱处理过程中,野生型和rcpld-oe植株莲座叶的相对含水量随着处理时间的延长都显著下降,但干旱处理21 d时rcpld-oe拟南芥相对含水量的下降幅度显著低于野生型植株,其中又以rcpld-oe-1-13植株下降幅度最小(图3,A)。野生型和rcpld-oe植株莲座叶脯氨酸含量在正常生长条件下基本无变化且维持在较低的水平,而在干旱处理过程中都有显著的提升,尤其在干旱处理后期迅速大幅度提升,且各rcpld-oe植株在处理7 d时提升幅度就达到显著水平,而野生型植株在处理14 d时才显著升高;在干旱处理过程中,各rcpld-oe植株莲座叶脯氨酸含量增加幅度始终显著高于同期野生型拟南芥(图3,B)。野生型和rcpld-oe株系植株莲座叶可溶性糖和可溶性蛋白质含量随着处理时间的变化趋势和幅度基本一致,rcpld-oe-1-13和rcpld-oe-2-9中可溶性糖含量在干旱处理过程中基本高于野生型拟南芥,可溶性蛋白质含量在干旱处理后期显著高于野生型拟南芥,而rcpld-oe-3-3中的含量低于野生型拟南芥(图3,C、D)。随着拟南芥植株进入生殖生长阶段和逐渐衰老,野生型和过表达植株莲座叶中丙二醛含量都有增加的趋势;在正常浇水条件下,野生型植株中丙二醛含量随着植株的生长而稳定增加,而rcpld-oe植株在生长前期含量变化幅度小于野生型拟南芥,整体丙二醛含量也较低;在干旱处理过程中,野生型拟南芥莲座叶中丙二醛含量随着处理时间的延长而显著提升且速率较稳定,rcpld-oe植株的丙二醛含量在干旱处理中也有所提升,但提升幅度始终低于野生型拟南芥(图3,E)。在总叶绿素含量方面,rcpld-oe植株在正常浇水条件下与野生型拟南芥表现有所不同,其莲座叶总叶绿素积累的速度较慢;在干旱处理过程中,野生型拟南芥中总叶绿素含量的积累受到了显著的抑制,rcpld-oe植株中的总叶绿素含量也有所降低,但受抑制程度显著低于野生型拟南芥(图3,F)。以上结果说明明RcPLD的过量表达使拟南芥在干旱过程中的渗透调节物质含量显著提高,进而使水分的损失程度降低,同时通过降低膜损伤程度和光合作用抑制水平来对植株进行保护。
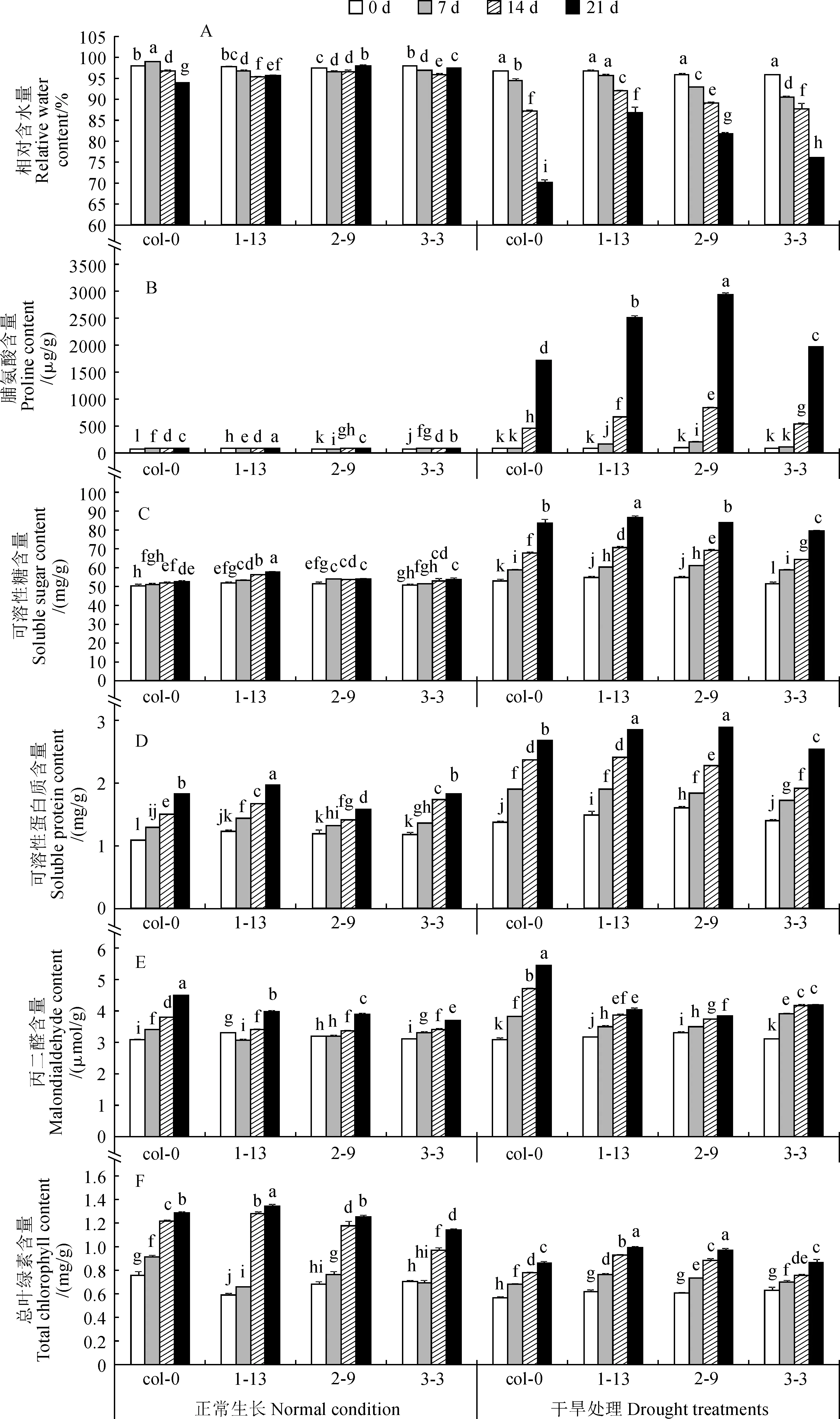
图3 干旱处理过程中野生型和rcpld-oe拟南芥植株莲座叶相关指标的变化Fig.3 Changes of related index in rosette leaf of wild-type and rcpld-oe Arabidopsis thaliana under the drought treatment
3 讨 论
在不同植物中,不同的PLD基因被证实能够影响植物的胁迫耐受能力。拟南芥中PLDα缺陷突变体的叶片蒸腾失水率显著高于野生型,pldα1-1在干旱胁迫下表现出比野生型更高的敏感性[24-25];菊花(Chrysanthemummorifolium)CmPLDα基因参与菊花的多种胁迫过程,包括机械损伤、高温胁迫、缺磷胁迫以及盐胁迫[26];而在苔藓植物中PLD的抗逆功能还缺乏报道。本研究构建的不同RcPLD过表达拟南芥株系rcpld-oe具有不同的RcPLD表达量,但在正常生长条件下表现的特征基本一致,基本表现为营养阶段下植株体积明显小于野生型拟南芥,莲座叶较小,营养生长时期较长,抽薹期延后等。
在干旱处理条件下,本研究发现拟南芥不同rcpld-oe株系植株总体抗旱能力明显强于野生型拟南芥,3周龄的rcpld-oe幼苗在自然干旱处理28 d后基本能够存活,多数植株在复水后能够恢复生长,而野生型拟南芥无法恢复。与正常生长的植株相比,野生型拟南芥植株体积在干旱胁迫过程中明显下降,而rcpld-oe植株在形态上受干旱胁迫抑制程度较小,甚至在干旱处理初期植株体积还略大于野生型拟南芥。值得注意的是,RcPLD赋予拟南芥抗旱性的情况并不完全与RcPLD的表达量呈正相关,在进行干旱处理的3个rcpld-oe株系中,rcpld-oe-3-3中RcPLD的表达量最高,但在3个株系中的抗旱能力表现为最弱,我们推测RcPLD对拟南芥抗旱能力的提升需要一个最适区间,也可能存在RcPLD在拟南芥基因组插入位点的影响,但3个rcpld-oe株系在表型特征上的一致性显示rcpld-oe-3-3在抗旱性方面的表现更可能与表达量相关,这个推论将在后续的工作中进一步进行分析验证。
本研究对野生型和rcpld-oe株系拟南芥干旱处理前21 d的材料进行了部分生理生化指标的测定,以初步分析RcPLD在提高拟南芥抗旱功能中可能的作用。首先,在水分保持能力方面,正常生长条件下野生型和rcpld-oe株系莲座叶相对含水量水平相似,都能够维持在90%以上,相对而言rcpld-oe株系相对含水量在生长过程中变化更平稳;在干旱处理过程中,野生型植株相对含水量下降的程度显著高于rcpld-oe植株,在干旱处理21 d时已接近70%,而除rcpld-oe-1-13和rcpld-oe-2-9植株的相对含水量都能够维持在80%以上,说明RcPLD的过量表达可能增强了拟南芥在干旱条件下防止水分散失的能力。曾有研究表明PLD的活性增加能够促进脱落酸诱导的气孔关闭过程来降低植物在干旱胁迫下的水分散失[27],我们认为这可能是RcPLD在过表达植株中提升抗旱性的机制之一。同时,气孔关闭程度提升会导致CO2摄入量减少,进而影响有机物同化量而导致植物体生长速率的减慢[28],这也与我们观察到的形态特征表现相一致,但RcPLD更精确的抗旱功能机制还需进一步探索。
其次,在干旱胁迫条件下,细胞中的渗透调节物质含量对于植物水分调节能力十分重要,随着干旱胁迫程度的加深,植物细胞往往要增加细胞中的渗透调节物质含量来应对外界提升的渗透势,游离脯氨酸、可溶性糖和可溶性蛋白质是常在植物遭受渗透胁迫过程中发挥作用的调节物质[23]。本研究对野生型和rcpld-oe拟南芥植株在干旱处理过程中这3类物质的含量进行了检测,发现野生型植株和rcpld-oe植株在可溶性糖和可溶性蛋白质含量变化方面相差不大,虽然在干旱处理过程中存在显著差异,但在差异幅度方面较小,而rcpld-oe植株在干旱处理过程中脯氨酸含量增加的速度和积累量都明显优于野生型植株,这说明过量表达的RcPLD在拟南芥的抗旱过程中可能参与了渗透调节物质的调控,但对可溶性糖和可溶性蛋白质总量的影响程度较低,可能主要参与了增加游离脯氨酸累积的过程。
再次,丙二醛作为膜脂过氧化的终产物常被用于指示细胞膜完整性的代谢产物,通常认为丙二醛含量越低,膜脂过氧化程度越低,膜完整性越高[23]。从本研究结果可知,正常生长条件下野生型拟南芥莲座叶片丙二醛含量的增加幅度就明显高于rcpld-oe植株,这可能是由于野生型拟南芥与rcpld-oe植株相比莲座叶片本身衰老的速度就较快有关;在干旱处理过程中可以发现,野生型拟南芥叶中丙二醛含量提升的速度和幅度显著增强,而rcpld-oe植株叶中丙二醛含量增加的幅度显著小于野生型植株,这说明在干旱处理过程中RcPLD一定程度上降低了rcpld-oe植株叶片细胞膜系统的过氧化伤害。
另外,在不同植物应对不同环境胁迫的过程中,光合作用采取的机制不尽相同,本研究检测了干旱处理过程中拟南芥野生型和rcpld-oe植株莲座叶总叶绿素的含量,探索RcPLD在提升拟南芥抗旱能力的过程中对光合作用可能产生的影响。研究发现在正常生长条件下,rcpld-oe植株总叶绿素的累积速度比野生型植株慢,这可能与rcpld-oe植株莲座叶生长较慢的现象有关;与正常生长条件下相比,干旱处理过程中野生型和rcpld-oe植株总叶绿素的含量都有所减少,但相对而言野生型植株中叶绿素含量的减少程度更大。
综上所述,本研究对前期发现响应砂藓脱水胁迫的磷脂酶D编码基因RcPLD在植物应对干旱胁迫时的作用进行了初步探讨,利用已克隆的RcPLD编码序列构建了植物中的过量表达载体,构建了RcPLD的过表达转基因拟南芥株系rcpld-oe,并获得了多个T3代rcpld-oe纯合体株系。这些拟南芥rcpld-oe植株的抗旱能力整体上强于野生型拟南芥植株,在正常生长条件下与野生型拟南芥植株相比在营养生长阶段体积较小,但营养生长期较长,抽薹较晚,莲座叶衰老速率较慢。同时,过量表达的RcPLD使拟南芥在干旱胁迫条件下的水分散失速率降低,在一定程度上降低了干旱胁迫的膜损伤和光合作用抑制程度,但对渗透调节物质的含量变化影响较小。因此,本研究认为砂藓中的RcPLD可以用于提高植物的抗旱性,其更深入的作用机制值得进一步研究。

