食品中有害物苯并[a]芘诱导结肠毒性的研究进展
袁 莉,王珠琳,李建科,张 萌
(陕西师范大学 食品工程与营养科学学院,陕西 西安 710119)
1 苯并[a]芘概述
1.1 苯并[a]芘的性质
苯并[a]芘(Benzo[a]pyrene,B[a]P)属于多环芳烃类化合物,是世界卫生组织确定的I类致癌物,同时具有极强的致畸性、致突变性和蓄积性。B[a]P的分子式为C20H12,相对分子质量为252.32,结构式如图1(a)所示[1]。在常温条件下,B[a]P为晶状固体,呈浅黄色,熔点为179℃,沸点为312℃,难溶于水,易溶于有机溶剂[2]。苯并[e]芘(Benzo[e]pyrene,B[e]P)是B[a]P的同分异构体,结构式如图1(b)所示,其致癌性目前尚不清楚。目前,B[a]P常用的检测方法有高效液相色谱-荧光法、气相色谱-质谱联用法、液相色谱-质谱联用法等。
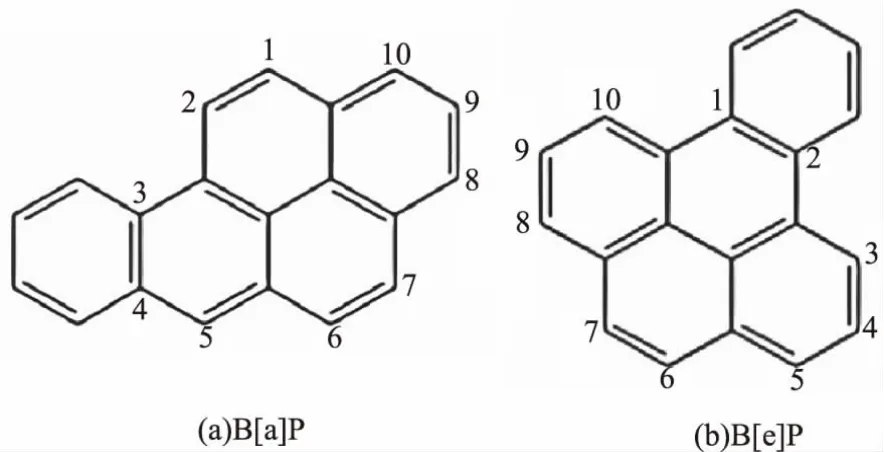
图1 B[a]P和B[e]P的化学结构式Fig.1 Chemical structural formula of B[a]P and B[e]P
1.2 苯并[a]芘在食品中的含量
食品中B[a]P主要有两方面来源:一是食品中有机物在煎、炸、熏、烤等高温加工条件下会发生热裂解反应,再经环化和聚合等反应形成B[a]P[3];二是工业生产和生活中煤炭、石油、天然气等燃料不完全燃烧产生含有B[a]P的废气,进而通过水源、空气和土壤等污染食品[4-5]。不同食品中B[a]P的质量分数如表1所示。

表1 不同食品中B[a]P的质量分数Table 1 B[a]P content in different foods
2 苯并[a]芘诱发结肠疾病的作用机制
随着人们生活水平的提高和饮食习惯的改变,结肠癌、结肠氧化损伤、结肠炎症、肠道菌群失调等各种结肠疾病的发病率逐渐上升。其中,食品加工有害物B[a]P对各种结肠疾病的发展具有诱导和促进作用[1,3]。因此,探究B[a]P诱发结肠疾病的作用机制可为其毒性控制提供理论基础,具有重要意义。B[a]P诱发各种结肠疾病的相关信号通路如图2所示。
2.1 苯并[a]芘诱发结肠癌的相关分子机制
2.1.1 细胞色素P450代谢途径B[a]P通过水和饮食摄入机体后被代谢为诱发癌症的关键性物质,从而破坏细胞大分子(如DNA),进而导致基因突变引发癌症[13]。细胞色素P450酶(CYP450)代谢B[a]P是诱导结肠癌的主要途径。CYP1A1和CYP1B1是两个非常重要的基因,它们负责肝脏和结肠中B[a]P的代谢[14]。Uno S等[15]研究发现,CYP1A1基因敲除的C57BL/6J小鼠和C57BL/6J野生型小鼠经B[a]P灌胃后,发现CYP1A1基因敲除的C57BL/6J小鼠30 d内死亡,而C57BL/6J野生型小鼠未表现出明显的毒性迹象,说明CYP1A1具有一定解毒作用。而CYP1B1用于代谢激活,可将B[a]P转化为二氢二醇环氧化合物,特别是对最终致癌物B[a]P-7,8-dihydrodiol-9,10-epoxide(BPDE)的形成至关重要[16]。在整个代谢过程中,B[a]P首先在结肠中形成代谢产物(例如二氢二醇),进一步被CYP1B1代谢为二氢二醇环氧化物(如BPDE),最后BPDE与DNA反应形成BPDE-DNA加合物,引起基因突变,从而启动肿瘤发生。
2.1.2 Wnt信号通路Wnt信号通路对癌变至关重要,其信号通路的异常激活经常发生在不同癌症中,特别是在结肠癌中[17]。β-catenin是Wnt信号的关键分子,参与细胞间的黏附调控,防止细胞发生转移[18]。结肠腺瘤性息肉病蛋白(adenomatous polyposis coli,APC)也是Wnt信号通路的成员之一,其突变与结肠癌的发生密切相关[19]。COX-2即诱导型环氧化酶,在机体受各种炎症介质、激素及促瘤因素等刺激作用下高度表达[20]。在Wnt信号通路中,APC基因的突变或缺失可导致β-catenin异常聚集,从而激活COX-2,使其高度表达,最终诱发癌变。Sonodn等[21]研究发现,CD2F1雄性小鼠经灌胃B[a]P和硫酸葡聚糖钠14周后,结肠不良隐窝中的β-catenin表达增加,从而诱发结肠癌的发生。
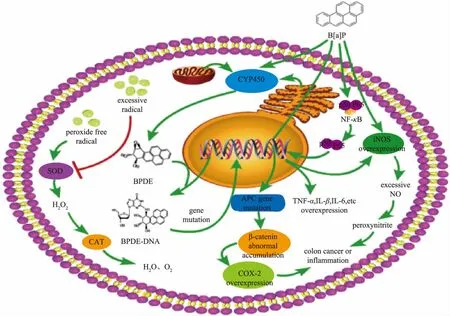
图2 B[a]P诱发各种结肠疾病的相关信号通路Fig.2 Related signal path of various colon diseases induced by B[a]P
2.2 苯并[a]芘诱导结肠氧化损伤的机制
结肠组织的氧化还原平衡状态受到结肠黏膜中抗氧化酶和非酶抗氧化剂的调控。超氧化物歧化酶(SOD)是一种普遍存在的抗氧化剂酶,可将超氧化物自由基催化转化为过氧化氢[22]。过氧化氢进一步被过氧化氢酶(CAT)分解为水和氧气。而B[a]P会引发结肠氧化损伤,原因可能是细胞色素P450代谢B[a]P过程中生成过量的自由基导致SOD和CAT活性下降,自由基异常累积,造成结肠氧化损伤[23]。此外,谷胱甘肽(GSH)是重要的维持肠道健康的非酶抗氧化剂,也是自由基清除剂和脂质过氧化抑制剂[24]。Ajayi等[25]研究发现,BALB/c雄性小鼠经灌胃B[a]P 14 d后,结肠中GSH水平降低,导致结肠氧化损伤,可能是由于机体在代谢B[a]P过程中产生过量自由基,随自由基解毒需求的增加导致GSH被过度利用,从而导致谷胱甘肽水平降低。
2.3 苯并[a]芘诱导结肠炎症的机制
Nuclear factor-kappa B(NF-κB)是一种调控炎症、细胞生长、肿瘤等相关基因表达的转录因子[26],以二聚体形式广泛存在于真核细胞胞浆中,最常见的异源二聚体由p50和p65组成[27]。NF-κB的转录作用对促炎因子如肿瘤坏死因子(TNF-α)和白细胞介素1β(IL-1β)的基因表达至关重要[28]。Ajayi等[29]研究发现,BALB/c雄性小鼠经灌胃B[a]P 7 d后,结肠组织中的NF-κB发生磷酸化,游离的NF-κB随后由胞浆转至核中,与TNF-α和IL-1β等蛋白质中特异性序列结合[27],使促炎因子TNF-α和IL-1β的合成增加,从而诱导小鼠结肠炎症的发生。此外,低水平的NO在正常的信号传导中发挥重要作用,而过量的NO则会导致过氧亚硝酸盐的形成,进而破坏组织[30]。B[a]P可活化诱导型NOS(iNOS)并产生高水平NO[31]。另外,iNOS基因也受NF-κB调控,NFκB被激活会促进iNOS的表达[32]。Ajayi等[29]研究还发现,BALB/c雄性小鼠经灌胃B[a]P 7 d后,结肠中iNOS表达增加、NO水平升高,进而诱导炎症和氮化应激导致结肠损伤。
2.4 苯并[a]芘诱导肠道菌群紊乱
肠道微生物菌群与宿主在长期的协同作用下相互适应,达到动态平衡,作为一个独特的微生物器官参与调节宿主的消化吸收、能量代谢、免疫反应等[33]。据报道,食用被B[a]P污染的食物会导致肠道菌群的变化,打破原有的平衡状态,从而诱发结肠损伤。Ribière等[34]研究发现,C57BL/6雄性小鼠经B[a]P灌胃后,粪便和肠黏膜上相关的细菌组成显著变化。在实验开始时,肠道菌群可能对B[a]P的促炎特性具有短暂的防护作用,尤其是通过增加黏液溶解促炎性细菌类群,例如黏螺旋菌属(Mucispirillum)是一种黏液溶解属[35],其产生的黏液对结肠上皮细胞具有保护作用,可防止致病微生物以及化学、物理或酶的损伤[36]。随着B[a]P的持续摄入,对小鼠不利的肠道环境逐渐形成,有益细菌丰度下降,如乳杆菌属(Lactobacillus)、粪球菌属(Coprococcus);对肠道有害的细菌丰度升高,如脱硫弧菌科(Desulfovibrionaceae)、紫单胞菌科(Porphyromonadaceae)、产碱杆菌科(Alcaligenaceae),这些细菌的代谢产物可能会破坏结肠上皮组织的屏障功能,进而诱发结肠炎。本研究团队也通过16S rRNA基因测序分析灌胃B[a]P 6周后的BALB/c雄性小鼠结肠内容物中菌群的组成和丰度[37],其主要细菌属的变化如表2所示,肠道中脱硫弧菌属(Desulfovibrio)、不动杆菌属(Acinetobacter)、臭杆菌属(Odoribacter)和韦荣氏球菌属(Veillonella)的相对丰度均高于对照组,普氏粪杆菌属(Faecalibaculum)和乳杆菌属(Lactobacillus)的相对丰度却低于对照组。其中,对肠道不利的细菌可能会产生一些毒性因子(如脱硫弧菌科的成员会产生肉毒素和有毒的硫[38]),从而诱发结肠炎或结肠癌,而对肠道有益的细菌可能会产生短链脂肪酸、丁酸盐等物质,可促进结肠癌细胞的凋亡,有利于肠道的健康[34,39]。
Zhao等通过16S rRNA基因测序,分析暴露于含B[a]P海水的海参肠道菌群的组成和丰度的变化[40]。研究进行第14天时,在门水平,扁平菌门的丰富度明显提高,变形菌门和拟杆菌门的丰度也增加,而厚壁菌门的丰度降低。其中,厚壁菌门是肠道内代谢未消化食物残渣的主要细菌,可促进寄主肠道复杂的膳食纤维和多酚的消化吸收[41]。在属水平上,多个有益属丰度下降,包括乳球菌属、芽孢杆菌属、乳杆菌属、肠球菌属、明串珠菌属和魏斯式菌属,且在组织学形态上,将海参暴露于含B[a]P海水中会对肠道结构和功能产生负面影响,其表现为海参肠中的炎症或萎缩、氧化应激和免疫抑制。此外,暴露于含B[a]P海水的海参肠道中还发现了降解烷烃的细菌,其中包括Lutibacter,Pseudoalteromonas,Polaribacter,Rhodopirellula和Blastopirellula,而这些菌大多可在被石油污染的海洋环境被发现中,研究推测在少量B[a]P暴露下,肠道菌群可通过对B[a]P的降解和解毒作用对寄主起到保护作用。

表2 小鼠结肠的主要细菌属相对丰度的变化[37]Table 2 Changes of the main bacterial genera in the colon of mice
2.5 饮食类型对苯并[a]芘诱导的结肠毒性的影响
2.5.1西方饮食 西方饮食多以肉类为主,热量较高。大量的流行病学调查显示,摄入过多红肉或过度的肥胖会增加结直肠瘤形成的概率。Harris等[42]通过给PIRC雄性大鼠分别喂养西方饮食和AIN-76A标准饮食,并同时灌胃B[a]P 60 d后,发现西方饮食会诱发B[a]P在PIRC雄性大鼠结肠上产生更多数量的肿瘤。因为通过饮食消耗过多的能量可能会导致胰岛素、甘油三酸酯和脂肪酸水平升高[43],随后诱导结肠上皮细胞增殖,并使它们暴露于活性氧中间体,达到结肠癌发展的理想环境。此外,由于B[a]P的脂溶性,当通过摄入富含脂质的食物时可能会促进其吸收,增加B[a]P长期暴露的可能性,使B[a]P和其代谢产物在胃肠道中的生物利用度提高,并对结肠上皮造成局部损害。
2.5.2 饮食脂肪的类型Diggs等[44]将B[a]P分别通过饱和脂肪(花生油)和不饱和脂肪(椰子油)给ApcMin雄性小鼠灌胃60 d后,发现饱和脂肪促进了B[a]P诱发结肠肿瘤的发展。单独摄入B[a]P与通过椰子油摄入B[a]P的小鼠相比,其血浆和结肠中会产生更多有毒代谢物(如B[a]P二醇和醌类物质等),可能会造成结肠损伤。且当B[a]P通过花生油摄入时,其代谢酶CYP1A1、1B1和谷胱甘肽S转移酶(GST)的活性提高(GST是一组与肝脏解毒功能有关的酶,对B[a]P具有解毒作用)、表达增加,在这些代谢酶持续作用下,部分B[a]P代谢产物会与DNA结合形成B[a]P-DNA加合物,促进结肠肿瘤形成和发展。流行病学调查显示,结肠癌患病率在地中海国家相对较低,其中橄榄油是饮食的主要成分[45]。橄榄油中含有丰富的酚类成分,这些成分具有有效的抗氧化特性,可以对多种类型的癌症起到保护作用[46]。肠道菌群和食用橄榄油之间的相互作用可以调节结肠微生物的组成和活性,也在预防癌症中发挥作用[47]。Banks等[48]研究发现,橄榄油可以有效预防B[a]P诱发的结肠癌。研究通过分析经灌胃60 d后的ApcMin雄性小鼠结肠中细胞色素P450代谢酶的表达,发现B[a]P通过橄榄油摄入,会使CYP1B1表达降低,从而抑制B[a]P的代谢。橄榄油也可有效减少B[a]P代谢过程中产生的活性氧(ROS)引起的DNA损伤,进而阻止结肠癌的发展。此外,橄榄油对COX-2和iNOS等与B[a]P引起结肠毒性相关的信号分子的表达具有抑制作用,有效减少结肠炎症和结肠癌的发生。
2.5.3 天然活性物质饮食中的植物化学成分在疾病预防中起着重要作用,多酚已显示出可抑制由致癌物诱导的肿瘤的发展[49]。其中,白藜芦醇是一种多酚,在葡萄皮和种子中含量丰富,食物来源包括葡萄酒,浆果和花生[50]。Huderson等[51]研究表明,白藜芦醇可以通过改变细胞色素P450参与的代谢途径,降低结肠中CYP1B1酶的活性,进而抑制B[a]P诱导结肠息肉的形成。CYP1B1的表达升高是结肠肿瘤形成的标志,而白藜芦醇会抑制CYP1B1的表达,阻止B[a]P的代谢。白藜芦醇还可以保护小鼠结肠组织免受活性氧引起的DNA损伤,促进受损碱基对的修复来阻断加合物的形成,阻止B[a]P最终代谢物与DNA结合,从而抑制肿瘤的形成和发展[52]。
聚甲氧基黄酮可以从柑橘果皮中分离得到,具有广泛的生物活性,例如抑制慢性炎症、预防癌症和抗动脉粥样硬化特性[53]。Wu等[54]研究发现,聚甲氧基黄酮可阻止苯并[a]芘/硫酸葡聚糖钠(B[a]P/DSS)诱导结肠肿瘤的形成。聚甲氧基黄酮可通过调节B[a]P的代谢途径使结肠组织中B[a]P的代谢产物和DNA的加合物减少。在分子水平上,RNA测序结果表明聚甲氧基黄酮改善了B[a]P/DSS诱导的异常分子机制改变,包括激活炎症反应、下调抗氧化靶标和诱导基因转移等。另外,食用聚甲氧基黄酮还可以通过改变肠道菌群的组成来抑制B[a]P诱导的结肠毒性,例如增加产生丁酸盐的益生菌和减少与诱导结肠癌相关的细菌。
6-姜醇是生姜中最具药理活性的成分,可促进肠道健康。Ajayi等[25]研究表明,6-姜醇可以降低TNF-α,IL-1β,COX-2和iNOS的水平来抑制B[a]P诱导的结肠炎症。另外,6-姜醇可以使B[a]P代谢酶的活性显著增加,并增强谷胱甘肽S转移酶(GST)和环氧水解酶(EPXH)的活性来促进B[a]P的解毒(当EPXH将水结合到环氧化物中形成二氢二醇时,GST使环氧化物与GSH结合,最终将以巯基酸的形式排出体外[55]),防止B[a]P诱导的结肠毒性。
异荭草素是一种天然黄酮类化合物,具有抗炎、抗癌、抗氧化、抗糖尿病、保肝等生物活性[56]。作者前期研究发现,异荭草素可以有效预防B[a]P诱导的结肠损伤,其在氧化系统中可作为自由基清除剂,并且可以通过提高SOD、谷胱甘肽过氧化物酶(GSH-Px)的活性,降低H2O2、丙二醛(MDA)的含量来抑制B[a]P诱导的结肠氧化损伤。此外,异荭草素还可通过抑制炎症相关因子TNF-α、IL-1β、IL-6、COX-2和iNOS的表达[57],调节B[a]P诱导的肠道菌群变化,缓解炎症。
3 展望
作者对不同食品中B[a]P的含量及其诱发结肠癌、结肠氧化损伤、结肠炎症、肠道菌群失调等各种结肠疾病的相关分子机制进行了综述。目前,关于饮食类型对B[a]P诱导的结肠毒性的影响已有部分相关研究,但仍需从多方面进行深入探究。在日常饮食中,除了要注意饮食搭配,保障营养均衡摄入外,还需注意食品加工方式对食品营养成分的影响,尽量避免营养成分被破坏和有害物质的形成。同时,应该保护环境,节约能源,对工业和生活中的废水、废气、废渣进行处理后再排放,避免环境中有害物质污染食品,进而危害人体健康。

表3 不同天然活性物质对B[a]P诱导的结肠毒性的影响Table 3 Effects of different natural bioactive substances on B[a]P induced colonic toxicity

