转基因抗虫水稻‘HD2’不同生长发育阶段cry2A*基因表达量
李荣田,于晓晨,孔梦莹,刘长华,3
(1黑龙江大学生命科学学院,黑龙江省普通高等学校分子生物学重点实验室,哈尔滨 150080;2黑龙江大学农业微生物技术教育部工程研究中心,哈尔滨 150080;3黑龙江大学现代农业与生态环境学院,哈尔滨 150080)
0 引言
水稻(Oryza sativa),是中国及世界重要的粮食作物[1]。螟虫特别是二化螟和三化螟的危害造成水稻严重减产,危害最大的二化螟在中国南北稻区都有分布[2]。黑龙江省是中国最大的粳稻产区,自1998年在五常市稻田首次发现二化螟以来,螟虫危害快速蔓延,逐年加重。中国每年投入大量人力、财力进行药剂防治水稻虫害,但虫害造成的损失仍然十分严重[3-4]。培育抗虫水稻品种是防治虫害最经济有效的措施[5-6]。由于水稻及其近缘种缺乏抗螟虫基因,利用传统杂交方法难以培育出抗虫品种。通过转基因技术将外源抗螟虫基因导入水稻中,为培育高抗螟虫水稻提供了新思路[7-8]。苏云金芽孢杆菌(Bacillus thuringiensis)是革兰氏阳性菌,可以形成Bt杀虫晶体蛋白,对鳞翅目害虫有很高的、专一的杀虫性,且不会对人类产生毒害[9-10]。cry2A是编码Bt蛋白质的基因之一,以cry2Aa基因为蓝本,在其编码蛋白质氨基酸顺序不变的条件下,根据水稻密码子偏爱性进行密码子优化并人工合成了cry2A*基因。转cry2A*基因籼稻表现出稳定的、较好的抗螟虫性[11]。水稻‘空育131’是北方粳稻及黑龙江省历史上年种植面积最大的常规品种,利用根瘤农杆菌Ti质粒介导法,将cry2A*基因导入水稻‘空育131’中,创制了转基因抗虫水稻‘HD2-1’等独立系。Bt植物的抗虫能力强弱与Bt蛋白含量(Bt Protein Content,BPC)有关。Bt水稻生长发育过程中外源目的基因表达是动态变化的,白耀宇等[12]研究发现,叶片及茎鞘BPC抽穗期较低,灌浆期显著升高;华桦[13]认为,叶片及茎鞘BPC孕穗期最高,然后逐渐降低;陈耕[14]报道,叶片BPC成熟期最高,茎鞘BPC分蘖期最高;于志晶等[15-16]认为,分蘖期、抽穗期以及灌浆期的叶片BPC差异并不大。不同研究关于Bt水稻外源目的基因表达量动态变化过程的研究结论存在着差异,其原因可能在于转基因Bt水稻材料及生长发育环境不同,外源基因表达能力不同,因此研究转cry2A*基因抗虫水稻‘HD2-1’等独立系在黑龙江省田间不同生长发育阶段目的基因的表达量是十分必要的。本研究将水稻‘HD2-1’等独立系种植在田间,分别于分蘖期、抽穗期及灌浆期检测有关器官cry2A*基因表达量以及糙米BPC,分析不同生长发育阶段外源目的基因表达量的关系,以期为培育及利用寒区转基因抗虫水稻品种奠定基础。
1 材料和方法
1.1 水稻
水稻材料为‘HD2-1’、‘HD2-2’、‘HD2-3’和‘HD2-4’等独立系。以早粳稻‘空育131’为受体,利用根瘤农杆菌Ti质粒介导的遗传转化法创制转Bt基因cry2A*早粳稻。携带cry2A*基因Ti质粒的T-DNA区见图1。遗传转化水稻以独立抗性愈伤组织系(下称独立系)为单位,在温室内以生长发育正常、外源基因bar和cry2A*等PCR检测阳性、抗除草剂Basta、Cry2A胶体金免疫层析试纸条检测阳性、室内高抗二化螟等为指标,每个独立系每个世代选择1株,直至稳定世代形成水稻‘HD2’,即为携带外源基因bar和cry2A*的转基因抗虫水稻。‘HD2-1’、‘HD2-2’、‘HD2-3’和‘HD2-4’等是来自于不同独立系的水稻‘HD2’。

图1 植物表达载体pbar-cry2A*的T-DNA区
受体水稻‘空育131’作对照。
1.2 Basta抗感性检测
培育供试水稻秧苗,秧苗3叶1心期用Basta处理。Basta即除草剂草丁膦或草铵膦,有效成分是膦丝菌素。将含膦丝菌素0.5%的Basta工作液均匀地喷施在供试水稻叶片上,连续7天观察水稻植株的变化并记录其抗感Basta情况[17]。
1.3 PCR检测
水稻‘HD2-1’、‘HD2-2’、‘HD2-3’和‘HD2-4’等独立系抗Basta的秧苗及对照‘空育131’的秧苗,每个供试水稻随机取5株,每株取1片嫩叶,用CTAB方法[18]提取DNA。对水稻DNA样品分别进行actin基因(内参基因)、bar基因及cry2A*基因的PCR检测。PCR所需的引物序列及预期产物大小如表1所示。
PCR反应体系:水稻模板DNA 1.5 μL,actin、bar或cry2A*正向引物 0.5 μL(10 μmol/L),actin、bar或cry2A*反向引物0.5 μL(10 μmol/L),2 ×TaqPCR Master Mix 5.15 μL,ddH2O 12.35 μL,总体积为20 μL。
PCR 扩 增程序(actin):94℃,3 min;94℃ 变性1 min,55℃退火1 min,72℃延伸1 min,35循环;72℃,8 min;4℃储存。
PCR扩增程序(bar或cry2A*):94℃,3 min;94℃变性 30 s,56℃退火 30 s,72℃延伸 1 min,32循环;72℃,8 min;4℃储存。
PCR完成后,在产物中加2 μL 6×loading buffer,经1%琼脂糖凝胶电泳检验条带的有无。
1.4 Cry2A胶体金免疫层析试纸条检测
供检测的水稻样品同1.3。利用武汉上成生物科技有限公司的Cry2A胶体金免疫层析试纸条检测水稻‘HD2’cry2A*基因是否表达Bt蛋白,操作步骤按胶体金免疫层析试纸条使用说明书进行。
1.5 本田试验设计及cry2A*基因表达量检测
1.5.1 试验设计 2020年正季,在黑龙江大学呼兰校区转基因水稻试验田(126°38'25.25"E,45°59'47.70"N)种植水稻‘HD2-1’、‘HD2-2’、‘HD2-3’和‘HD2-4’等独立系及对照‘空育131’。本田田间试验设计采用随机区组法,3次重复。小区6行区,行长5 m,插秧规格为行距30 cm,株距12 cm,每蔸插1棵秧苗,小区面积为9 m2。育苗、插秧、施肥、水管理、防病等与一般生产田相同,不进行二化螟等虫害防治。在水稻分蘖期、抽穗期和灌浆期,从田间每小区随机选取3蔸水稻,取每蔸主茎,将主茎分为最上部完全展开叶叶片、茎鞘及幼穗等3个器官,每个器官分别准确取100 mg及大约取20 mg左右2份,用灭菌的锡箔纸包好置液氮中保存,用于检测cry2A*基因的mRNA表达量及BPC。收获期田间每小区收获稻谷,室内充分干燥后加工成糙米,从各小区糙米中取出3份20 mg左右的样品用于检测糙米BPC。
1.5.2 mRNA表达量检测 实时荧光定量PCR方法检测供试水稻cry2A*基因mRNA表达量[19]。操作步骤如下。
(1)总RNA的提取:利用生工生物工程(上海)股份有限公司的UNIQ-10柱式Trizol总RNA抽提试剂盒,按照说明书提取水稻样品总RNA,检测总RNA的纯度及完整性并置于-80℃冰箱中保存备用。
(2)逆转录合成cDNA:用生工生物工程(上海)股份有限公司的M-MuLV第1链cDNA合成试剂盒,依据其说明书对RNA进行反转录合成cDNA。
(3)qRT-PCR:使用TaKaRa TB Green®Premix Ex Taq™II试剂盒,利用Bio-Rad iQTM2多重实时荧光定量PCR仪进行cry2A*基因的qRT-PCR检测。qRT-PCR内参基因actin的正向引物为5‘TCGTGTAGCACCAGAAGAGCA3’,反向引物为5‘TCCACTAGCATAGAGGGAAAGC3’;cry2A*目的基因的正向引物是5‘TTCCTGCTGAAGAAGGTGGGT3’,反向引物是 5‘ACGAGCGAGGGTGTCAGTGTT3’。qRT-PCR引物由生工生物工程(上海)股份有限公司合成。qRT-PCR 反应体系20 μL,水稻cDNA 2 μL,TB Green Premix ExTaqII 10 μL,actin或cry2A*基因正向引物(10 μmol/L)0.8 μL,actin或cry2A*基因反向引物(10 μmol/L)0.8 μL,ROX Reference Dye 0.4 μL,ddH2O 6 μL。qRT-PCR 扩增程序:95℃,3 min;(95℃,10 s;57℃,30 s),40个循环,实时采集荧光强度信号;95℃,1 min;57℃,1 min;57℃,10 s(温度变化范围 57~95℃),77个循环,自第2个循环开始每个循环上升0.5℃,实时采集荧光强度信号并形成溶解曲线。
(4)cry2A*基因mRNA表达量:以内参基因actin为标准,以水稻‘空育131’为对照,利用2-ΔΔCt法计算目的基因mRNA表达量[20]。
1.5.3 Cry2A蛋白含量检测 利用武汉上成生物科技有限公司“转基因Bt Cry2A酶联免疫定量检测试剂盒”检测水稻样品cry2A*基因BPC,具体步骤见参考李荣田等[21]的研究方法。
1.6 数据处理
每个小区不同生长发育阶段各器官的3个水稻样品为3次技术重复,cry2A*基因mRNA表达量及BPC 3次技术重复间差异不得大于5%,3次技术重复的平均值为小区值,以小区值进行差异显著性检测及相关分析。
2 结果与分析
2.1 水稻‘HD2’外源基因的整合及表达
Basta抗感性检测、PCR检测及Cry2A胶体金免疫层析试纸条检测结果见图2。由图2可知,在‘HD2-1’、‘HD2-2’、‘HD2-3’和‘HD2-4’等独立系各植株中都整合了bar及cry2A*基因,并且耐除草剂Basta及Cry2A蛋白阳性。说明水稻‘HD2’等独立系携带bar和cry2A*等外源基因,并且外源基因能够稳定表达。

图2 转基因水稻‘HD2’外源基因的整合及表达
2.2 水稻‘HD2’cry2A*基因表达量
转基因抗虫水稻‘HD2’不同生长发育阶段目的基因cry2A*的mRNA表达量见表2。由表2可知,在叶片和茎鞘中‘HD2’水稻cry2A*基因mRNA表达量生长发育前期相对较低,后期相对较高;幼穗中生长发育前期较高,后期较低。水稻分蘖期、抽穗期、灌浆期的各器官mRNA表达量在‘HD2-1’、‘HD2-2’、‘HD2-3’和‘HD2-4’之间存在着显著或极显著差异。

表2 水稻‘HD2’cry2A*基因mRNA表达量
转基因抗虫水稻‘HD2’不同生长发育阶段各器官Cry2A蛋白含量见表3。由表3可知,‘HD2’水稻成熟期糙米中的Cry2A蛋白含量与生长发育过程组织器官BPC比较是最低的;在叶片、茎鞘中,Cry2A蛋白含量最高的生长发育时期为灌浆期,其次为抽穗期、分蘖期;在幼穗中,Cry2A蛋白含量最高的生长发育时期是抽穗期,其次是灌浆期。水稻分蘖期、抽穗期、灌浆期各器官及糙米的BPC在‘HD2-1’、‘HD2-2’、‘HD2-3’和‘HD2-4’等独立系间存在着极显著差异。

表3 水稻‘HD2’Cry2A蛋白含量
2.3 水稻‘HD2’cry2A*基因表达量不同生长发育阶段间的关系
转基因抗虫水稻‘HD2’不同生长发育阶段cry2A*基因表达量关系见图3。图3A显示,‘HD2’水稻cry2A*基因mRNA表达量,在叶片中,分蘖期与抽穗期、抽穗期与灌浆期及分蘖期与灌浆期之间呈显著正相关;在茎鞘中,分蘖期与灌浆期之间呈显著正相关,分蘖期与抽穗期、抽穗期与灌浆期之间呈正相关趋势;在幼穗中,抽穗期与灌浆期呈显著正相关。说明,转cry2A*基因抗虫水稻‘HD2’组织器官的cry2A*基因mRNA表达量在不同生长发育阶段间具有正向关系,前期目的基因mRNA表达量高,后期往往也高。

图3 水稻‘HD2’cry2A*基因表达量在不同生长发育阶段间的关系
图3B显示,‘HD2’水稻Cry2A蛋白含量在叶片中,分蘖期与抽穗期呈显著正相关,抽穗期与灌浆期及分蘖期与灌浆期之间有正相关趋势;在茎鞘中,分蘖期与抽穗期、抽穗期与灌浆期之间呈显著正相关,分蘖期与灌浆期之间呈正相关趋势;在幼穗中,抽穗期与灌浆期呈显著正相关。这表明,转cry2A*基因抗虫水稻组织器官中BPC在不同生长发育阶段具有正相关关系,前期Bt含量高,后期含量往往也高。
2.4 水稻‘HD2’cry2A*基因mRNA表达量和BPC的关系
水稻‘HD2’各器官不同生长发育阶段cry2A*基因mRNA表达量和BPC的关系见图4。图4显示,在叶片、茎鞘及幼穗等器官中,cry2A*基因mRNA表达量和BPC均呈极显著的正向直线关系。这说明,在转cry2A*基因抗虫水稻整个田间生长发育时期,器官组织中目的基因转录水平表达量高,翻译水平表达量通常也高。同时,暗示着水稻‘HD2’cry2A*基因mRNA及其蛋白质在水稻细胞中具有稳定性。
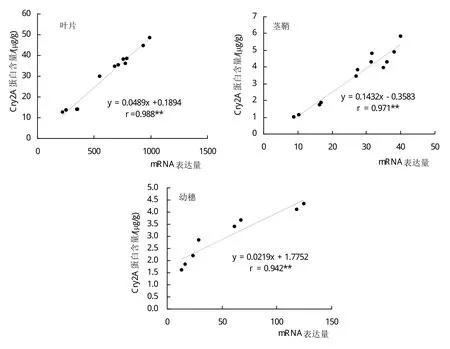
图4 水稻‘HD2’生长发育过程cry2A*基因mRNA表达量和BPC的关系
2.5 水稻‘HD2’糙米BPC与cry2A*基因表达量的关系
水稻‘HD2’糙米BPC与不同生长发育阶段各器官cry2A*基因表达量的关系见图5。图5A显示,水稻‘HD2’糙米BPC与分蘖期叶片和茎鞘、抽穗期幼穗及灌浆期叶片cry2A*基因mRNA表达量呈显著正相关,与灌浆期茎鞘和幼穗cry2A*基因mRNA表达量呈极显著正相关,与抽穗期叶片和茎鞘的cry2A*基因mRNA表达量有正相关趋势。这表明,转cry2A*基因抗虫水稻糙米BPC和生长发育过程中的组织器官里的目的基因转录水平具有正相关关系,特别是与生长发育中后期的幼穗目的基因转录水平的正相关关系更紧密。

图5 水稻‘HD2’糙米BPC与不同生长发育阶段cry2A*基因表达量的关系
由图5B可知,水稻‘HD2’糙米BPC与分蘖期及抽穗期的叶片Cry2A蛋白含量呈正相关趋势,与分蘖期的茎鞘、抽穗期的茎鞘和幼穗及灌浆期的叶片、茎鞘和幼穗Cry2A蛋白含量呈显著或极显著的正相关。这说明,转cry2A*基因抗虫水稻‘HD2’糙米BPC与生长发育过程中的组织器官的BPC具有正相关关系,特别是与生长发育中后期的目的基因翻译水平表达量正相关关系更明显。
3 结论
转基因抗虫水稻‘HD2-1’、‘HD2-2’、‘HD2-3’和‘HD2-4’等不同的独立系,田间不同生长发育阶段各器官cry2A*基因mRNA表达量及其蛋白质含量明显不同,糙米BPC也存在着明显差异。叶片、茎鞘及幼穗等器官cry2A*基因表达量在不同生长发育阶段间具有正相关或正相关趋势,前期表达量高的材料往往后期表达量也高。
水稻‘HD2’田间生长发育期间组织器官cry2A*基因mRNA表达量和BPC呈极显著的正相关关系,目的基因转录水平表达量高,翻译水平表达量也高。
水稻‘HD2’糙米BPC与田间生长发育时期的叶片、茎鞘及幼穗等器官cry2A*基因mRNA表达量、BPC具有正相关或正相关趋势,田间生长发育时外源目的基因表达量高,糙米BPC往往也高。
4 讨论
关于Bt植物目的基因表达量不同生长发育阶段间的关系,转基因杨树叶片Bt基因的转录及翻译水平表达量在前期和后期间均存在正相关[22],Bt棉主茎功能叶BPC在不同生长阶段间未见正相关关系[23]。本研究显示,转基因抗虫水稻‘HD2-1’等独立系叶片、茎鞘及幼穗cry2A*基因mRNA表达量和BPC在不同生长发育阶段间存在正相关关系。关于Bt植物目的基因mRNA表达量和BPC的关系,夏兰芹等报道,Bt棉目的基因mRNA和Bt杀虫蛋白含量存在正相关趋势,但未达显著水平[24]。孙玥研究不同受体品种的转Bt基因水稻抽穗期叶片、茎秆及颖壳中Bt基因mRNA表达量与BPC间的关系,发现了与Bt棉类似的现象,即目的基因转录水平和翻译水平表达量存在着正相关趋势[25]。但是,本研究结果表明,水稻‘HD2-1’等独立系生长发育过程中组织器官中Bt基因mRNA表达量和BPC呈极显著的正相关关系。本研究的抗虫转基因水稻独立系是同一个受体品种、具有相同的外源基因卡盒、来自于不同的转化事件,最大程度地排除了基因表达框架和遗传背景差异的影响,研究结果可能更符合客观情况。种植在田间的、同一受体品种及T-DNA区的不同的转基因水稻,外源基因转录或翻译水平生长发育前期表达量高、中后期往往也高,生长发育过程中目的基因转录水平表达量高、翻译水平表达量也高。
Bt水稻目的基因蛋白含量与田间抗虫性呈正相关,BPC太低的转基因水稻没有抗虫性[26],当BPC超过一定阈值时,植株田间均表现为高抗虫性[21]。本研究中的水稻材料经过了抗二化螟选择,虽然不同材料cry2A*基因表达量不同,但是是在较高表达量范畴的差异。糙米是水稻重要的经济器官,本研究显示转基因抗虫水稻糙米BPC和田间生长发育时外源目的基因表达量存在正相关。从稻米消费者的心理角度出发,在培育转基因抗虫水稻品种工作中,需要注意“高中选低”,即从外源目的基因表达量较高的抗虫材料中选择表达量较低的基因型。

