阴沟肠杆菌乳酸脱氢酶基因缺失突变株的构建及其生物学特性
石会玲,周宇航,何 平,黄蒙蒙,邵 帅,葛菁萍,凌宏志
(1黑龙江大学生命科学学院微生物重点实验室,哈尔滨 150080;2黑龙江大学农业微生物技术教育部工程研究中心,哈尔滨 150500)
0 引言
乙偶姻(AC)又称3-羟基丁酮或甲基乙酰甲醇[1],具有特殊的奶油香味,自然存在于干酪、香蕉、可可、玉米、葡萄、苹果和肉类等食品中[2-3],乙偶姻的应用范围极其广泛,为满足社会的需求,目前有大量的学者对于乙偶姻的生产方法及产量进行研究[4-5]。微生物以糖类物质为底物发酵生产乙偶姻是比较典型的发酵途径,葡萄糖通过磷酸转移酶系统(PTS)被细胞利用,其中除部分碳源供菌体生长以外,还会形成一系列的中间代谢产物和副产物,如乳酸、乙酸、丁二酸、乙醇、2,3-丁二醇和乙偶姻等[6-7]。在发酵过程中,这些副产物的产生不仅消耗了代谢过程中产生的能量,而且对乙偶姻的产量积累产生不利的影响,增加了下游工程中乙偶姻分离纯化的难度[8-11]。因此,对乙偶姻代谢支路副产物的相关关键酶基因敲除成为基因工程改造提高乙偶姻产量的主要策略之一[12-16]。
自杀质粒同源重组技术是将构建好的自杀敲除质粒,通过细菌接合的方法进入到受体菌中[17]。将扩增的外源的目的基因同源重组片段插入到自杀质粒当中,利用自杀质粒可以在供体菌中复制,但不可以在受体菌中复制特点,通过细菌接合的方式使自杀质粒进入到受体菌中[18]。在重组酶的作用下,使自杀质粒上的线性打靶片段与染色体的特定目的基因序列发生同源重组,目的基因被置换下来,然后利用自杀质粒上的抗生素筛选标记筛选单交换阳性转化子[19-20]。接合同源重组作为一种基因敲除手段,由于接合的方法对于分子量大的质粒的转化具有很好的效果、适用范围广及敲除效率高等特点在原核生物的菌种改造方面有着极为广泛的应用[21]。
本研究以实验室保藏的阴沟肠杆菌(E.cloacae)作为出发菌株,对该菌种进行乳酸脱氢酶ldh基因进行敲除,对原始菌株进行基因改造,构建敲除ldh基因的阴沟肠杆菌(E.cloacae△ldh)并对其生物特性进行初步研究。通过本课题的研究,利用接合同源重组技术生产乙偶姻,为构建高效、稳定的生产乙偶姻工程的菌株奠定了良好的技术基础。同时采用了同源重组技术,这也为利用分子手段进行菌株改造探索了方法,为今后相关微生物发酵工程菌株的获得及大规模工业生产提供技术支持和菌种保障。
1 材料与方法
1.1 材料
1.1.1 实验菌株 阴沟肠杆菌E.cloacae,大肠杆菌E.coli DH5α以及大肠杆菌E.coli S17-1 λpir均来自于黑龙江大学微生物重点实验室,用于ldh左右同源臂的克隆转化和与E.cloacae接合。
1.1.2 实验质粒 pMD18-T购自大连宝生物工程有限公司,用于克隆载体;自杀质粒pKR6K由黑龙江大学微生物重点实验室保存;质粒pT-ldh和pKR6K-△L均自行构建,用于克隆ldh上下游片段和敲除ldh基因自杀质粒。
1.1.3 酶与试剂 1.1×T3 Super PCR Mix(TSE030)购自北京擎科新业生物技术有限公司,TranStart®FastPfu DNA polymerase(AP221-01)、2.5 mmol/L High Pure dNTPs(AD101-1)购自北京全式金生物技术有限公司,限制性核酸内切酶BamHI(R0136V)、EcoRI-HF(R3101V)、XbaI(R0145V)、SphI(R0182V)、SalI-HF(R3138V)、HindIII-HF(R3104V)均购自 New England Biolabs公司。普通琼脂糖凝胶DNA回收试剂盒(DP209-02)、质粒小提试剂盒(货号DP103-02)及细菌基因组DNA(小量)提取试剂盒(DP302-02)均购自北京天根生化科技有限公司。Taq DNA polymerase、DNA Ligation Kit Ver.2.1(6022Q)、异丙基硫代半乳糖苷(IPTG)、5-溴-4-氯-3-吲哚-β-D半乳糖苷(X-gal)、氨苄青霉素(Amp)、卡那霉素(Kan)、DL2000 Marker(3427A)、DL5000 Marker(3582Q)、DL15000 Marker(3582A)购自大连宝生物工程有限公司。
1.1.4 扩增引物 根据NCBI数据库中E.cloacae的基因组序列信息,利用Snapgene设计实验所用的PCR引物,用于克隆ldh基因以及验证敲除结果,如表1所示。

表1 引物序列
1.1.5 培养基 LB(Luria-Bertani)培养基(g/L):NaCl 10,酵母提取物 5,蛋白胨 10,pH 7.0,121℃高压灭菌15 min,固体培养基添加2%的琼脂粉,用于本研究细菌的培养。
种子培养基(g/L):K2HPO44.4,KH2PO41.3,(NH4)2SO42,MgSO4·7H2O 0.2,酵母浸粉1,加入蒸馏水定容至1 L,调节pH 7.0,121℃高温高压灭菌15 min。将上述已灭菌的溶液加入到经108℃高压灭菌20 min的40 g葡萄糖中,用于阴沟肠杆菌的培养;加入到经108℃高压灭菌20 min的60 g葡萄糖中,用于阴沟肠杆菌生产乙偶姻的发酵实验。
1.2 方法
1.2.1 出发菌株E.cloacae基因提取 将经过菌株活化和复壮后的E.cloacae接种到LB液体培养基中,35℃,140 r/min的条件下培养至对数期,利用细菌基因组DNA提取试剂盒分别提取2株菌体的基因组。
1.2.2ldh基因上下游片段的克隆与测序 用表1的引物对ldh基因上下游片段进行PCR扩增,PCR反应体系和反应程序如表2和表3所示。以pMD18-T载体为连接骨架,分别将加“A”后的ldh1基因和ldh2基因PCR产物与其在16℃金属浴中过夜连接,进行“TA”克隆,将重组质粒命名为pT-ldh1和pT-ldh2。

表2 ldh1和ldh2 PCR反应体系组分

表3 ldh1和ldh2 PCR反应程序
1.2.3 pKR6K-△L敲除质粒的构建 利用内切酶EcoRI和BamHI对pT-ldh1和自杀质粒pKR6K分别进行双酶切,在37℃条件下反应120 min,将回收片段ldh1通过T4连接酶插入到线性载体pKR6K(EcoRI、BamHI)中,16℃过夜连接。在插入ldh1片段的相邻位置,选择内切酶XbaI和SalI分别对pT-ldh2和插入到线性载体pKR6K-ldh1(XbaI、SalI)过程中进行酶切处理,这样ldh1-ldh2部分就组成了敲除ldh基因的同源重组片段,同时得到ldh基因敲除质粒pKR6K-△L。整体构建策略如图1所示。

图1 基因敲除质粒pKR6K-△L完整构建策略
1.2.4E.cloacae和E.cloacae△ldh菌株的生长情况的测定 出发菌株E.cloacae和重组菌株E.cloacae△ldh以1%接种量分别接种到100 mL/250 mL种子液培养基中35℃,140 r/min培养至对数生长期,以1%接种量分别转接到100 mL/250 mL发酵培养基中,35℃,140 r/min发酵48 h后结束。分别在0、2、4、8、12、24、36、48 h取样,将样品稀释10倍进行其pH和OD600处的吸光值的测定。绘制菌株生长情况及发酵液的pH的变化曲线。
1.2.5E.cloacae和E.cloacae△ldh菌株的发酵产物及底物消耗情况检测试验 将E.cloacae和E.cloacae△ldh甘油管接种到种子培养基中扩大培养(35℃,140 r/min),在12 h后,以1%的接种量将种子培养基中的菌液接种到发酵培养基中,发酵48 h。温度35℃,转速140 r/min。分别在0、2、4、8、12、24、36、48 h取样。样品经处理后,经高效液相色谱(HPLC)检测乙偶姻等相关代谢产物的产量以及底物的剩余浓度。
1.2.6 试验数据的统计学分析 运用SPSS Statistics19软件对本试验所有样本重复的试验数据进行统计学分析,试验数据均以X±SD表示,均数间的比较采用差异显著性分析,ldh0.05为差异显著。
2 结果与分析
2.1 E.cloacae基因组提取
原始菌株E.cloacae进行基因组提取,对提取的样品进行1%琼脂糖凝胶电泳检测,如图2所示,在15 kb的上方有一条清晰的条带,说明E.cloacae基因组提取成功。
图2 E.cloacae基因组DNA
2.2 ldh基因上下游片段的克隆及测序
以上述提取的原始菌株E.cloacae基因组DNA为模板,利用引物ldh1F、ldh1R和ldh2F、ldh2R分别对目的基因ldh1和ldh2进行PCR扩增,扩增产物大小均为526 bp(图3),与预期结果一致。

图3 ldh1和ldh2片段扩增结果
将扩增产物分别与克隆载体pMD18-T连接,通过热激法转化到E.coliDH5α感受态细胞中,提取菌株质粒分别进行HindIII单酶切验证,以1%琼脂糖凝胶电泳进行检测,在2500 bp和5000 bp中间有一清晰的条带,长度大小与扩增产物ldh1、ldh2(506 bp)和pMD18-T(2692 bp)之和(3218 bp)相符,证明目的基因ldh1、ldh2已连接到克隆载体(图4)。

图4 HindIII酶切结果
2.3 pKR6K-△L敲除质粒的构建
以限制性内切酶EcoRI和BamHI对质粒pT-ldh1和pKR6K进行双酶切,1%琼脂糖凝胶电泳进行检测,酶切结果如图5所示,质粒pT-ldh1和pKR6K被完全酶切。通过T4连接酶连接pKR6K(EcoRI和BamHI,5199 bp)与ldh1(EcoRI和BamHI,506 bp),连接产物通过热激法转化到E.coliS17-1感受态细胞中。

图5 EcoRI和BamHI酶切结果
提取质粒pT-ldh2和pKR6K-ldh1,以限制性内切酶XbaI和SalI对上述质粒进行双酶切,pT-ldh2酶切结果如图6所示,质粒pT-ldh2和pKR6K-ldh1被完全酶切。通过T4连接酶连接pKR6K-ldh1(XbaI和SalI,5699 bp)与ldh2(XbaI和SalI,506 bp),连接产物通过热激法转化到E.coliS17-1感受态细胞中。

图6 XbaI和SalI酶切结果
2.4 E.cloacae乳酸脱氢酶(ldh)基因缺失菌株的筛选
E.cloacae中ldh基因单交换菌株的筛选结果如图7所示,将发生单交换重组的E.cloacae接种于含10%蔗糖不含NaCl的LB培养基中35℃过夜培养后,涂布于含10%蔗糖不含NaCl的LB固体培养基上,35℃过夜培养,对长出的菌落进行菌落PCR验证,利用发生重组部分的外侧引物ldh-up和ldh-down进行PCR反应,如图8所示,同源重组片段ldh1-ldh2已完全整合到宿主菌E.cloacae的染色体基因组上。

图7 E.cloacae中ldh基因单交换菌株的筛选

图8 E.cloacae△ldh突变株筛选结果
2.5 E.cloacae与E.cloacae△ldh的生长情况
对E.cloacae和E.cloacae△ldh进行摇瓶发酵试验(E.cloacae作为对照菌株),结果如图9所示。敲除ldh基因对E.cloacae的生长情况并无明显影响,二者均在12 h时达到最大值,OD600值在0.85左右。两者的pH值变化均处于下降趋势,稳定在5.6左右。

图9 E.cloacae与E.cloacae△ldh的生长情况
2.6 E.cloacae与E.cloacae△ldh的发酵产物及底物消耗情况测定
通过HPLC测定乙偶姻、2,3-丁二醇、底物葡萄糖以及乳酸浓度,结果如图10所示。由发酵结果显示,出发菌株E.cloacae与重组菌株E.cloacae△ldh的葡萄糖均在12 h时基本耗尽,直至24 h消耗完全,菌株的OD600随葡萄糖的消耗而增加,重组菌株在12 h时,2,3-丁二醇的产量达到最大值为18.28±0.42 g/L,此时出发菌株的2,3-丁二醇产量为17.11±0.51 g/L,由此可知敲除ldh基因使2,3-丁二醇的产量提高了6.8%,差异显著(ldh0.05)。在原始菌株中12 h时,乳酸产量达到最大值为2.85±0.21 g/L;重组菌株E.cloacae△ldh在24 h时丁二酸的产量最高为2.46±0.10 g/L,而出发菌株在48 h时丁二酸的产量最大,为2.08±0.24 g/L,因此丁二酸的产量提高了18.3%,差异显著(ldh0.05)。

图10 E.cloacae与E.cloacae△ldh的发酵产物及底物消耗情况结果
出发菌株E.cloacae与重组菌株E.cloacae△ldh各产物产量如表4所示。出发菌株E.cloacae在12 h时,乳酸产量最大,为2.85±0.21 g/L;E.cloacae△ldh发酵过程中2,3-丁二醇的最大产量为18.28±42 g/L,比E.cloacae产生的17.11±0.51 g/L提高了6.8%,但乙偶姻的产量变化不大,差异不显著(P>0.05)。此外,丁二酸的产量由原来的2.08±0.24 g/L提高到2.46±0.10 g/L,提高了18.3%,差异显著(ldh0.05)。乙酸产量由2.92±0.20 g/L提高到3.63±0.29 g/L,提高了24.3%,差异显著(ldh0.05)。乙醇的产量变化不大,差异不显著(P>0.05)。
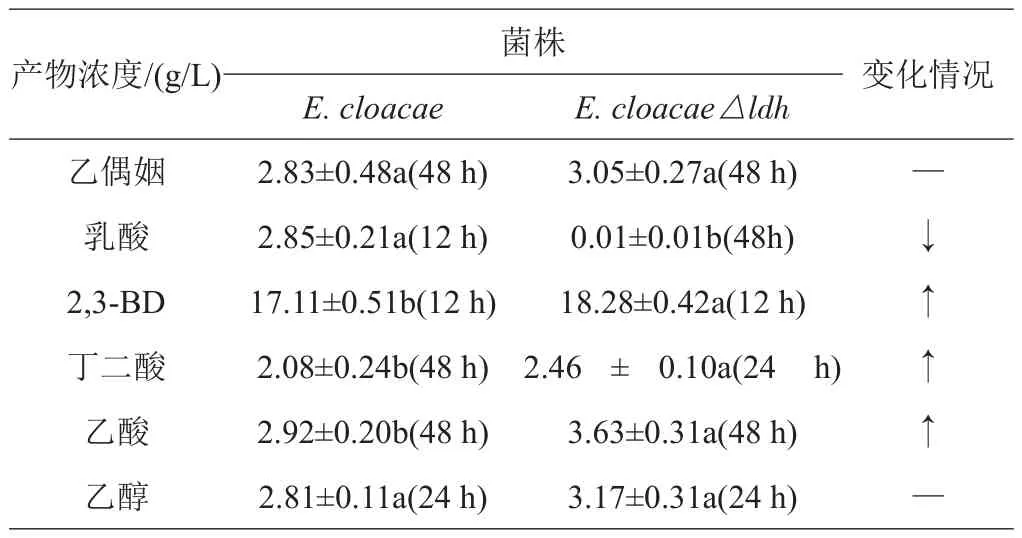
表4 E.cloacae和E.cloacae△ldh的摇瓶发酵产物的比较
3 讨论
随着20世纪80年代提出可持续发展概念以来,人们对于环境与资源的保护意识的日益提高,乙偶姻作为一种重要的平台化合物,其在各个领域均被广泛应用[22]。在自然界中,许多微生物的代谢产物中都发现了乙偶姻的存在。提高乙偶姻的产量可以从以下几个方面进行研究,阻止乙偶姻的进一步代谢,阻断其他分支代谢路径以及加强乙偶姻合成的关键酶基因的表达[23]。Zhang等[24]敲除阴沟肠杆菌(Enterobacter cloacae)SDM53中2,3-丁二醇(2,3-BD)脱氢酶基因budC,运用分批补料的方法,以木质纤维素水解产物最为底物,乙偶姻产量可达45.6 g/L,乙偶姻产量得到明显提高。Hillman等[25]发现在以葡萄糖为碳源发酵时,野生型变形链球菌(Streptococcus mutans)与乳酸脱氢酶缺陷型突变体相比,乳酸脱氢酶缺陷型突变体的乙偶姻产量远高于野生型。Liu等[26]通过敲除丙酮丁醇梭菌(Clostridium acetobutylicum)中编码乙酰乙酸脱羧酶的基因adc,使得乙偶姻得率提高了37.5%。饶志明等[27]对野生型枯草芽孢杆菌(Bacillus subtilis)JNA中葡萄糖-6-磷酸脱氢酶基因zwf进行过表达,以150 g/L葡萄糖对重组菌株进行发酵实验,乙偶姻产量为71.4 g/L,乙偶姻产量相比于出发菌株提高了84%,2,3-丁二醇产量为2.4 g/L,相比于出发菌株下降了86%。Xu等[28]在大肠杆菌(Escherichia coli)中过量表达源于粘质沙雷氏菌(Serratia marcescens)的butB与butA基因,对重组菌株通过5 L发酵罐进行分批补料发酵,D-(-)-乙偶姻的最大产量达到60.3 g/L,产率为86.3%。
本试验以阴沟肠杆菌(Enterobacter cloacae)SDM作为出发菌株,使用自杀质粒pKR6K构建基因敲除载体,通过细菌接合的方式敲除载体转化进入受体菌中进行同源重组的基因敲除,构建了乳酸合成途径中乳酸脱氢酶缺失重组菌株E.cloacae△ldh。以60 g/L葡萄糖为底物,同时对E.cloacae和E.cloacae△ldh菌株进行摇瓶发酵培养后,利用高效液相色谱(HPLC)对发酵产物进行检测,出发菌株乙偶姻产量为2.83±0.48 g/L,发现改造后的E.cloacae△ldh的乙偶姻产量为3.05±0.27 g/L,相比于出发菌株E.cloacae△ldh乙偶姻产量无明显变化;E.cloacae乙偶姻的转化率(0.05±0.01 g/g)与生产强度(0.06±0.01 g/L·h)和E.cloacae△ldh乙偶姻的转化率(0.05±0.01 g/g)与生产强度(0.06±0.01 g/L·h)相比并没有变化。敲除ldh基因虽然没有对乙偶姻产量造成显著影响,但丁二酸的产量提高18.3%,2,3-丁二醇也有小幅度的提升,这说明敲除ldh基因虽然没有使乙偶姻的产量提高,但由于阻断了乳酸代谢途径,也使碳源流向了其他的代谢路径。重组菌株E.cloacae△ldh中几乎没有检测到乳酸的产生,进一步说明ldh基因成功敲除,使重组菌株不产生乳酸。
4 结论
本试验为探索敲除阴沟肠杆菌(E.cloacae)中ldh基因对乙偶姻形成路径中含量的的影响,以实验室保藏的阴沟肠杆菌(Enterobacter cloacae)SDM作为出发菌株构建E.cloacae△ldh,得到结论如下:成功克隆出两段E.cloacae乳酸脱氢酶基因的同源序列,长度分别为526 bp,通过序列比对分析,E.cloacae乳酸脱氢酶基因序列相似性为100%。通过对E.cloacae进行乳酸脱氢酶基因的敲除,成功构建一株ldh缺失重组菌株E.cloacae△ldh,乙偶姻产量虽无明显变化,但发酵液中并没有检测到乳酸,同时2,3-丁二醇提高6.8%,乙酸提高了24.3%。

