miR-148a靶向STAT3对宫颈癌HeLa细胞顺铂化疗敏感度的增强作用
汤良君,孙艳,张晓红,盛少琴
0 引言
宫颈癌是全球常见的妇科恶性肿瘤之一,近年来发病率逐渐升高,且呈年轻化趋势发展[1]。目前,手术前后辅助化疗被认为是治疗宫颈癌有效的治疗方法之一,顺铂作为化疗的常用药物,在宫颈癌新辅助化疗方案中作为基础药物被广泛应用,然而,顺铂具有的肾、耳、血液、胃肠道等不良反应限制了化疗效果[2-3]。因此,寻找可增强宫颈癌顺铂敏感度的基因靶点药物,对降低顺铂用量、减轻不良反应具有重要的应用价值。微小RNA(microRNA,miRNA)是一类小分子非编码单链RNA,通过从转录后水平调控靶基因表达,广泛参与细胞的生长、分化、增殖、凋亡等过程[4]。研究发现,肾癌、乳腺癌等多种类型癌细胞的化疗敏感度均与miR-148a表达相关[5-6],但miR-148a与宫颈癌顺铂耐药的关系尚不明确。信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)参与宫颈癌的发生发展,抑制STAT3通路可提高宫颈癌顺铂敏感度[7]。miRTarBase数据库预测发现,STAT3是miR-148a的潜在靶点,其靶向关系在非小细胞肺癌中已有研究,但在宫颈癌中尚无定论[8]。HeLa细胞是宫颈癌细胞中最为稳定且增殖迅速的细胞系,故本研究将通过调控miR-148a表达,探讨miR-148a靶向STAT3对宫颈癌HeLa细胞顺铂化疗敏感度的影响。
1 材料与方法
1.1 试剂与仪器
人HeLa细胞(货号:HZ-H496)购自美国ATCC细胞库;胎牛血清(货号:0025)购自美国ScienCell公司;顺铂(货号:D8810)购自北京索莱宝科技有限公司;DMEM培养基(货号:KL-P0032)购自德国Merck/Sigma公司;Lipofectamine 2000转染试剂(货号:11668019)购自美国Invitrogen公司;实时荧光定量PCR(qRTPCR)试剂盒(货号:K1002S)、pGL3-basic vector(货号:E1751)购自美国Promega公司;miR-control、miR-148a mimic、nonsense inhibitor、miR-148a inhibitor及miR-148a、STAT3、U6、β-actin引物均由生工生物工程(上海)股份有限公司设计合成;MTT溶液(货号:N/A-896)购自美国AMEKO公司;AnnexinV-FITC/PI细胞凋亡检测试剂盒(货号:S0185)购自哈尔滨新海基因检测有限公司;p-STAT3抗体、STAT3抗体、CyclinD1抗体、Bcl-2抗体、Bax抗体、Cleaved caspase-3抗体、GAPDH抗体、羊抗兔lgG(货号:ab76315、ab119352、ab226977、ab194583、ab81083、ab2302、ab59164、ab6717)均购自美国Abcam公司;双荧光素酶报告基因检测试剂盒(货号:SLDL-100)购自美国BioAssay Systems公司。培养箱(型号:MIR-162-PC/MIR-262-PC)购自日本松下公司;荧光定量PCR仪(型号:ABI 7500)购自美国Applied Biosystems公司;酶标仪(型号:Stat Fax-2100)购自美国Awareness公司;流式细胞仪(型号:Guauasoft 6L)购自美国Millipor公司。
1.2 实验方法
1.2.1 细胞培养 用含10%胎牛血清、1%双抗的DMEM培养基培养HeLa细胞,并置于37℃、5%CO2培养箱中常规培养,细胞融合至80%左右时消化、传代,取对数生长期细胞进行实验。
分为对照组(细胞不进行转染)、mimic对照组、miR-148a mimic组、inhibitor对照组和miR-148a inhibitor组。除对照组外,其他组均使用Lipofectamine 2000转染试剂分别转染miR-control、miR-148a mimic、nonsense inhibitor和miR-148a inhibitor。转染步骤:细胞在转染前一天消化、计数铺24孔板,用含血清DMEM培养基培养,使之在转染日密度达90%,并替换为无血清培养基培养;分别取0.8~1.0 µg转染物miR-control、miR-148a mimic、nonsense inhibitor和miR-148a inhibitor并用50 µl DMEM培养基稀释;取2 µl转染试剂Lipofectamine 2000并用DMEM培养基稀释,5 min内与转染物稀释液混合,室温保温20 min后加入每孔中轻轻摇匀,置于37℃、5%CO2培养箱中培养48 h。
1.2.2 qRT-PCR法检测HeLa细胞中miR-148a和STAT3的表达 将转染后的各组HeLa细胞以1×105个/毫升接种于96孔培养板,每孔100 μl,培养48 h后收集细胞,使用TRIzol试剂提取细胞总RNA,反转录试剂盒合成cDNA,qRT-PCR试剂盒检测细胞中miR-148a、STAT3 mRNA表达水平,U6、β-actin为内参基因。反应条件:95℃预变性30 s;95℃变性5 s,60℃退火35 s,循环40次。miR-148a上游引物:5'-TCTGAGACACTCCGACTCTGA-3',下游引物:5'-CTGGCGTCTGGAGCACTG-3';STAT3上游引物:5'-ACTCCATCGCTGACAAAA-3',下游引物:5'-CAGTGACCAGGCAGAAGA-3';U6上游引物:5′-CTCGCTTCGGCAGCACA-3′,下游引物:5′-AACGCTTCACGAATTTGCGT-3′;β-actin上游引物:5′-TCCCATCACCATCTTCCAG -3′,下游引物:5′-GGTATCCATCGCCATGCTC-3′。结果分析采用2-ΔΔCt法表示。
1.2.3 MTT法检测HeLa细胞增殖 将未转染的HeLa细胞及转染后的各组HeLa细胞以1×105个/毫升接种于96孔培养板,每孔100 μl,未转染的HeLa细胞用不同浓度的顺铂(0、1、2、4、8、16、32、64、128 μmol/L)处理48 h,转染后的各组HeLa细胞用4 μmol/L顺铂处理48 h,每孔加50 μl 5 mg/ml的MTT溶液,置于培养箱继续培养4 h,弃培养液,每孔加入150 μl DMSO,充分溶解后终止反应,根据酶标仪450 nm处测定的各孔吸光度OD值,计算细胞增殖抑制率,增殖抑制率=(OD对照组-OD实验组)/OD对照组×100%。
1.2.4 流式细胞仪检测HeLa细胞凋亡情况 将转染后的各组HeLa细胞以1×105个/毫升接种于96孔培养板,每孔100 μl,4 μmol/L顺铂处理48 h后收集细胞,胰酶消化后再次收集,加入400 μl Binding Buffer将细胞重悬,依次加入Annexin V-FITC、PI各5 μl,混匀,避光孵育15 min,流式细胞仪检测细胞凋亡情况。
1.2.5 流式细胞仪检测HeLa细胞周期分布 将转染后的各组HeLa细胞以1×105个/毫升接种于96孔培养板,每孔100 μl,4 μmol/L顺铂处理48 h后收集细胞,PBS洗涤,每孔加900 μl 75%乙醇固定过夜,离心收集细胞,PBS洗涤后每孔加500 μl RNase A/PI(50 μg/ml RNase A,50 μg/ml PI)重悬,避光放置20 min,流式细胞仪检测细胞周期分布情况。
1.2.6 Western blot法检测HeLa细胞中STAT3通路相关蛋白表达 将转染后的各组HeLa细胞以1×105个/毫升接种于24孔培养板,每孔300 μl,4 μmol/L顺铂处理48 h后收集细胞,加裂解液置于冰上裂解30 min,1200 r/min离心10 min后加200 μl Loading Buffer,100℃煮沸10 min,用BCA蛋白测定试剂盒测定蛋白浓度。10%SDS-PAGE电泳分离蛋白质,半干法转至PVDF膜上,用含5%脱脂奶粉的TBST封闭1.5 h,加入一抗(p-STAT3抗体、STAT3抗体、Cyclin D1抗体、Bcl-2抗体、Bax抗体、Cleaved caspase-3抗体、GAPDH抗体,1:1000)孵育过夜,TBST洗涤3遍,加二抗(羊抗兔,辣根过氧化物酶标记,1:2000)孵育1 h,TBST洗膜3遍,曝光显影,BandScan图像分析系统扫描图像并分析条带灰度,计算目的蛋白与内参蛋白的灰度值比值。
1.2.7 双荧光素酶报告基因实验验证miR-148a与STAT3的靶向作用关系 利用miRTarBase网站预测miR-148a与STAT3的靶向关系及潜在结合位点。构建STAT3的野生型、突变型3'UTR-荧光素酶表达载体(STAT3-WT和STAT3-MUT),利用脂质体转染技术将其分别与miR-control、miR-148a mimic共同转入HeLa细胞中,48 h后用双荧光素酶报告基因检测试剂盒测定荧光素酶活性,以萤火虫与海肾荧光素酶活性比值表示荧光素酶相对活性。
1.3 统计学方法
采用SPSS19.0版统计软件进行数据分析。所得数据以均数±标准差(x±s)表示,两组比较采用t检验,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 转染后各组HeLa细胞中miR-148a和STAT3的表达
转染后,与对照组相比,mimic对照组、inhibitor对照组HeLa细胞中miR-148a、STAT3 表达水平差异无统计学意义(P=0.980、0.999,P=0.999、0.999);与mimic对照组相比,miR-148a mimic组HeLa细胞中miR-148a表达水平显著升高(P=0.000),STAT3表达水平显著降低(P=0.000);与inhibitor对照组相比,miR-148a inhibitor组HeLa细胞中miR-148a表达水平显著降低(P=0.000),STAT3表达水平显著升高(P=0.000),见图1。
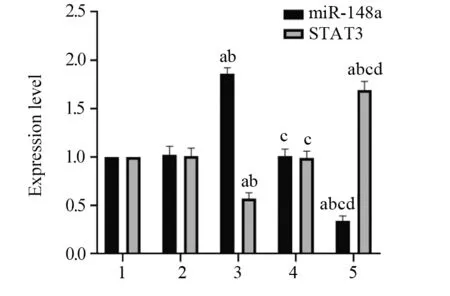
图1 转染后各组HeLa细胞中miR-148a、STAT3的表达水平Figure 1 Expression level of miR-148a and STAT3 in HeLa cells after transfection
2.2 不同浓度的顺铂对HeLa细胞增殖的影响
随着顺铂浓度的升高,HeLa细胞增殖抑制率逐渐升高;HeLa细胞的顺铂IC20约为4 μmol/L,见图2。后续实验将以4 μmol/L为顺铂处理浓度。
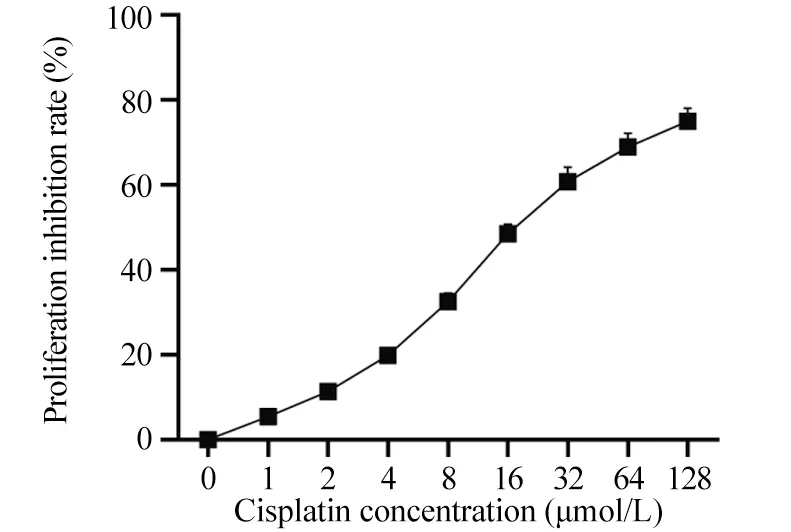
图2 不同浓度顺铂作用下HeLa细胞增殖抑制率 (x±s,n=6)Figure 2 Proliferation inhibition rate of HeLa cells under different concentrations of cisplatin treatment (x±s,n=6)
2.3 miR-148a对HeLa细胞增殖的影响
与对照组相比,mimic对照组、inhibitor对照组HeLa细胞OD值差异无统计学意义(P=0.969、0.969);与mimic对照组相比,miR-148a mimic组HeLa细胞OD值显著降低(P=0.000);与inhibitor对照组相比,miR-148a inhibitor组HeLa细胞OD值显著升高(P=0.000),见图3。
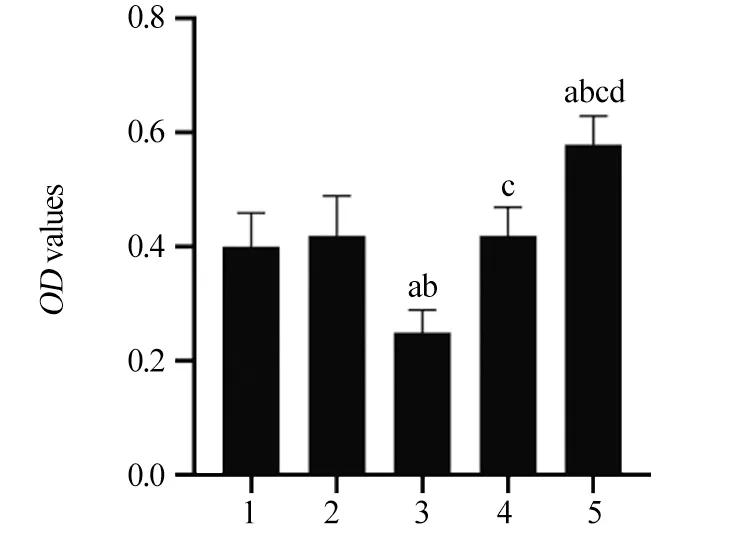
图3 各组HeLa细胞OD值Figure 3 OD values of HeLa cells in each group
2.4 miR-148a对HeLa细胞凋亡的影响
与对照组相比,mimic对照组、inhibitor对照组HeLa细胞凋亡率差异无统计学意义(P=0.952、0.981);与mimic对照组相比,miR-148a mimic组HeLa细胞凋亡率显著升高(P=0.000);与inhibitor对照组相比,miR-148a inhibitor组HeLa细胞凋亡率显著降低(P=0.000),见图4。
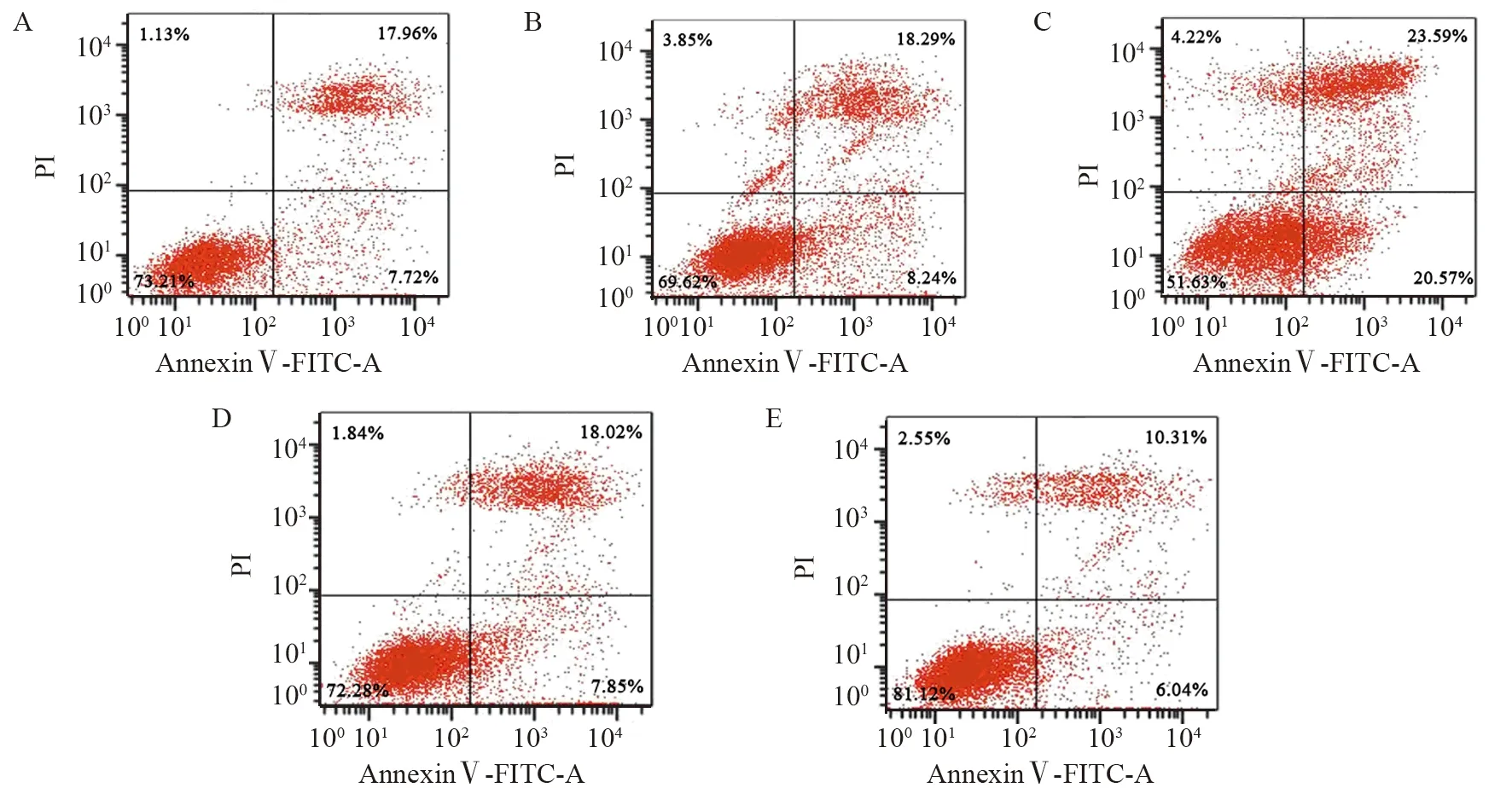
图4 各组HeLa细胞凋亡情况Figure 4 Apoptosis of HeLa cells in each group
2.5 miR-148a对HeLa细胞周期分布的影响
与对照组相比,mimic对照组、inhibitor对照组HeLa细胞G0/G1、S、G2/M期比例差异无统计学意义(P=0.999、0.828,P=0.980、0.998,P=0.437、0.999);与mimic对照组相比,miR-148a mimic组HeLa细胞G0/G1期比例显著升高(P=0.000),S、G2/M期细胞比例显著降低(P=0.000,P=0.000);与inhibitor对照组相比,miR-148a inhibitor组HeLa细胞G0/G1期比例显著降低(P=0.000),S、G2/M期细胞比例显著升高(P=0.005,P=0.002),见图5。

图5 各组HeLa细胞周期分布情况Figure 5 Distribution of HeLa cells cycle in each group
2.6 miR-148a对HeLa细胞中STAT3通路相关蛋白的表达
与对照组相比,mimic对照组、inhibitor对照组HeLa细胞中p-STAT3/STAT3、Cyclin D1、Bcl-2、Bax、Cleaved caspase-3蛋白表达水平差异无统计学意义(P=0.952、0.996,P=0.999、0.981,P=0.820、0.996,P=0.999、0.992,P=0.990、0.990);与mimic对照组相比,miR-148a mimic组HeLa细胞中p-STAT3/STAT3、Cyclin D1、Bcl-2蛋白表达水平显著降低(P=0.000,P=0.000,P=0.000),Bax、Cleaved caspase-3蛋白表达水平显著升高(P=0.000,P=0.000);与inhibitor对照组相比,miR-148a inhibitor组HeLa细胞中p-STAT3/STAT3、Cyclin D1、Bcl-2蛋白表达水平显著升高(P=0.000,P=0.000,P=0.000),Bax、Cleaved caspase-3蛋白表达水平显著降低(P=0.007,P=0.000),见图6。

图6 各组HeLa细胞中STAT3通路相关蛋白表达Figure 6 Expression level of STAT3 pathway-related protein in HeLa cells of each group
2.7 HeLa细胞中miR-148a与STAT3的靶向作用关系
miRTarBase网站预测发现STAT3可能为miR-148a的下游靶基因。双荧光素酶报告基因实验结果显示,miR-148a对转染突变型STAT3 3'UTR-荧光素酶表达载体细胞的荧光素酶活性无明显影响(P=0.134),但可抑制转染野生型STAT3 3'UTR-荧光素酶表达载体细胞的荧光素酶活性(P=0.000),见图7~8。

图7 miRTarBase预测miR-148a与STAT3的靶向关系Figure 7 Targeting relation between miR-148a and STAT3 predicted by miRTarBase
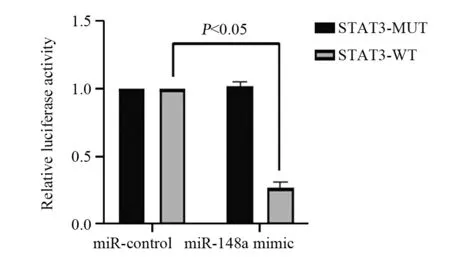
图8 各组HeLa细胞相对荧光素酶活性Figure 8 Relative luciferase activity of HeLa cells in each group
3 讨论
宫颈癌是女性常见恶性肿瘤之一,发病率、死亡率较高,严重威胁女性健康及生命安全。目前,已有包括手术切除、化疗、放疗、激素治疗在内的多种治疗措施被引入并应用于宫颈癌,但肿瘤复发仍是导致宫颈癌患者死亡的主要原因[9]。辅助化疗是减少肿瘤复发的传统治疗策略,可明显提高肿瘤局控率及改善患者生存率[10]。顺铂是化疗的基础药物,但患者在治疗过程中出现各种不良反应,不利于患者的治疗效果及身心健康[11]。临床上常通过联合治疗,在保证癌细胞敏感度不降低的前提下,降低顺铂用药剂量及频次,减轻不良反应[12]。因此,寻找在顺铂低剂量下,提高宫颈癌细胞顺铂化疗敏感度的方法具有重要意义。本研究通过设置顺铂浓度梯度,发现4 μmol/L顺铂最接近HeLa细胞的IC20,故后续实验均以4 μmol/L为顺铂处理浓度。
miRNA是一种非编码小RNA分子,通过与靶基因mRNA的3’未翻译区序列特异性结合,在肿瘤细胞的增殖、凋亡及放化疗敏感度等生物学行为方面发挥重要的调控作用[13-14]。李航等[15]研究表明,人为过表达miR-148a能降低肺癌A549、H1299细胞的增殖能力,并增强其放射敏感度。陈元元等[6]研究中亦发现,miR-148a-3p与乳腺癌的紫杉醇耐药性有关,可用于判断患者的紫杉醇耐药情况。Li等[16]研究认为,miR-148a-3p下调是胃癌患者化疗过程中产生顺铂耐药性的关键步骤,miR-148a-3p可能是克服胃癌顺铂耐药性的预后标志物或治疗候选物。Kim等[5]研究发现,miR-148a能通过靶向Rab14诱导肾癌细胞凋亡,降低肾癌细胞克隆形成性并增加顺铂敏感度。本研究显示,在4 μmol/L顺铂处理过程中,过表达miR-148a后,HeLa细胞OD值及S、G2/M期细胞比例显著降低,凋亡率及G0/G1期细胞比例显著升高;抑制miR-148a表达后,HeLa细胞OD值及S、G2/M期细胞比例显著升高,凋亡率及G0/G1期细胞比例显著降低,提示在顺铂诱导基础上,miR-148a可进一步诱导HeLa细胞,将细胞周期阻滞于G0/G1期,进而抑制HeLa细胞增殖并促进细胞凋亡,增强HeLa细胞的顺铂敏感度。
STAT3是转录信号转导子与激活子家族的重要成员,其持续激活会导致癌细胞中抗凋亡蛋白及细胞周期调控因子上调,促进肿瘤异常增殖及恶性转化[17]。Bcl-2和Bax为Bcl-2家族的重要成员,对细胞凋亡分别具有抑制和促进作用[18]。Caspase-3是各种细胞凋亡途径的共同执行蛋白,Cleaved caspase-3是其活性形式[19]。Cyclin D1是重要的细胞周期调控因子,在细胞从G0期进入G1期过程中发挥重要调控作用[20]。双荧光素酶报告基因实验显示,在HeLa细胞中,STAT3为miR-148a的下游靶基因。进一步通过蛋白检测显示,在4 μmol/L顺铂处理过程中,过表达miR-148a后,HeLa细胞中STAT3 mRNA及蛋白磷酸化水平、Cyclin D1、Bcl-2蛋白水平显著降低,Bax、Cleaved caspase-3蛋白水平显著升高;反之,抑制miR-148a表达后,HeLa细胞中STAT3 mRNA及蛋白磷酸化水平、Cyclin D1、Bcl-2蛋白水平显著升高,Bax、Cleaved caspase-3蛋白水平显著降低,提示在顺铂诱导基础上,miR-148a可能通过靶向抑制STAT3的表达与活化,影响Cyclin D1、Bcl-2、Bax、Cleaved caspase-3蛋白水平,进而调控HeLa细胞的增殖、凋亡、细胞周期进程,增强HeLa细胞的顺铂敏感度。
综上所述,miR-148a可靶向抑制STAT3,在顺铂处理宫颈癌HeLa细胞基础上,抑制HeLa细胞增殖、诱导细胞周期阻滞及细胞凋亡,对HeLa细胞顺铂化疗敏感度具有增强作用,在临床化疗中顺铂小剂量用药方向具有一定前景。

