环状核糖核酸调节肾透明细胞癌生物学行为的研究进展
张慧杰,刘利婷,崔宏伟,于蕾,岳根全
0 引言
肾细胞癌(renal cell carcinoma,RCC)是最常见的肾脏肿瘤,起源于肾小管上皮细胞,占成人肾脏恶性肿瘤的85%~90%。据估计,2020年美国将有73 750例新发肾细胞癌病例[1]。肾透明细胞癌(clear cell renal cell carcinoma,ccRCC)占RCC的70%~75%。非编码核糖核酸(non coding RNA,ncRNAs)是一种调节性核糖核酸。环状核糖核酸(cyclic ribonucleic acid,circRNAs)是ncRNAs的亚型,含共价单链闭环结构,缺乏5’端和3’端,进而可抵抗核酸外切酶的降解[2]。越来越多的证据表明,circRNAs在人类疾病发病机制中起着至关重要的作用,特别是在恶性肿瘤中,如三阴性乳腺癌、肺腺癌、结肠癌、肝细胞癌、膀胱癌及ccRCC[3-4]。近期研究发现,circRNAs在调节ccRCC细胞增殖、凋亡、迁移和侵袭中起关键作用[5]。因此,阐明circRNAs调节ccRCC生物学行为的有关机制及临床相关性,为ccRCC的诊断、预后和选择性治疗提供线索或信息。
1 CircRNAs与肾透明细胞癌
RCC又称肾腺癌,是起源于肾实质泌尿小管系统的恶性肿瘤。据调查,RCC在我国泌尿生殖系统肿瘤中占第二位,仅次于膀胱癌,约占成人恶性肿瘤的2%~3%,并占成人肾脏恶性肿瘤的80%~90%[6]。Wei等[4]研究发现,circRNAs不仅调节基本的生物过程,并在多种疾病中发挥重要作用,如ccRCC。Ma等[7]通过微阵列研究,发现542个circRNAs在ccRCC中异常表达,其中324个circRNAs下调,而218个circRNAs显著上调。因此认为,circRNAs是ccRCC中关键的分子调节剂,参与ccRCC发病的多种过程,包括增殖、凋亡、迁移、侵袭和上皮间质转化。circRNAs通过CircRNA-miRNA-mRNA网络相互作用促进ccRCC的发展。
2 CircRNAs
2.1 CircRNAs合成
CircRNAs是一种转录产物,由外显子反向剪接及选择性剪接形成,见图1A。CircRNAs由基因的内含子、外显子、非翻译区或基因间区编码产生,包括外显子环状核糖核酸、外显子-内含子环状核糖核酸(exon intron cyclic ribonucleic acid,EIciRNAs)和环状内含子核糖核酸(cyclic intron RNA,ciRNAs)。与线性RNA相比,circRNAs可抵消核酸外切酶活性而维持稳定,并通过与ceRNA的竞争来调节基因表达与转录[3]。
2.2 CircRNAs功能
CircRNAs结构与其特有的合成方式可调节各种重要的生物过程与功能,见图1B~C。
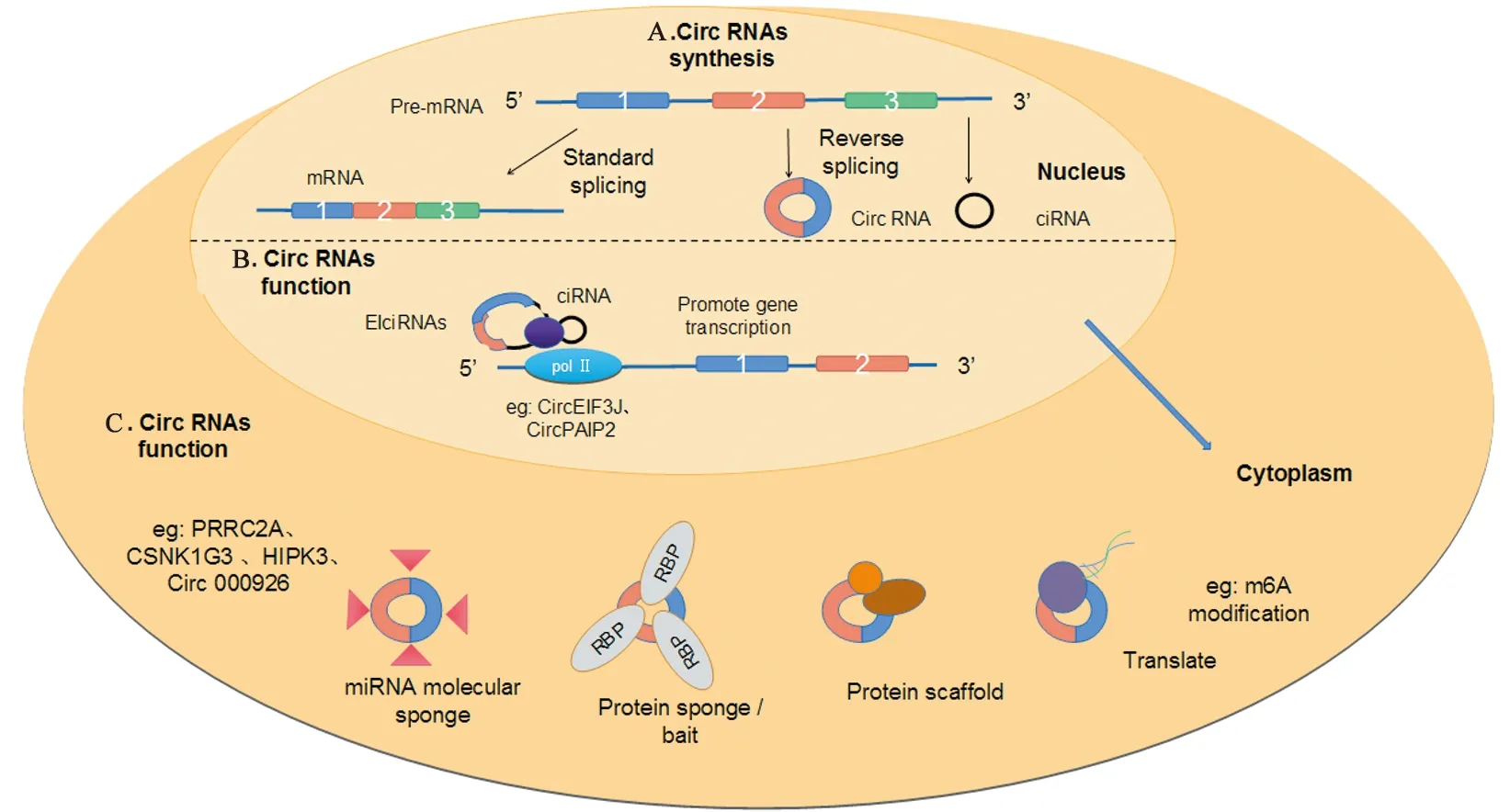
图1 CircRNAs生物合成与功能Figure 1 CircRNAs biosynthesis and function
2.2.1 CircRNAs调节细胞核内基因转录水平EIciRNAs可通过U1核小核糖核蛋白颗粒(small nuclear ribonucleoprotein particles,snRNP)相互作用构成EIciRNA-U1snRNP复合体,并与RNA聚合酶Ⅱ结合,来增强其基因转录与剪接[8],如CircEIF3J或CircPAIP2。此外,ciRNA也可增强RNA聚合酶Ⅱ转录,如ci-ankrd52调节细胞核内基因转录[9]。
2.2.2 CircRNAs调节细胞质内基因转录水平miRNA结合位点被称为miRNA应答元件。竞争性内源RNA(competitive endogenous RNA,ceRNA)机制即circRNAs充当miRNA分子海绵结构,抑制miRNA对其靶基因的沉默作用,间接上调靶基因及下游信号分子表达[3]。CircPVT1作为一种ceRNA,直接结合miR-145-5p,调节TBX15的表达,以评估ccRCC临床病理关联性及患者预后情况[10-11];CircTLK1通过控制miR-136-5p表达,上调促进色原体4,增加血管内皮生长因子表达,促进ccRCC的增殖或发展[12]。RNA结合蛋白(RNA binding protein,RBP)通过调控RNA的可变剪接、转运、翻译等转录后过程,参与细胞增殖、迁移、凋亡及氧化应激等多种生物学行为。研究发现,circRNAs可与RNA聚合酶Ⅱ及真核起始因子4A-Ⅲ等RBP稳定结合,构成RNA-蛋白复合体并与线性RNA相互作用[13]。CircPABPN1可与PABPN1基因的mRNA竞争RBPHuR蛋白,致下游PABPN1翻译受阻[14]。最新研究表明[15],circRNAs可翻译多肽或蛋白质,如N6-甲基腺嘌呤(N6-Methyladenosine,m6A)修饰,有效促进circRNAs的翻译进程。此外,circRNAs充当蛋白质诱饵结合多种RNA结合蛋白,或作为蛋白质支架,促进底物酶结合,调节反应动力学。
3 CircRNAs调节肾透明细胞癌生物学行为
CircRNAs充当肿瘤启动子,通过miRNA调节下游信号分子,调节ccRCC细胞增殖、上皮间质转化及凋亡等生物活性,见表1~2及图2。

表1 CircRNAs调节肾透明细胞癌增殖、迁移及上皮间质转化Table 1 CircRNAs regulate proliferation,migration and epithelial mesenchymal transition of ccRCC

表2 CircRNAs调节肾透明细胞癌凋亡Table 2 CircRNAs regulate apoptosis of clear cell renal cell carcinoma

图2 ccRCC相关circRNAs的作用和调节途径Figure 2 Role and regulatory pathway of ccRCC-related circRNAs
3.1 CircRNAs调节ccRCC增殖与迁移
叉头框(forkhead box,FOX)蛋白在调节代谢及免疫系统发展及器官发育形成过程中发挥重要作用。FOX基因在不同的癌症中均差异表达,依据基因家族类型及细胞类型不同,既为癌基因,也为抑癌基因。FOXP4编码蛋白属于FOX转录因子家族P亚家族,位于6号染色体上。最初研究证实[16-17],FOXP4异常表达与肺癌、肝癌、食管鳞状细胞癌、鼻咽癌等肿瘤密切相关。Xiong等[18]研究发现,Circ-ZNF609可提高FOXP4的水平,显著促进RCC细胞的增殖与侵袭,并揭示Circ-ZNF609/miR-138-5p/FOXP4轴在肾细胞癌中的关键作用。同时,认为Circ-ZNF609受m6A修饰的调节在细胞质进行翻译,进一步调控ccRCC细胞恶化。趋化因子配体13(C-X-C motif chemokine ligand 13,CXCL13)是一种稳态趋化因子,与CXCR5协同促进ccRCC细胞增殖和迁移[19]。Circ HIPK3作为circRNAs的一员,源于HIPK3基因的外显子2。Han等[20]发现,Circ HIPK3通过调控miR-508-3p/CXCL13信号轴变化,募集miR-508-3p,刺激CXCL13,进而诱导ccRCC细胞增殖和转移。Liu等[21]通过对140例RCC标本的免疫组织化学表达,发现CircPTCH1在ccRCC细胞G3/G4期的表达高于G1/G2期。CircPTCH1主要定位于细胞质,其作为miR-485-5p分子海绵与竞争性结合,增强MMP14的表达,降解细胞外基质及几种生物活性分子成分,异常激活Hh途径,促进ccRCC侵袭与转移。
3.2 CircRNAs调节ccRCC上皮间质转化
组织金属蛋白酶抑制因子3(tissue inhibitors of metalloproteinase 3,TIMP3)作为一种抗肿瘤基因,可被miR-181b抑制进而促进肿瘤细胞生长和转移。CircCSNK1G3位于染色体5q23,属于CK1家族的成员。Li等[22]表明,CSNK1G3通过上调miR-181b抑制TIMP3表达并介导ccRCC上皮-间质转化,促进生长与转移。N-钙黏蛋白(cadherin 2,CDH2)是一种经典的钙黏蛋白和黏附分子,主要参与组织稳态、器官发生、肾上皮极性与完整性,作为ccRCC侵袭性的主要因素[23]。一项研究[24]显示,Circ 000926可提高体外细胞增殖、迁移与侵袭能力,显著促进体内ccRCC的生长及间质转化,并揭示了与ccRCC转移相关调控轴:Circ_000926/miR-411/CDH2。Circ PRRC2A位于6p21.33,其表达与晚期RCC临床分期及较差的生存率呈正相关。转化受体电位阳离子通道M3(transient receptor potential cation channel,subfamily M,member 3,TRPM3)是一种组织特异性癌基因。Li等[25]研究,Circ PRRC2A通过miR-514a-5p或miR-6776-5p的分子海绵作用上调TRPM3并防止其降解,促进RCC患者的上皮间质转化及侵袭性。
3.3 CircRNAs调节ccRCC凋亡
3.3.1 CircRNAs作为miRNA的分子海绵 CircRNAs在ccRCC中具有肿瘤抑制作用。CircRNAs表达及其功能研究表明,cRAPGEF5是ccRCC中的一种新的肿瘤抑制因子,其表达与侵袭性临床特征有关。经RNA免疫沉淀和体外生化分析表明[26],cRAPGEF5作为miR-27a-3p分子海绵发挥作用,靶向抑制硫氧还蛋白互作蛋白(thioredoxin interacting protein,TXNIP)基因,介导氧化应激,诱导ccRCC细胞凋亡。FOXK2属于叉头盒转录因子家族,以抑制表皮生长因子受体及ccRCC的恶性表型作为肿瘤抑制因子。研究发现[27],CircUBAP2在ccRCC中显著下调,通过靶向miR-148a-3p/FOXK2途径影响细胞周期从G1期向S期的进展,而抑制ccRCC的增殖及转移,并与ccRCC患者的整体存活率差相关。
3.3.2 CircRNAs作为miRNA的“储库”CircRNAs也可作为miRNA的“储库”来调节ccRCC的进展。雄激素受体(androgen receptor,AR)在调节癌症的进展和转移中起关键作用,如ccRCC。Wang等[28]研究发现,Circ HIAT1充当miRNA“库”来增加miR-195-5p/29a-3p/29c-3p的活性,调节细胞骨架重组、细胞周期进程、极性与转录,进而抑制ccRCC细胞的独立迁移与侵袭。
3.3.3 CircRNAs调节相关的信号通路 CircRNAs通过癌症相关的信号通路调节ccRCC发展,如hsacirc-0072309[29]通过miR-100分子海绵作用,阻断ccRCC细胞系中的PI3K/AKT与mTOR的级联活性,促进ccRCC细胞凋亡。
4 CircRNAs作为肾透明细胞癌诊断、预后生物标志物及潜在治疗靶点
早期诊断与筛查便于临床治疗并降低ccRCC患者死亡率。经临床ccRCC有关研究表明,circRNAs异常表达与临床疾病特异性相关。Hsa_circ 0001451[30]与ccRCC临床病理特征和总生存率(overall survival,OS)相关,其AUC-ROC曲线下的面积为0.704,且ccRCC与健康者的敏感度和特异性分别为0.755和0.608。因此表明,Hsa_circ 0001451可作为诊断ccRCC的理想候选物。Lin等[31]发现联合Circ EGLN3与 Lin EGLN3检测其AUC-ROC值达到0.99(95%的敏感度和99%的特异性),表明circRNAs的组合诊断价值高于单个circRNAs。
一些circRNAs也可用于预后评估。Huang等[32]在体外研究中发现,Circ ABCB10在ccRCC组织中显著升高,与肿瘤大小、病理分级、晚期肿瘤淋巴结转移分期和远处转移显著相关,利于临床预后评估。Li等[25]多变量分析表明,CircPRRC2A表达是ccRCC患者OS的独立危险因素。
根据CircRNA在ccRCC中的生物功能,进一步探索ccRCC治疗的潜在新途径,提出相关治疗策略,CircHIAT1和CircATP2B1可作为转移抑制剂,靶向控制AR-CircHIAT1-miR-195-5p/29a-3p/29c-3p/CDC42及CircATP2B1介导的miR-2043p/FN1信号级联[28,33]。吉西他滨是一种新型抗癌药物,可选择性靶向调节酪氨酸激酶,进而改善ccRCC患者生活质量。Yan等[34]认为,hsa-circ_0035483通过miR-335/CCNB1信号通路以增强吉西他滨的耐药性,并认为其可能是吉西他滨耐药性的潜在靶位。
5 总结
CircRNAs是一种新描述的非编码核糖核酸,丰富临床对ncRNAs表达及其作用的理解。CircRNAs参与某些肿瘤的发病机制,如结肠癌、肝细胞癌及ccRCC等。CircRNAs调节肿瘤细胞程序性死亡、增殖、迁移与转移,并认为其可作为潜在的肿瘤标志物便于临床诊断或应用。CircRNAs在ccRCC中研究较少,且其生物学功能与分子机制不明确。因此,未来需进一步研究circRNAs在ccRCC中的环化、降解与细胞定位的确切机制,并明确其临床相关敏感度与特异性,为ccRCC早期诊断、预后及治疗提供依据。

