2种分子质量的丝胶蛋白对间充质干细胞黏附活性的探究
王志强 张慧华(南阳市经济作物技术推广站,河南南阳 473000; 河南民兴生物科技股份有限公司,河南社旗 473300)
蚕丝由内层丝素和外层丝胶2部分组成[1],丝胶包覆在丝素外围,对丝素起着保护和胶黏作用,可防止因织造摩擦对丝纤维的损伤[2],一般要到染色、整理工序时才将丝胶全部脱净[3]。丝绸绢纺厂精练液的废水中含有浓度极高的丝胶蛋白[4],直接排放流入河道会消耗水中的溶解氧,使水体丧失自净能力,破坏人类生态环境。但是,以往很多工厂都是将丝胶废水作为环境污染物处理,丝胶的价值没有得到很好的利用,而又容易造成环境污染。而丝胶的提取[5]和利用一方面可以减轻丝胶废水对自然环境造成的压力,另一方面将丝胶作为自然资源开发并利用,对增加经济效益也具有深远的意义。丝胶蛋白以其独特的优异性能,用途日趋扩大,产品日益增多,现已广泛应用在化妆品添加剂[6]、医药[7]、织物后整理涂层[8]以及功能性生物材料[6]等方面。近年来,丝胶蛋白作为生物材料的应用研究日趋活跃,明确丝胶蛋白的细胞相容性[9-10]是丝胶蛋白在医学组织工程材料[11]领域应用的必要前提,而其良好的细胞黏附活性是丝胶蛋白细胞相容性的突出表现之一。然而,现阶段对从废水中回收的丝胶蛋白的相对分子量鲜有报道,且其细胞相容性暂不明确,为此开展了从废水中回收不同分子量大小的丝胶蛋白对细胞的影响试验,以期为丝胶蛋白在医学组织工程的进一步开发应用提供参考。
1 材料与方法
1.1 试验材料
1.1.1 供试丝胶蛋白粉 利用膜过滤技术从桑条吐精炼液中提取的高分子量丝胶蛋白(HS)和低分子量丝胶蛋白(LS),河南民兴生物科技股份有限公司丝胶提取设备生产,蛋白质含量93.6%(纯度93.6%),具体生产方法参见文献[12]。
1.1.2 主要试剂 间充质干细胞(mesenchymal stem cells,MSC)无血清培养基套装(MSC基础培养基+MSC无血清添加剂)、胰蛋白酶消化液、小牛血清(FBS),均购自北京科霖恩生物科技有限公司,以上试剂均为细胞级;间充质干细胞,由北京科霖恩公司郭子宽教授赠送;碳酸钠、柠檬酸三钠、浓盐酸、丙烯酰胺、N,N′-亚甲基双丙烯酰胺、二甲基亚砜(dimethyl sulfoxide,DMSO),购自国药试剂,均为分析纯;三羟甲基氨基甲烷[tris(hydroxymethyl) methyl aminomethane THAM,Tris]、4×蛋白上样缓冲液(含β-巯基乙醇)、四甲基乙二胺(N,N,N′,N′-tetramethyl ethylenedia mine,TEMED)、过硫酸铵(ammonium persulphate,APS)、甲醇、冰醋酸、蛋白标准品Marker(M①11.0~180.0 kD、M②14.4~97.4 kD、M③3.3~20.1 kD)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、甘氨酸、磷酸盐缓冲液(phosphate buffered saline,PBS)、考马斯亮蓝 G-250,购自北京索莱宝有限公司,均为分析纯;噻唑蓝(MTT)、木瓜蛋白酶、纤维素酶、纤维连接蛋白(fibronectin,FN),购自美国-Sigma-公司,均为分析纯。
1.1.3 主要仪器设备 温水浴锅、PHS-3E型pH计、超纯水机、鼓风干燥箱,均为浙江力辰仪器科技有限公司产品;752N型紫外可见分光光度计,上海精密科学仪器有限公司产品;DYY-300型电泳仪,美国Bio-Rad公司产品;二氧化碳培养箱、生物安全柜、酶标仪、电动移液器,均为Thermo公司产品;电子天平,精度0.001 g,上海恒平科学仪器有限公司产品;磁力搅拌器,常州市金坛大地自动化仪器厂产品;血球计数板、96孔细胞培养板、150 mm细胞培养皿、50 mL离心管、移液管,均为美国Corning公司产品。
1.2 试验方法
1.2.1 分离胶的配制 取27.23 g的Tris溶解于80 mL 蒸馏水中,用盐酸调pH值至8.8,蒸馏水定容至150 mL。量取其中20 mL溶液,加入40 mL 30%的丙烯酰胺贮液、1 mL 10%的SDS和18 mL蒸馏水混匀,即配制成15%的分离胶,于4 ℃保存备用;量取其中的20 mL溶液,加入54 mL 30%的丙烯酰胺贮液、1 mL 10%的SDS和4 mL蒸馏水混匀,即配制成20%的分离胶,于4 ℃保存备用。分别量取15%和20%的分离胶9.95 mL,加入100 μL 10%的APS和5 μL的TEMED混匀,灌入胶板中,上层加入蒸馏水封口,等待分离胶凝固,即制成15%和20%的分离胶胶板。
1.2.2 浓缩胶的配制 (1)将6.00 g的Tris溶解于60 mL 蒸馏水中,用盐酸调pH值至6.8,蒸馏水定容至100 mL。(2)量取步骤(1)中的溶液2.5 mL,加入3.4 mL 30%的丙烯酰胺贮液、0.2 mL 10%的SDS和13.6 mL蒸馏水混匀,于4 ℃保存备用。(3)量取步骤(2)中的溶液10 mL,加入20 μL 10%的APS和10 μL的TEMED混匀,待1.2.1项的分离胶凝固后,倒出表面的水层,将配制好的浓缩胶灌入胶板中,然后插入梳子,等待凝固,即制成15%和20%的分离胶体系。
1.2.3 完全培养基的配制 量取16 mL的MSC基础培养基于50 mL离心管中,加入4 mL的FBS,用MSC基础培养基定容至20 mL,即为完全培养基。
1.2.4 MTT溶液的配制 准确称取50.00 mg的MTT溶解于4.5 mL的MSC基础培养基中,然后再用MSC基础培养基定容至5.0 mL,分装后于-20 ℃保存备用。
1.2.5 其他试剂的配制 (1)10%APS的配制。准确称量1.00 g的APS溶解于8 mL蒸馏水中,然后用蒸馏水定容至10 mL,分装后于-20 ℃保存备用。(2)10%SDS的配制。准确称量10.00 g的SDS溶解于80 mL蒸馏水中,50 ℃加热溶解,然后用蒸馏水定容至100 mL,于室温保存备用。(3)30%丙烯酰胺贮液的配制。精确称取29.00 g的丙烯酰胺和1.00 g的N,N′-亚甲基双丙烯酰胺,溶解于80 mL蒸馏水中,然后用蒸馏水定容至100 mL,过滤后避光于4 ℃保存备用。
1.2.6 丝胶蛋白分子量的测定 试验采用SDS-聚丙烯酰胺凝胶电泳法(SDS-PAGE法)测定丝胶蛋白的相对分子量。将从桑条吐精炼液中提取的HS和LS溶液用纯化水稀释至体积质量浓度为0.5 mg/mL,并与含β-巯基乙醇的蛋白上样缓冲液充分混合,煮沸3 min离心备用。HS在15%的分离胶体系下进行,LS在20%的分离胶体系下进行。上样(每孔上样量为10 μL,共10孔),在80 V电压下电泳30 min,120 V电压下电泳1 h,取出凝胶,固定(甲醇∶冰醋酸=4∶1,100 mL),用考马斯亮蓝溶液染色4 h以上,染色结束后脱色(甲醇∶冰醋酸=5∶1,100 mL)3~5次,每次间隔40~60 min直到蛋白质条带清晰可见,与蛋白标准品条带比对确定丝胶蛋白的相对分子量。
1.2.7 细胞黏附试验 将HS和LS分别用MSC基础培养基稀释至体积质量浓度为0.1 mg/mL、0.5 mg/mL、1.0 mg/mL、2.0 mg/mL的溶液为试验组,以体积质量浓度为100 μg/mL的FN[12-14]为阳性对照组,以PBS为阴性对照组,共6组,每组分别做12个平行。上述各组分别以100 μL加入96孔细胞培养板中,4 ℃过夜,完成包被。将包被过夜的96孔板用PBS洗涤2~3次,然后加入细胞,密度为104个/孔,再加入含体积质量百分比为0.5%的FBS基础培养基100 μL,在37 ℃下孵育20 min,去除液体,再次用PBS洗涤2~3次,去除未贴壁细胞,加入完全培养基继续培养4 h。采用MTT比色法检测细胞的生长情况,具体过程如下:用完全培养基培养4 h后,每孔再加入20 μL体积质量浓度为5 mg/mL的MTT溶液,继续培养4 h。终止培养,小心吸去上清液,加入150 μL/孔的DMSO振荡5~10 min,使结晶物充分溶解,选择在490 nm波长下,用酶标仪测其吸光度值,重复测定3次,并以试验各组及阳性和阴性对照组为横坐标,吸光度值为纵坐标绘制柱状图,对比分析HS和LS在同一体积质量浓度下的细胞黏附活性。
2 结果与分析
2.1 丝胶蛋白相对分子量的确定
通过SDS-PAGE 法测定丝胶蛋白LS和HS的分子质量分布。从图1可以看出,利用膜过滤技术制备的HS分子量主要分布在31.0~97.4 kD之间,LS分子量分布在7.8~31.0 kD之间。
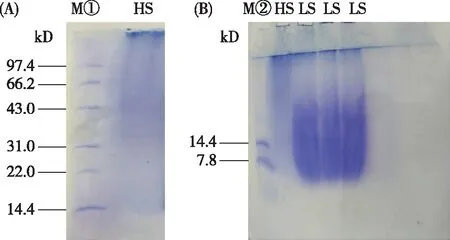
HS表示高分子量丝胶蛋白,LS表示低分子量丝胶蛋白。图1 HS(A)和LS(B)的SDS-PAGE法测定的分子质量图谱
2.2 丝胶蛋白HS和LS的细胞黏附活性
试验以体积质量浓度为100 μg/mL的FN为阳性对照,以PBS为阴性对照,HS和LS等2种分子量大小的丝胶蛋白在0.1 mg/mL、0.5 mg/mL、1.0 mg/mL、2.0 mg/mL体积质量浓度下均表现出良好的细胞黏附活性,具体如图2所示。从图2可以看出,在同一体积质量浓度下经HS包被处理过夜的试验组对间充质干细胞的黏附活性极显著高于(P<0.01)LS包被处理过夜的试验组。试验结果表明,不同分子量的丝胶蛋白对间充质干细胞的黏附活性产生了重要影响。

柱图为490 nm波长下的吸光度值。图2 MTT法检测经HS和LS包被处理96孔板过夜后对间充质干细胞的黏附活性
3 小结与讨论
试验采用SDS-PAGE法测定利用膜过滤技术从桑条吐精炼液中回收提取的高分子量丝胶蛋白的分子量分布在31.0~97.4 kD之间,低分子量丝胶蛋白的分子量分布在7.8~31.0 kD之间。
丝胶蛋白用于生物医学材料时,必须要有良好的生物相容性,细胞在相关材料上的黏附活性是评价丝胶蛋白生物相容性的重要指标之一[9-10]。本试验通过膜过滤技术制备了高分子量和低分子量丝胶蛋白用于探究其做为生物材料构建的可行性,用2种不同分子量的丝胶蛋白包被处理96孔板过夜后,用MTT法检测其对细胞的黏附活性,试验结果表明,从桑条吐精炼液中利用膜过滤技术回收的高分子量丝胶蛋白和低分子量丝胶蛋白均表现出良好的细胞黏附活性,且在同一体积质量浓度下高分子量丝胶蛋白各试验组极显著高于(P<0.01)低分子量丝胶蛋白各试验组,这可能与丝胶蛋白的纯度有很大的关系,在蚕丝脱胶过程中的各种化学药剂残留为主要原因,这也为丝胶蛋白的提纯技术提出了更高的要求。本试验验证了丝胶蛋白生物相容性对细胞的黏附活性的影响,为其在医学工程领域的开发提供了理论依据。

