我院药品不良反应报告系统实施及应用评价
谢吉科,颜 妍,孟慧杰,孙 坤,毛乾泰△
(1. 清华大学附属北京清华长庚医院药学部,北京 102218; 2. 清华大学临床医学院,北京 102218)
近年来,我国药品不良反应(ADR)监测工作取得了长足发展,评价能力不断提升。1999 年至2019 年,全国ADR 监测网络累计收到《药品不良反应/事件报告表》1 519 万份,其中2019 年收到151.4 万份[1]。这些ADR报告主要来自医疗机构,医师、药师、护士是主要报告者,其中2019 年报告严重的ADR 15.6 万份(10.3% ),每100 万人口平均报告数为1 130 份。我院于2017 年初申请加入国家药品不良反应监测哨点,2017 年7 月获批后,我院信息管理部门积极配合,并进行信息化接口开发,于2017 年底完成了中国医院药物警戒系统(CHPS)软件上线,实现了我院ADR 辅助报告,关注ADR 主动监测与智能搜索,药物警戒信息反馈等功能。自2018 年使用CHPS[2]上报ADR 以来,上报数量及质量均有较大进步。现将实施情况报道如下。
1 上报流程改进
我院ADR 报告系统原流程为,医务人员发现ADR后,于医院信息系统(HIS)提报,该系统仅能提报患者病历号、姓名、年龄、性别、发生日期、药品名称、症状描述、处置、上报人员信息;ADR 监测管理员负责与上报人员沟通,并完善《药品不良反应/事件报告表》,审核,登录国家ADR 监测系统上报。该流程存在诸多弊端[3],如每家医院仅1 个账号用于登录上报,工作量大,易导致数据采集、上报不及时;HIS 提报资料有限,上报人员对症状描述、处置书写不规范;HIS 导出报表无法与国家ADR 监测系统对接,需人工反复输入和整理,工作效率低。
CHPS 软件上线后,所有医务人员均可上报,上报途径多样化,医师工作站、护士工作站、药房系统、院内网链接均可登录后上报(系统登录界面见图1),ADR 辅助上报界面(见图2,其中报告编号为自动生成)与ADR报告表内容一致,通过患者病历号,可检索并带入患者信息(性别、出生日期、民族、体质量、联系方式)、药品信息(名称、批号、生产厂家)、原患疾病等。通过个性化的ADR 过程描述模板(如通用、皮疹、恶心呕吐、过敏性休克等)提高上报人员的ADR 上报质量。医院ADR 监测管理员可在线审核、上报,通过一键上传或Excel 文件导出后上传至国家ADR 监测系统。这种快捷、便利的上报途径大幅提高了ADR 上报数量和质量[4]。我院2017 年至2019 年上报ADR 数量及质量评分见表1。
图1 中国医院药物警戒系统登录界面Fig.1 Login interface of the China Hospital Pharmacovigilance System

图2 ADR 辅助上报界面Fig.2 ADR auxiliary reporting interface

表1 2017 年至2019 年我院上报ADR 数量及质量评分Tab.1 The quantity and quality scores of ADRs reported by our hospital from 2017 to 2019
2 上报ADR 数据质量评估与分析
2.1 ADR 质量评估
ADR 报告质量评分:根据《药品不良反应病例报告质量评估评分标准》(北京细则)制订我院ADR 报告评分表、评分标准,对报告的真实性、规范性、完整性、加分项等各项目进行评分,上报的ADR 经我院ADR 监测管理员审核评估均为真实报告。2017 年至2019 年的ADR报告质量评分见表2。

表2 2017 年至2019 年我院ADR 报告质量评分(分)Tab.2 The quality score of ADR reports in our hospital from 2017 to 2019(point)
质量评分准确性:质量评分虽有评分标准,但难以量化,评价的准确与否需要专业判断,缺乏统一的技术标准[5]。评分为人工打分,由于长期进行,势必造成偏颇,需研究设计通过计算机辅助的评分方法,以便更精准地对报告进行评分和日常质量评价。通过对各指标的评分,可全面了解ADR 报告质量,发现上报过程中存在的问题,从而有针对性地对报告进行干预,从根源上提高报告质量[6]。由上述评分可见,2017 年至2019 年ADR 报告质量评分无明显变化。
质量评价分析:我院的ADR 报告在规范性方面评分较高,2017 年至2019 年的平均得分率为98.31%,其中用法用量得分率为100.00%。得分率较低的项目为完整性方面的“3 个ADR 时间”和“出现的ADR 症状、体征”,2017 年至2019 年平均得分率分别为62.30%和58.71%。
2.2 ADR 报告分析
报告情况:我院2017 年至2019 年上报ADR 报告471 例,其中新的、严重的ADR 30 例(6.37% );男性略多于女性(248 ∶223);年龄1 ~96 岁,平均55.92 岁;涉及药品类型主要为抗菌药物(188 例,33.92%),抗肿瘤药物(68 例,14.44%),镇痛药(24 例,5.10%),消化系统药物(23 例,4.88%),对比剂(21 例,4.46%);累及器官/系统主要为胃肠道系统、皮肤及其附件、神经系统等。详见表3。
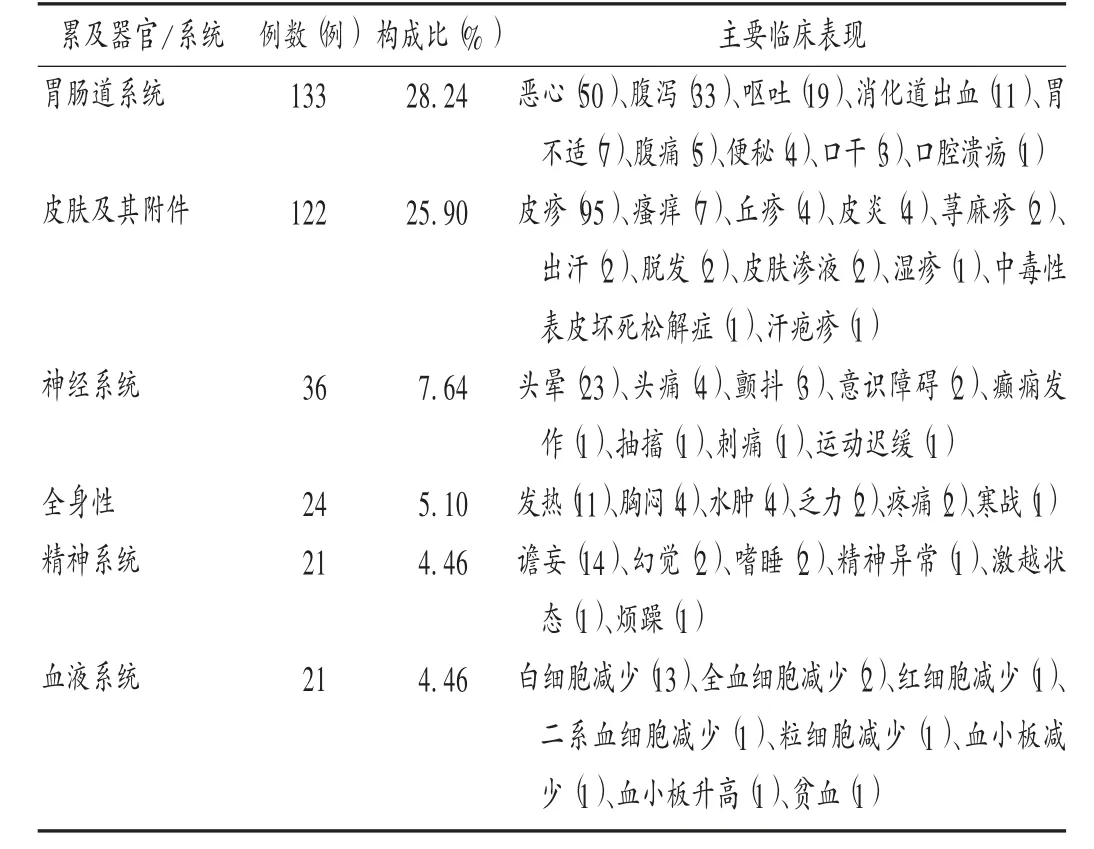
表3 2017 年至2019 年ADR 累及器官/系统及主要临床表现Tab.3 The organ/system and main clinical manifestations involved in ADRs from 2017 to 2019
分析:我院ADR 报告涉及药品类型中最多的是抗菌药物,与2019 年国家ADR 监测年度报告抗感染药物不良反应/事件报告率[1]相当,与医院报告中药品类型同为抗感染药物相似[7-9]。发生率较高的药品有头孢菌素类(53 例)、喹诺酮类(46 例)、碳青霉烯类(15 例)、青霉素类(15 例)、大环内酯类(12 例)、糖肽类(11 例),与2019 年国家ADR 监测年度报告中抗感染药物排名头孢菌素类、喹诺酮类、大环内酯类类似,大环内酯类药物ADR 发生率排名有所降低。对比剂在我院ADR 上报药品中的占比为4.46%,主要药品为碘克沙醇、碘佛醇、碘海醇。其ADR 临床表现为皮疹(10 例)、头晕(4 例)、皮肤渗液(2 例)、肾功能损害(1 例)、心跳加速(1 例)、发热(1 例)、腹痛(1 例)、呼吸急促(1 例)。对比剂皮肤及其附件损害的发生率为57.14%,高于文献[10-11]报道的34.13%和48.51%。我院对比剂ADR 主要表现为皮疹,为迟发性过敏反应,以T 细胞介导的Ⅳ型变态反应为主[12]。鉴于此,在临床使用对比剂时,建议提前告知患者此项检查的必要性及可能出现的ADR,以消除患者的紧张情绪,配备急救药品及抢救设施,做好应急预案,有效保障患者的用药安全[10]。
3 讨论
在大数据时代背景下,国家药品不良反应监测中心对有效的医疗资源进行整合开发,形成了哨点医院药物警戒系统[13-16],该系统打通了医院上报人员、医院管理员、国家药品不良反应监测中心的通路。自2014 年在广东省试点以来,该系统现已在全国32 个省、自治区、直辖市及新疆生产建设兵团387 家医院部署测试使用。该系统集成了医院ADR 辅助上报、主动监测、统计分析等功能,为医疗机构ADR 上报、分析统计提供了便利。
该系统实施后,我院《药品不良反应/事件报告表》的规范性、完整性均有了很大提高。通过系统可提供报告表所需的大部分信息,并自动带入,具有数据的可追溯性。极大地方便了上报人员,减轻了医院ADR 管理员的上报工作量,提高了临床医护人员在ADR 上报、监测中的主动性和自觉性。辅助上报和主动监测功能的提升,使医院ADR 监测手段得以创新,方便对重点药品进行监测,为药品上市后再评价提供了研究平台,提升了医疗机构上报的数量和质量,以及科研能力。

