柑橘皮蛋白质提取工艺优化及抗氧化活性研究
徐 弦,安兆祥,李晓明,刘馥源,程宏桢,沈勇根,蔡志鹏
(江西农业大学食品科学与工程学院,江西省发展与改革委员会农产品加工与安全控制工程实验室,江西南昌 330045)
柑橘属芸香科下属植物,是世界上第一大水果[1−2]。近年来,无论是产量还是栽培面积均居世界各类水果首位[3]。柑橘类水果作为新鲜农产品,果汁在世界范围内被大量消费,而果皮通常被当作废物丢弃[4]。目前世界上对柑橘的加工能力占35%,而我国却只有5%[5]。现在大部分柑橘皮渣会用作生产加工动物饲料或者被弃用填埋,而进行填埋处理容易导致霉变发臭直接对环境造成污染[6]。所以,对“无用”的柑橘皮进行进一步加工处理,不仅可以增加柑橘产业的附加值,还可以减轻环境压力。
柑橘皮渣是工厂对柑橘加工处理后以及榨成汁后的剩余物,重量约占柑橘总重量的30%,其内营养丰富,蛋白质含量约占7.7%(干重),还含有如钙、磷、钾、镁、铁、铜,锌、硒、碘等各种矿物质元素[7]。柑橘皮在中国最早应用于中药,人们通常将柑橘皮晒干当作陈皮入药,具有健脾开胃、理气消食、清热解毒等多种益处。我国柑橘加工产业发展迅速,柑橘皮渣资源十分丰富,但是中药所需数量有限且由于缺乏相关研究和技术落后,导致很多柑橘皮渣无法得到有效的利用而直接废弃[8]。近年来,随着人民生活质量水平的提高,人们对食品营养健康的需求也越来越高。相对于动物蛋白,植物蛋白资源更加丰富,因其价格便宜,且不含胆固醇以及饱和脂肪,能够降低人体血压,而越来越被人们所关注[9−10]。目前人们对于柑橘皮的研究主要集中在香精油[11−13]、果胶[14−16]的提取与利用,对其蛋白质的提取与开发利用却相对较少。
蛋白质提取的方法有很多,常用的有水溶液提取、碱溶酸沉[17]、有机溶剂提取、酶法提取等。其中碱溶酸沉法操作简单、综合成本较低、提取率也相对可观,因此大部分蛋白质的提取都会选择此法[18]。所以,本文采用碱提酸沉法来作为提取柑橘皮蛋白质的方法,通过单因素实验与Box-Benhnken设计结合,确定提取柑橘皮蛋白质的最佳工艺,并对提取的柑橘皮蛋白质进行体外抗氧化活性评价,为柑橘皮蛋白质日后开发与利用提供理论基础。
1 材料与方法
1.1 材料与仪器
新鲜赣南脐橙 江西农大超市;牛血清蛋白(BSA)、DPPH(1,1-二苯基-2-三硝基苯肼) 上海源叶生物科技有限公司;浓盐酸 四川西陇化工有限公司;NaOH 天津永大化学试剂有限公司;考马斯亮蓝G-250 上海强顺化学试剂有限公司;抗坏血酸 上海展云化工有限公司;亚硝酸钠、盐酸萘乙二胺、对氨基苯磺酸 上海麦克林生化科技有限公司;双氧水、硫酸亚铁、PBS、水杨酸、无水乙醇 南昌市芜锦生物科技有限公司;以上试剂均为分析纯。
WFJ 2100可见分光光度计 尤尼科(上海)科学仪器有限公司;DHG-914385-Ⅲ电热恒温鼓风干燥箱 上海新苗医疗器械制造有限公司;SCZL-2数显控温磁力搅拌器 巩义市予华仪器有限公司;Q500B高速多功能粉碎机 上海冰都电器有限公司;100目标准筛 绍兴市上虞张兴纱筛厂;PHS-P便携式p H计 上海大普仪器有限公司;K-355凯氏定氮仪瑞士步琪有限公司;Scientz-10N冷冻干燥机 宁波新芝生物科技股份有限公司;SF-TGL-16G台式高速离心机 上海菲恰尔分析仪器有限公司;T-25 basic高速分散机 艾卡(广州)仪器设备有限公司;QL-901涡旋振荡器 海门市其林贝尔仪器制造有限公司;ME3002电子天平 梅特勒-托利多仪器(上海)有限公司。
1.2 实验方法
1.2.1 原料处理 取新鲜柑橘皮置于50℃鼓风干燥箱中4 h至烘干,然后用高速多功能粉碎机粉碎后过100目筛,得到柑橘皮粉,保存至真空干燥皿备用。
1.2.2 牛血清蛋白标准曲线的绘制 分别配制浓度为(0.02、0.04、0.06、0.08、0.1 mg/mL)的牛血清蛋白质溶液。分别吸取1 mL不同浓度的蛋白质溶液于10 mL离心管中,再向离心管中加入5 mL考马斯亮蓝,振荡混匀,静置2 min。在波长为595 nm处用分光光度计测定不同浓度的牛血清蛋白质吸光度值,以蛋白质标准溶液浓度为横坐标(mg/mL),对应的吸光度值为纵坐标,绘制牛血清蛋白质的标准曲线。
1.2.3 柑橘皮蛋白质等电点(pI)的测定 参照孙小斐等[19]的方法对柑橘皮蛋白质的等电点进行测定。先用量筒量取10 mL柑橘皮提取液溶液,加盐酸分别将溶液p H调为2.2、2.4、2.6、2.8、3、3.2、3.4、3.6、3.8、4,于4℃恒温箱静置沉淀24 h。将溶液以10000 r/min离心15 min,除去沉淀,保留上清液,取1 mL上清液于10 mL离心管中,再向离心管中加入5 mL考马斯亮蓝溶液,振荡混匀,静置2 min。在波长为595 nm处使用可见光分光光度计分别测定不同pH上清液其吸光度值。当吸光度值为最小时,此时溶液的pH即为柑橘皮蛋白质等电点。
1.2.4 柑橘皮蛋白质提取 柑橘皮蛋白质的提取方式参照刘静等[20]的方法并作相应的修改。取1 g柑橘皮粉,按相应料液比(1:20~1:50)g/mL加入蒸馏水在烧杯中溶解,用0.1 mol/L NaOH将柑橘皮溶液调至相应碱溶pH(9~13),边搅拌边恒温(30~70℃)加热(0.5~3 h),常温下冷却后离心15 min(6000 r/min,4℃),取1 mL上清液,采用Bradford法测上清液蛋白含量,用0.1 mol/L HCl将剩余上清液pH调至等电点,在4℃条件下沉淀24 h,离心15 min(10000 r/min,4℃),取沉淀水洗并用0.1 mol/L NaOH调至中性(p H≈7),用真空冷冻干燥机干燥48 h得到柑橘皮蛋白质粉。
1.2.5 柑橘皮蛋白提取率的测定 采用Bradford[21]的方法对溶液中的蛋白质进行定量,吸取0.30 mL蛋白质提取液于10 mL离心管中,再加入0.70 mL的蒸馏水和5 mL的考马斯亮蓝溶液,振荡混匀,静置2 min。于波长为595 nm处测定柑橘皮蛋白质提取液的吸光度值,再结合牛血清蛋白质标准曲线计算提取液中蛋白质的含量。根据凯氏定氮法测定柑橘皮中蛋白质的总含量。根据公式(1)计算柑橘皮蛋白质提取率:

1.2.6 单因素实验 柑橘皮蛋白提取工艺中,先固定提取工艺条件:p H为10、提取温度为50℃、提取时间为2 h、料液比为1:30(g/mL)。每次单因素实验取1 g柑橘皮粉末,分别考察pH(9、10、11、12、13)、提取温度(30、40、50、60、70℃)、料液比(1:20、1:25、1:30、1:35、1:40、1:45、1:50 g/mL)、提取时间(0.5、1.0、1.5、2.0、2.5、3.0 h)等4个因素对柑橘皮蛋白质提取率的影响,选择p H、提取温度、提取时间、料液比最优的水平进行后续的响应面试验。
1.2.7 响应面优化设计 在前节1.2.6单因素实验的基础上,运用软件Design-Expert 8.0.6中的响应面优化设计,以pH(A)、提取温度(B)、提取时间(C)、料液比(D)这四个单因素为自变量,以实验中柑橘皮蛋白质提取率的大小为响应面的响应值进行工艺条件优化,相关试验因素水平编码见表1。

表1 响应面因素水平编码Table 1 Factor level coding of response surface
1.2.8 柑橘皮蛋白质纯度计算 将优化工艺条件下提取的柑橘皮蛋白质粗提液调至等电点,过滤取沉淀,冷冻干燥,得到柑橘皮粗蛋白,取0.2 g蛋白质粗提物,用蒸馏水定容至50 mL作为待测液,取1 mL待测液按照1.2.5中的方法测定溶液中柑橘皮蛋白质含量,柑橘皮蛋白质纯度按照公式(2)计算:
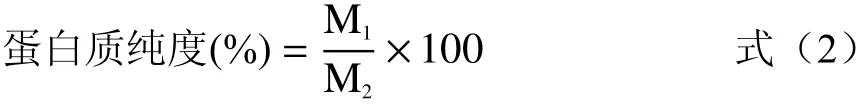
式中:M1为溶液中柑橘皮蛋白质的质量;M2为样品粗提物质量。
1.2.9 体外抗氧化活性测定 通过测定柑橘皮蛋白质溶液对DPPH·、H2O2、·OH和N O−2的清除率来研究其体外抗氧化活性的能力。
1.2.9.1 清除DPPH·活性测定 参照Hou等[22]方法并做修改。先分别量取2 mL不同质量浓度的柑橘皮蛋白质溶液(0.2、0.4、0.6、0.8、1.0 mg/mL)于10 mL离心管中,加入刚配制的0.2 mmol/L DPPH·溶液2 mL,振荡混匀,在25℃环境下避光保存30 min,然后使用可见光分光度计测定其在波长为517 nm处的吸光度值,计算公式如下:

式中:A0为蒸馏水代替蛋白质溶液吸光度值;A1为样品蛋白质溶液实验的吸光度值;A2为无水乙醇代替DPPH·的吸光度值。
1.2.9.2 清除H2O2活性测定 参照Liu等[23]方法并做修改。先分别量取2 mL不同质量浓度柑橘皮蛋白质溶液(0.2~1.0 mg/mL)于10 mL离心管中,再分别加入4.8 mL 0.1 mmol/L PBS(pH7.4)和1.2 mL 40 mmol/L H2O2溶液,振荡混匀,在25℃环境下放置30 min,然后使用可见光分光光度计测定其在波长为230 nm处的光度值,计算公式如下:

式中:A0为蒸馏水代替蛋白质溶液所测的吸光度值;A1为样品蛋白质溶液实验的吸光度值;A2为蒸馏水代替H2O2溶液的吸光度值。
1.2.9.3 清除·OH活性测定 参照周明等[24]的方法并做修改。先分别量取2 mL不同质量浓度(0.2~1.0 mg/mL)的柑橘皮蛋白质溶液于10 mL离心管中,再往离心管中加入刚配制好的2 mL 6 mmoL/L的双氧水溶液和2 mL 6 mmoL/L的硫酸亚铁溶液,将离心管中混合液完全混匀后在避光处静置30 min,再向离心管中加入刚配制好的2 mL 6 mmol/L的水杨酸溶液,振荡混匀,25℃环境下静置10 min,然后使用可见光分光光度计测定其在波长为510 nm处的吸光度值,计算公式如下:

式中:A0为蒸馏水代替蛋白质溶液的吸光度值;A1为样品蛋白质溶液实验的吸光度值;A2为蒸馏水代替水杨酸溶液的吸光度值。
1.2.9.4 清除N O−2活性测定 参照赵功玲等[25]的方法并做修改。先分别量取1 mL不同质量浓度(0.2~1.0 mg/mL)的柑橘皮蛋白溶液于10 mL离心管中,再加入1 mL 0.2%亚硝酸钠标准使用液,振荡混匀,在37℃恒温水浴锅内加热20 min,再往试管中加入2 mL 0.4%对氨基苯磺酸溶液,振荡混匀,静置10 min,再向离心管中的混合溶液中加入1 mL 0.2%盐酸萘乙二胺溶液,在避光处充分反应15 min,然后使用可见光分光光度计测定其在波长为538 nm处的吸光度值,计算公式如下:

式中:A0为蒸馏水代替蛋白质溶液的吸光度值;A1为样品蛋白质溶液实验的吸光度值。
1.3 数据处理
采用Design-Expert 8.0.6进行响应面设计;使用OriginPro9.1和IBM SPSS Statistics 22进行数据处理分析。
2 结果与分析
2.1 牛血清蛋白质标准曲线
根据试验数据,以牛血清蛋白浓度为横坐标,吸光度值为纵坐标用Excel 2010绘制标准曲线,得到回归方程y=4.685x+0.0813,R2=0.9991,ODck=0.410。牛血清蛋白与标准品与吸光度值呈良好的线性关系如图1。
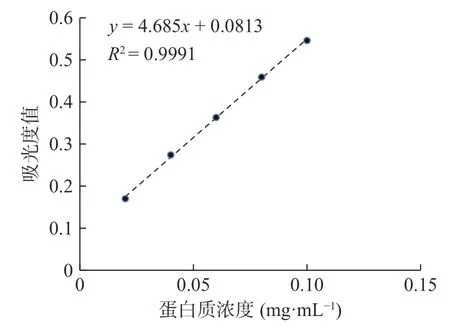
图1 牛血清蛋白标准曲线Fig.1 Standard curve of bovine serum protein
2.2 柑橘皮蛋白质等电点
如图2所示,当pH为3.0附近时,上清液的吸光度值为最低,曲线为最低点,说明此时溶液中蛋白质含量最低。当蛋白质处于等电点时,蛋白质分子所带的正电荷与负电荷恰好相等,相同电荷间作用力抵消,其颗粒极易发生碰撞而产生沉淀,导致蛋白质容易析出。所以pH3.0为柑橘皮蛋白质等电点。将蛋白质提取液的pH调至等电点,溶液中的蛋白质将以沉淀的形式从溶液中析出,过滤得到蛋白质沉淀,经过冷冻干燥得到柑橘皮粗蛋白质。

图2 柑橘皮蛋白质等电点Fig.2 Isoelectric point of citrus peel protein
2.3 单因素实验
2.3.1 pH对柑橘皮蛋白提取率的影响 如图3所示,随着p H的逐渐升高,溶液中柑橘皮蛋白质的提取率先上升后下降。当溶液p H处于9~12时,柑橘皮蛋白质的提取率随着p H的升高而显著上升(P<0.05),这可能是由于p H在一定碱性范围内,p H越高,溶液中蛋白质分子间的氢键越容易被打破[26],随着氢键被打破,蛋白质分子间的相互作用力减小,会加强蛋白质分子与水分子的结合,增加其与水的溶解度;当pH=12时,柑橘皮蛋白质提取率达到55.20%;当溶液p H>12时,柑橘皮蛋白质的提取率下降显著(P<0.05),这可能是因为强碱导致溶液较为浓稠,不易使蛋白质从柑橘皮中溶出,且p H过高容易使蛋白质变性。所以选取pH=12进行后续响应面试验。

图3 pH对柑橘皮蛋白提取率的影响Fig.3 Effect of pH on extraction rate of protein from citrus peel
2.3.2 提取温度对柑橘皮蛋白提取率的影响 如图4所示,随着提取温度的逐渐升高,柑橘皮蛋白质的提取率是先升高后下降。当溶液提取温度处于30~60℃时,柑橘皮蛋白质的提取率随着提取温度的升高而显著上升(P<0.05),提取液温度的升高会增加溶液中分子的动能和扩散速率,导致氮溶解指数升高,从而增加了蛋白质的溶出;当提取温度为60℃时,柑橘皮蛋白质提取率达到峰值53.43%;而随着提取温度继续升高时,柑橘皮蛋白质提取率下降显著(P<0.05),这可能是当温度超过60℃时,柑橘皮蛋白质已经开始变性,氮溶解指数开始下降。所以选择最适温度60℃进行后续的响应面试验。

图4 提取温度对柑橘皮蛋白提取率的影响Fig.4 Effect of extraction temperature on extraction rate of protein from citrus peel
2.3.3 料液比对蛋白提取率的影响 如图5所示,随着料液比的升高,蛋白质的提取率先上升后趋于平缓。当溶液料液比为1:20~1:45(g/mL)之间时,柑橘皮蛋白质提取率随着料液比的升高而显著上升(P<0.05),当料液比较低时柑橘皮没有完全溶解,溶液较为粘稠,不利于蛋白质从柑橘皮中溶出,所以在这个范围内,随着料液比的增加,柑橘皮蛋白质提取率越来越高。而随着料液比继续增加时,蛋白质提取率略微下降,但下降趋势较为平缓,此时柑橘皮溶解已达到最大,所以蛋白质提取率变化不大,但是过高的料液比会导致酸沉时产生大量的废料,成本增多,所以选择料液比为1:45(g/mL)进行后续响应面试验。

图5 料液比对柑橘皮蛋白提取率的影响Fig.5 Effect of solid-liquid ratio on extraction rate of protein from citrus peel
2.3.4 提取时间对蛋白质提取率的影响 如图6所示,随着提取时间的逐渐增加,柑橘皮蛋白质的提取率呈先上升后下降的倒“V”型。当提取时间处于0.5~2.5 h之间时,柑橘皮蛋白质的提取率随着提取时间的升高显著上升(P<0.05),这可能是当提取温度在这个范围内,提取时间越长,越有利于柑橘皮蛋白质的溶解;而随着提取时间继续增加时,柑橘皮蛋白质提取率下降显著(P<0.05),这可能是由于当蛋白质长时间处于碱溶液时部分蛋白质会出现聚集现象而产生沉淀,而与杂质一起被离心分离。所以选取2.5 h进行后续的响应面试验。
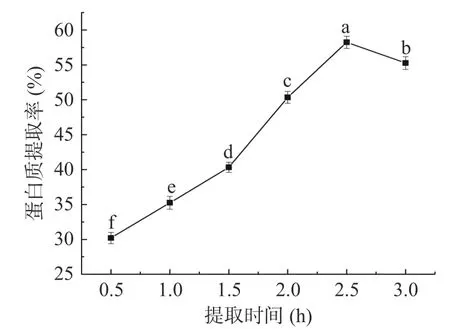
图6 提取时间对柑橘皮蛋白提取率的影响Fig.6 Effect of extraction time on extraction rate of protein from citrus peel
2.4 响应面优化试验
2.4.1 响应面设计及结果 以pH(A)、提取温度(B)、提取时间(C)、料液比(D)4个单因素为自变量,以柑橘皮蛋白质提取率的大小为响应面的响应值,利用Box-Behnken一共设计出29组试验,相应的响应面试验设计方案及结果见表2。
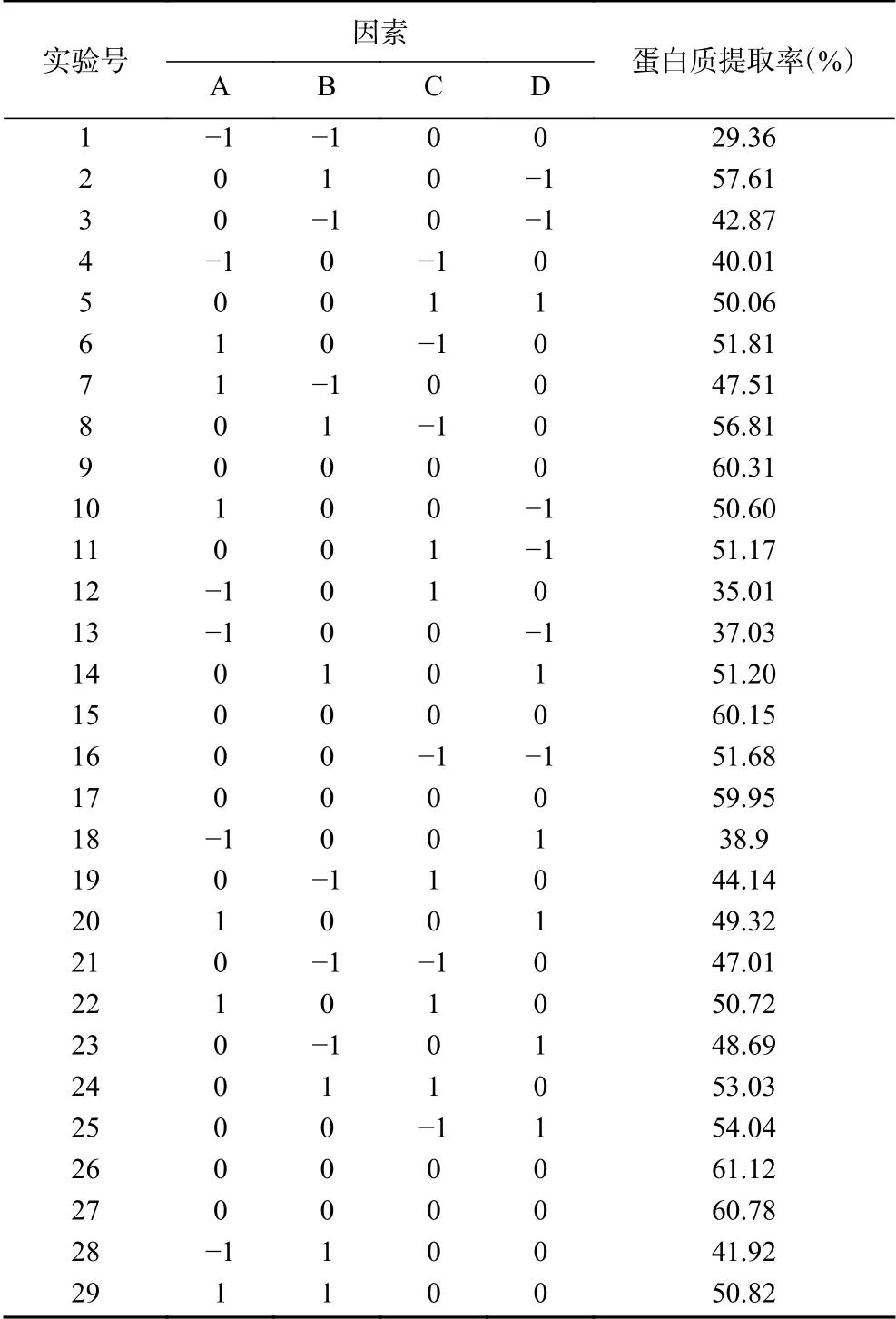
表2 响应面试验设计方案及结果Table 2 Experimental design and results for response surface analysis
2.4.2 响应面模型的建立与分析 根据Design-Expert 8.0.6对响应面模型结果进行拟合分析,以pH、提取温度、提取时间、料液比四个因素为自变量,以柑橘皮蛋白质提取率为响应面响应值的二元回归方程:Y=60.46+6.55A+4.31B−1.43C+0.10D−2.31AB+0.97AC−0.79AD−0.23BC−3.05BD−0.85CD−11.99A2−5.99B2−4.19C2−4.47D2。
由表3可知,模型中一次项A(pH)、B(提取温度)、C(提取时间)对柑橘皮蛋白质提取率影响极显著(P<0.01),D(料液比)对柑橘皮蛋白质提取率影响不显著(P>0.05);模型中AD、CD对蛋白质提取率影响显著(P<0.05),BC对蛋白质提取率影响不显著(P>0.05),其余都是极显著(P<0.01),这说明了各因素对柑橘皮蛋白质提取率的影响并不只是简单的线性关系。此外,该模型中P<0.0001、F值为382.54、失拟项P=0.3104(>0.05),该响应面模型差异极显著,模型失拟项不显著,说明实验方法与设计可靠、合理,且其他未知因素对该实验结果影响较小;其中模型决定系数R2=0.9974,校正系数R2Adj=0.9948,这说明模拟预测值与真实试验值在试验范围内模拟度非常好。所以,回归方程可以用来分析与预测柑橘皮蛋白质提取的工艺结果。根据F值得大小可知,影响柑橘皮蛋白质提取率因素的主次顺序为:pH>提取温度>提取时间>料液比。

表3 回归模型方差分析Table 3 Analysis of variance in regression model
2.4.3 响应面各因素相互作用分析 响应面曲面的凹凸程度反映了各因素对柑橘皮蛋白质提取率的影响大小。当一个响应曲面曲率越大时,说明响应值对于因素大小的变化十分敏感;当响应面曲率较小时,说明响应值对因素大小的变化不敏感[27]。如图7a~图7c所示,三个曲面的曲率相对较大,其中p H与提取温度的交互作用大于p H与提取时间和p H与料液比的交互作用对响应值的影响,其中p H的变化对柑橘皮蛋白质提取率影响最大。再结合图7d~图7f曲率可知,提取温度、提取时间、料液比两两之间的交互作用对响应值的影响相对较小,提取率对提取温度改变的敏感程度大于提取时间,提取率对料液比改变的敏感程度最低。因此4个因素对柑橘皮蛋白质提取率影响次序为:pH>提取温度>提取时间>料液比,与方差分析结果一致。

图7 各因素交互对柑橘皮蛋白提取率的影响的响应面图Fig.7 Responsesurface methodology for theeffect of interaction of variousfactorson the extraction rateof citrus peel protein
2.4.4 最佳工艺验证试验 利用Desig-Expert8.0.6软件优化回归模型进行的工艺参数,确定提取柑橘皮蛋白质的最适工艺条件为p H为12.12,提取温度为52.8℃,提取时间2.59 h,料液比1:42.1(g/mL),预测蛋白质提取率为63.01%。为证明响应面优化设计的合理与可靠性,进行试验验证,考虑到实际操作的可行性,将工艺条件修改为:pH为12.1,提取温度为52.8℃,提取时间2.6 h,料液比1:42(g/mL)。进行三次验证试验,得到的蛋白提取率为62.23%±0.22%。这与模型预测值的相对偏差为1.2%,说明该提取条件参数可靠,具有较好的可行性。经计算,最优条件下提取的蛋白质纯度为42.3%。
2.5 柑橘皮蛋白质抗氧化活性
2.5.1 DPPH·清除能力测定 DPPH·溶液为紫色,会与抗氧化物质发生还原反应导致溶液褪色,并且在517 nm处存在最大吸收峰,根据吸收值的变化来判断物质的抗氧化能力强弱[28]。如图8所示,在浓度为1~5 mg/mL范围内,VC对DPPH·的清除率稳定在93%~94%之间,各浓度之间差异不显著(P>0.05);在浓度为1~3 mg/mL范围内,柑橘皮蛋白质对DPPH·清除率随着浓度的增加而显著上升(P<0.05),当浓度处于3~5 mg/mL范围时,柑橘皮蛋白质对DPPH·清除率趋于稳定,各浓度间差异不显著(P>0.05),其清除率最高可达87.5%,经数据分析,柑橘皮蛋白质对DPPH·的IC50为1.20312 mg/mL,其IC50小于10 mg/mL,说明柑橘皮蛋白质具有较好的抗氧化效果[29]。VC对DPPH·的IC50明显小于柑橘皮蛋白质,所以,柑橘皮蛋白质对DPPH·清除效果小于VC。
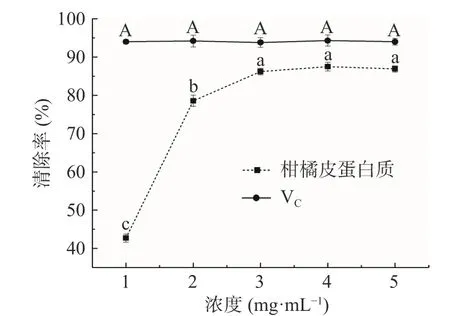
图8 柑橘皮蛋白质和VC对DPPH·清除率Fig.8 Scavenging effect of VC and citrus peel protein on DPPH· radical
2.5.2 H2O2清除能力测定 由图9可知,在浓度为0.2~1.0 mg/mL范围内,柑橘皮蛋白质对H2O2的清除率随着浓度的增加而显著上升(P<0.05),在浓度为1.0~1.2 mg/mL时,柑橘皮蛋白质对H2O2清除率趋于稳定,各浓度间差异不显著(P>0.05),最高清除率可达79.3%;在浓度为0.2~1.0 mg/mL,VC对H2O2的清除率显著上升(P<0.05),当浓度超过0.4 mg/mL时,VC对H2O2清除率趋于稳定,各浓度间差异不显著(P>0.05),最高清除率可达92.8%;经数据分析,柑橘皮蛋白质清除H2O2的IC50为0.52516 mg/mL,VC对H2O2的IC50小于柑橘皮蛋白质对H2O2的IC50,所以,VC对H2O2的清除效果好于柑橘皮蛋白质。

图9 柑橘皮蛋白质和VC对H2O2清除率Fig.9 Scavenging effect of VC and citruspeel protein on H2O2 radical
2.5.3 ·OH清除能力测定 ·OH是一种对人体毒害很大的自由基,它能与人体内的蛋白质、DNA等物质发生氧化反应,导致人体细胞受损或坏死[30]。由图10可知,在浓度为0.2~1.0 mg/mL范围内,随着浓度的增大,柑橘皮蛋白质和VC对·OH的清除率均显著上升(P<0.05),在浓度为0.2 mg/mL时,柑橘皮蛋白质对·OH清除率略大于VC,当浓度为1.0~1.2 mg/mL范围内,柑橘皮蛋白质与VC对·OH的清除率趋于稳定,各浓度间差异不显著(P>0.05);其中VC对·OH的IC50为0.48629 mg/mL,柑橘皮蛋白质对·OH清除率的IC50为0.79207 mg/mL,据相关文献报道,曹伟等[31]利用盐法提取的茶籽蛋白质对·OH的IC50为2 mg/mL,表明其对·OH清除能力小于柑橘皮蛋白质,这可能由于蛋白质提取方法的不同以及不同植物蛋白的结构差异导致的。根据IC50值的大小可以判断出柑橘皮蛋白质对·OH清除效果小于VC。

图10 柑橘皮蛋白质和VC对·OH清除率Fig.10 Scavenging effect of VC and citrus peel protein on ·OH radical
2.5.4 N O−2清除能力测定 如图11可知,在浓度为0.2~1.0 mg/mL范围内,柑橘皮蛋白质和VC对NO−2的清除率随着浓度的增加而显著上升(P<0.05),当柑橘皮蛋白质浓度在1.0~1.4 mg/mL范围内,柑橘皮蛋白质对于N O−2的清除率趋于稳定,各浓度间差异不显著(P>0.05),清除率最高可达到59.3%;当VC浓度在1.2~1.4 mg/mL范围内,其对N O−2的清除率趋于稳定,变化不显著(P>0.05),清除率最高可达89.8%;经数据分析,柑橘皮蛋白质对N O−2的IC50为0.87216 mg/mL,VC对N O−2的IC50为0.47847 mg/mL,根据IC50值可以判断柑橘皮蛋白质对N O−2的清除效果小于VC。

图11 柑橘皮蛋白质和VC对N O−2清除率Fig.11 Scavenging effect of VC and citruspeel protein on N O−2 radical
3 结论
本实验采用碱法提取柑橘皮蛋白质,并结合响应面优化设计得到柑橘皮蛋白提取的最佳工艺,确定了最佳提取工艺:p H为12.1,提取温度为52.8℃,提取时间2.6 h,料液比1:42(g/mL),在此条件下进行三次核对检验试验,最后得到柑橘皮蛋白质提取率为62.23%±0.22%,与预测值63.01%接近。说明该模型对试验拟合程度较高,工艺合理可靠;柑橘皮蛋白质对对DPPH·、H2O2、·OH、和N O−2清除率的IC50值分别为1.20312、0.52516、0.79207、0.87216 mg/mL,其值均小于10 mg/mL,表明柑橘皮蛋白质具有较好的体外抗氧化活性,但其抗氧化活性均小于VC。该实验结果可为废弃柑橘皮提供新的资源化利用途径,且柑橘皮蛋白质可以作为新的抗氧化食品应用。
虽然柑橘皮蛋白质在体外表现出较好的抗氧化活性,但是其具体发挥抗氧化作用的机制以及在体内是否还能保持这样的作用还需要进一步研究。

