马氏珍珠贝来源DPP-IV抑制活性肽的虚拟筛选及其作用机制
李 姣,苏继磊,陈 敏,戴世鲲,高永利,尹 浩,
(1.中国科学院南海海洋研究所,中国科学院热带海洋生物资源与生态重点实验室,仪器设备公共服务中心,广东广州 510301;2.中国科学院大学,北京 100049;3.南方海洋科学与工程广东省实验室(广州),广东广州 511458)
近年来,活性肽作为一种天然安全的食品补充剂得到了迅速发展,其重要的生理调节功能致使其在人类健康保健预防上占有一席之地[1]。目前的研究已证实牛奶,大豆等食品蛋白的水解物具有一系列生理活性,如抗氧化、抗炎、降血压、降血糖血脂等[2−6]。糖尿病是一种高发高危性的慢性疾病,据报道,到2030年,全球糖尿病患病人数将突破4亿,其中2型糖尿病占绝大多数,约占比90%[7]。在糖尿病的发生发展中,胰岛β细胞分泌的胰岛素多肽(GIP)和胰高血糖素样肽1(GLP-1)起着关键的调控作用,而二肽基肽酶IV(DPP-IV)则可以降解这些激素,致使其在体内的含量降低,从而导致血糖的升高[8−10]。因此,抑制DPP-IV的活性,成为控制血糖的关键步骤。已知上市的具有DPP-IV 抑制活性的药物有西格列汀、沙格列汀、阿格列汀等[11−12]。然而,其副作用使这些化学药物的使用受到限制。因此,寻找安全有效的DPP-IV活性抑制替代物成为近年来的研究热点。经研究发现,某些具有2~8个氨基酸的肽可抑制DPP-IV,其活性受氨基酸组成,序列长短,疏水性等各种因素影响[13]。
在活性肽的制备过程中,传统的制备方法是以活性为导向的一系列分离纯化,然后鉴定出活性肽单体,其过程繁琐,需要耗费大量的人力物资,且收率低[14],并且因其分段的活性测定方法导致错过某些活性极强的单肽。因此需要寻找一种高效寻找活性肽的方法,以实现大量制备。
随着计算机技术的发展,其在活性药物筛选,结构优化设计上近年来有了明显的突破,使用计算机对小分子化合物进行虚拟筛选,结构设计在医药领域已得到广泛的应用。然而,使用这一技术对活性肽进行全面系统的虚拟筛选并不多见。常见的虚拟筛选方法包括基于受体蛋白的分子对接以及基于配体小分子的药效团模型。Nongonierma等[15]运用分子对接技术预测了二肽抑制DPP-IV的潜力,然而,利用药效团模型对DPP-IV抑制活性多肽进行筛选并不多见。Wang等[16]采用已知的ACE抑制肽构建了药效团模型,并进行了初步验证,然而并未利用构建的药效团进行肽分子的筛选。
在前期的研究中,利用Biopep数据库采用在线虚拟酶解方法,发现马氏珍珠贝蛋白来源的活性肽具有较高的DPP-IV抑制潜力。因此本研究继续以马氏珍珠贝蛋白为研究对象,利用PeptideCutter平台在线酶解,产生小分子肽库,通过建立DPP-IV抑制肽的药效团模型,采用最优药效团模型及分子对接方法对肽库进行虚拟筛选,以鉴定出具有高活性的DPP-IV抑制肽。
1 材料与方法
1.1 材料与仪器
二肽基肽酶IV(DPP-IV)、抑二肽素A(IPI)、甘氨酰-脯氨酰-对硝基苯胺对甲苯磺酸(Gly-Pro-pNA)美国Sigma公司;合成肽LPIY、VQDR、PIY和APSL(纯度>98%) 吉尔生化(上海)有限公司。
Discovery Studio(DS)软件 美国Accelrys公司;K 3 Plus酶标仪 上海宝予德科学仪器有限公司。
1.2 实验方法
1.2.1 药效团模型的产生 如图1所示,从Biopep数据库中,收集了40个已知的具有DPP-IV抑制活性小肽作为模型建立和验证的数据集[17],其中20个作为训练集用于产生药效团模型,剩余的20个组成测试集用作药效团模型的验证。采用ChemOffice 2018构建活性肽结构,并赋与CHARMM力场进行能量优化。采用Discovery Studio软件中“3D QSAR Pharmacophore Generation”生成药效团模型。在构象产生时,设置“Best”构象生成方法,并限定产生的最大构象数为250,新产生的构象与最低能量构象之间的能量差不大于20 kcal·mol−1,用于产生药效团模型的化学特征有:氢键受体(A)、氢键给体(D)、疏水中心(H)和阴离子中心(N)。将不确定值(Uncertainty)值设为2,其余参数为软件默认值。
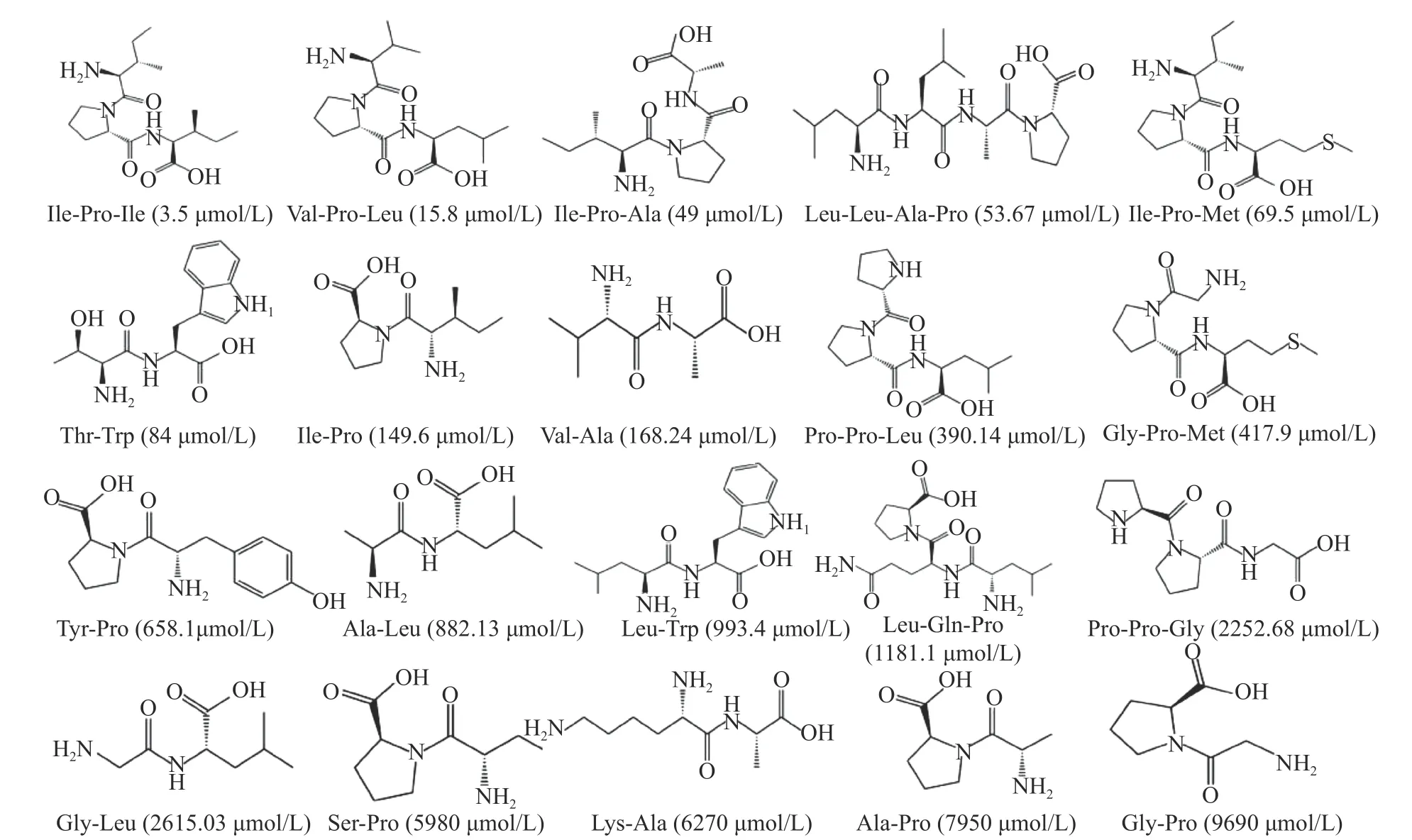
图1 用于构建药效团模型的训练集的肽结构Fig.1 Structure of peptidesin thetraining set used to construct the pharmacophore model
1.2.2 药效团模型的验证 为检验药效团是否具有预测能力,采用测试集分子,Fisher随机验证对药效团模型进行评价。
1.2.2.1 测试集分子验证 为检测该药效团模型的预测能力,本研究选取除训练集以外已报道的20个不同结构的DPP-IV抑制活性肽分子作为测试集,采用DS软件中的“Ligand Pharmacophore Mapping”模块对模型进行验证,测试集肽分子的构象产生方式与训练集相同。
1.2.2.2 Fisher 随机验证 Fisher随机验证是通过对训练集中的分子重新分配活性值,从而产生药效团模型,如果随机产生的药效团模型优于之前产生的模型,则证明先前产生的模型是随机产生的,不具有统计学意义,反之则具有统计学意义,通过设置置信度为95%,对模型进行Fisher随机验证。
1.2.3 肽库的构建 从UniProt数据库(http://www.uniprot.org/)中选取了十一条来源于马氏珍珠贝肉的蛋白,其编码为M 5AKJ3,M 5AJM 7,M 5AKK3,M 5AJP7,B3GRV7,Q2AAD2,Q967M 3,Q0ZVW7,A0A510EA 34,A0A0N7J6H6,A 0A 0P0LDM 5。参考Yang等[18]的做法,采用PeptideCutter在线酶切所选的蛋白序列,所用到的蛋白酶有胰蛋白酶、胃蛋白酶、糜蛋白酶以及脯氨酸内切蛋白酶,在线虚拟酶解完后,选取氨基酸个数小于或等于5的小分子多肽组成多肽库。
1.2.4 药效团模型对肽库的筛选 使用构建好的药效团模型对建立的小分子多肽库进行搜索,整个搜索过程在“Search 3D Database”中完成,设定搜索方法为‘BEST’,其余参数保持不变。
1.2.5 分子对接 参考Nongonierma等[19]的方法进行分子对接,DPP-IV 3D结构从PDB生物大分子数据库(PDB code:1WCY)检索获得,使用AutoDock Tools(version 1.5.6)对其去水,加氢并设置搜索空间。格点坐标及盒子体积设置如下:size_x=18,size_y=16,size_z=18,center_x=56.133,center_y=63.602,center_z=39.577。对接前将蛋白晶体结构中原始配体Diprotin A提取出来重新对接,计算RMSD值,如果RMSD<2Å,证明对接程序可信。将经药效团模型筛选后理论活性值较高的前23个多肽(匹配值FitValue>6.0)与DPP-IV进行Autodock Vina分子对接,进一步筛选得到理论上活性高的多肽。肽结构均由ChemOffice 2018软件画的,能量最小化后与蛋白对接,产生的结合能用于表示小分子与蛋白结合的稳定性,结合能越低,表明小分子与蛋白结合得越稳定,其理论上的活性值越大。
1.2.6 肽的固相合成 肽由上海吉尔生化有限公司合成的,纯度大于98%,其分子量采用LC-MS确定,纯度采用HPLC测定[20]。
1.2.7 体外DPP-IV抑制活性测定 DPP-IV抑制实验参考Ibrahim等[21]的方法稍作修改。将25μL的DPP-IV(总浓度为0.0035 U/mL)与100μL的样品溶液混合并保温10 min,控制组以Tris-HCl缓冲液代替样品加入。随后加50μL浓度为1 mM底物(Gly-Pro-pNA溶液)分别到样品组和控制组,继续保温反应1 h,使用酶标仪测量405 nm的吸光度。每个样品进行三次重复实验,DPP-IV酶活性抑制率根据以下公式计算:
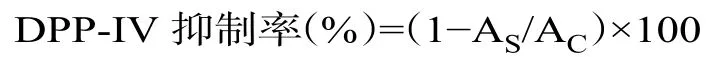
式中:As组为多肽样品存在时的吸光度;Ac为控制组的吸光度。
1.3 数据处理
采用GraphPad Prism 8.0.1的单因素方差分析进行统计分析。所有实验均重复三次,数据表示为平均值±标准偏差,以P<0.05时表示差异显著。
2 结果与分析
2.1 药效团模型的产生
由20个多肽组成的训练集产生了10个药效团模型,其相应的统计评分如表1所示,一般来说,评差(Δcost),config值,均差(RMS),以及相关度可用于综合评价药效团是否具有统计学意义。在理想的药效团模型中,总评值(total cost)应位于固定值(fixed cost)和空值(null cost)之间,接近前者,并远离后者,并且,null cost和total cost差值(Δcost)应大于60,才表明该模型统计学意义大于90%,即说明模型具有良好的预测能力[22−24]。另外,模型的config值应小于17,RMS值应小于1.5,相关度应大于0.9。从下表1可以看出,产生的十个药效团的Δcost,RMS,相关度都在合理的范围内,均具有统计学意义。同时,Hypo1因具有最大的Δcost和相关度,最小的RMS,被认为是理论上最优药效团模型。Hypo1对训练集的预测结果如表2所示,从表2可以看出,其对训练集中各分子的预测IC50值与真实IC50值较为接近,误差值(Error)保持在±4以内,预测结果良好。
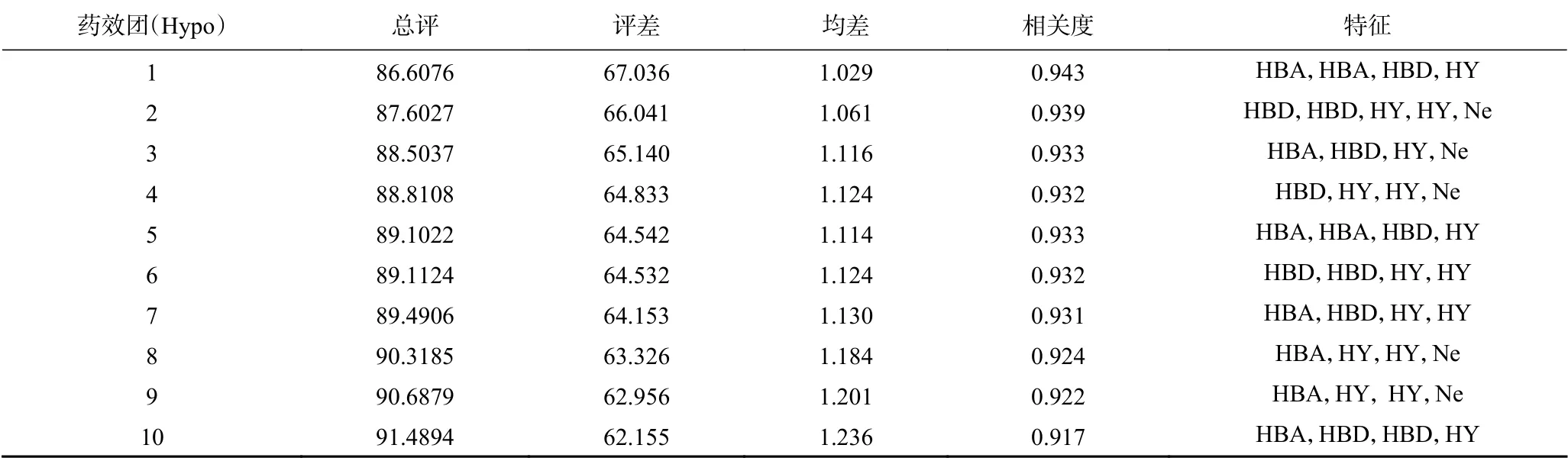
表1 建立的药效团的各项参数Table 1 Parameters of the established pharmacophore
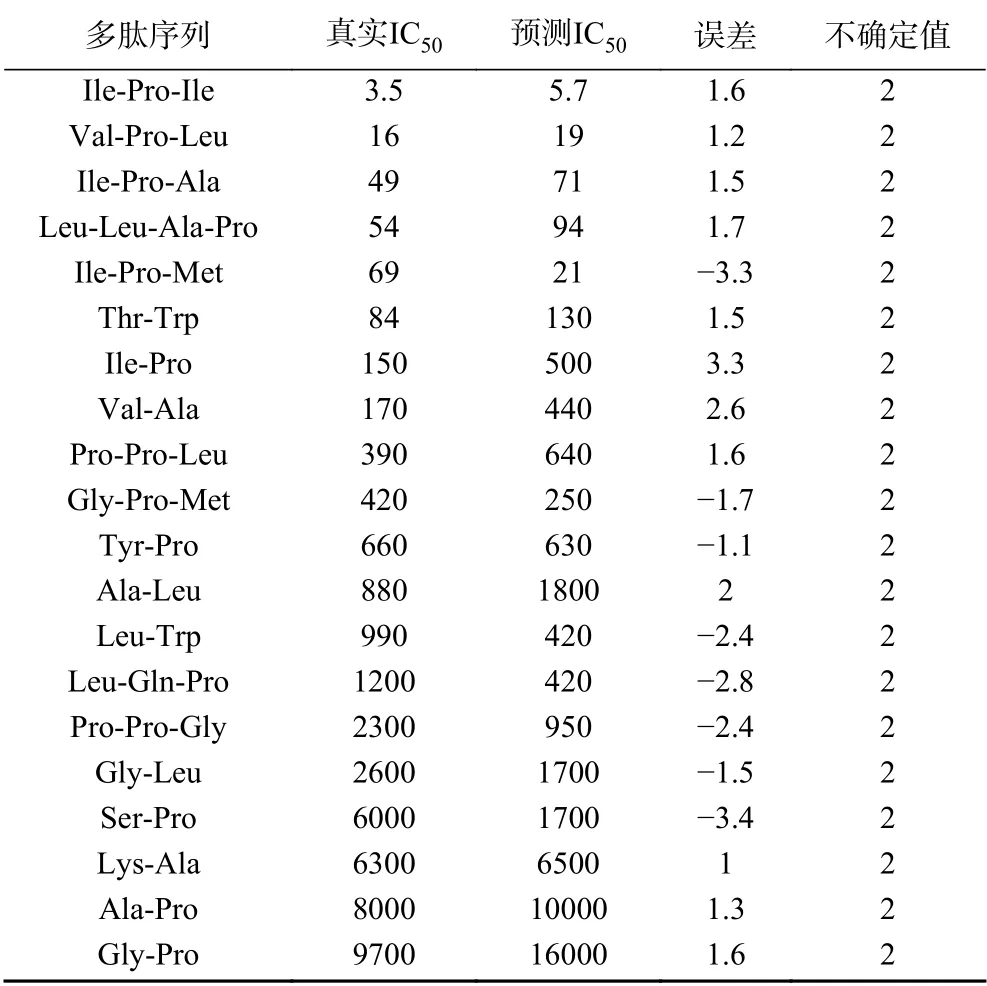
表2 Hypo1对训练集分子的预测Table 2 Prediction of Hypo1 for training set molecules
Hypo1含有的药效团特征有氢键受体,氢键给体,疏水特征,各药效团之间的空间距离如下图2A所示。Hypo1对训练集中的活性最强,即真实IC50值最小的肽分子(Ile-Pro-Ile)以及活性最弱的肽分子(Gly-Pro)预测结果分别如图2B和2C所示,活性最强的分子同药效团完全匹配上,而活性最弱的分子则有一个疏水特征没有匹配上。
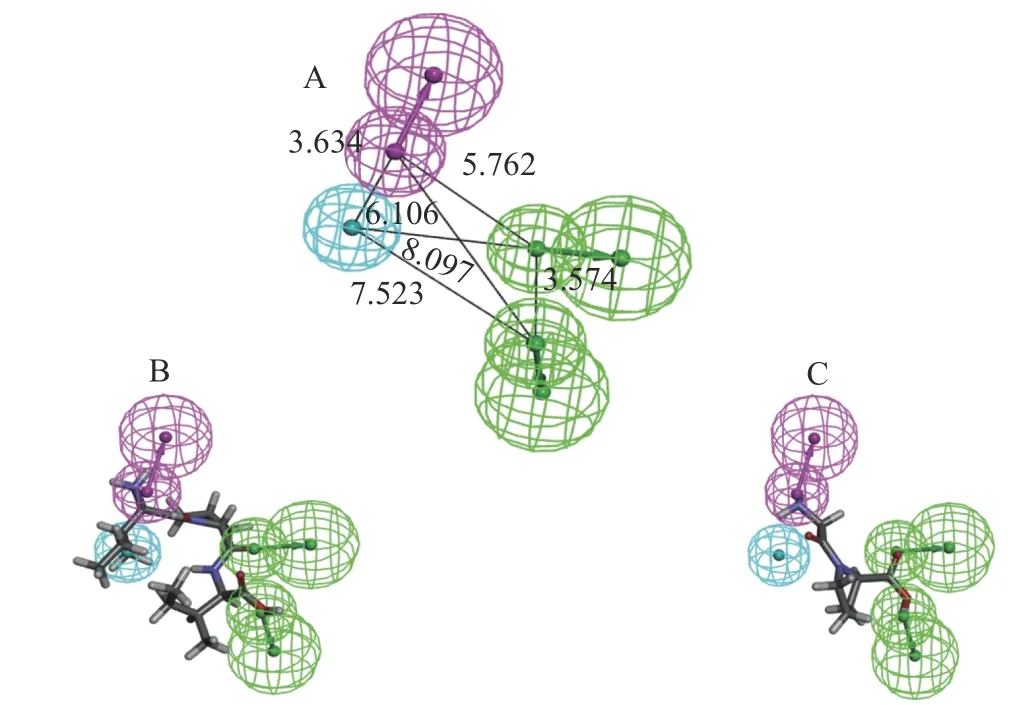
图2 最优药效团模型及其与训练集分子的匹配Fig.2 Optimal pharmacophore model and its aligning with training set molecules
2.2 药效团模型的验证
为了验证Hypo1对除训练集以外的其他肽分子也有预测作用,以文献中20个具有DPP-IV抑制作用的其他分子组成测试集,对Hypo1进行验证,结果如图3A所示,得到其真实活性与预测活性值之间的决定系数R2为0.81,相关性良好。这表明Hypo1不仅能预测训练集中的肽,对除训练集以外的多肽也具有一定活性预测能力。采用Fisher随机验证以判断药效团的产生是否具有偶然性,结果如图4B,可以看出,随机产生的19个药效团模型相比Hypo1(original),其总评值(cost值)都要更大,这表明本研究中产生的Hypo1不是偶然产生的,具有一定的统计学意义。
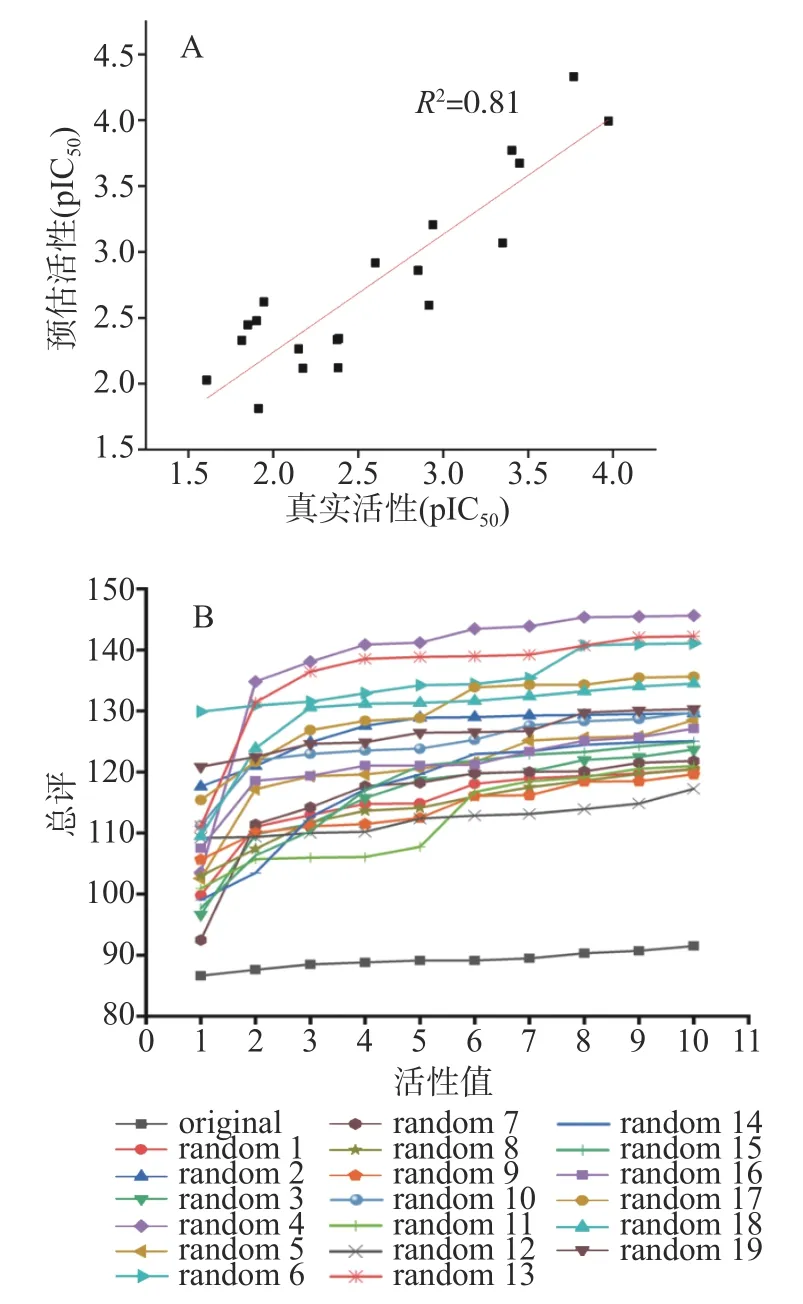
图3 药效团模型的验证Fig.3 Verification of the pharmacophore model
2.3 肽库的筛选及活性验证
将珍珠贝肉虚拟酶解产生的192个小分子多肽组成多肽库,能量最小化后,使用Hypo1对多肽库进行筛选,选择Fit value值大于6.0的肽进行分子对接,以进一步筛选高活性DPP-IV抑制肽,其结果如下表3所示。从表3可以看出,多肽LPIY,VQDR,PIY及APSL与DPP-IV的结合能最低,分别为−8.0,−7.8,−7.6,−7.6 kcal/mol。因此选择这四个肽分别固相合成,测定2.5 mg/mL时它们的DPP-IV抑制率,结果如图4所示,VQDR和PIY并没有展示活性,而LPIY及APSL却表现了极好的DPP-IV抑制率,分别为79.43%±0.61%和80.3%±0.24%(P>0.05),而阳性对照IPI在浓度为1.5 mg/mL时,DPP-IV抑制率为80.06%±0.44%。进一步测得LPIY和APSL的IC50值,分别为521.19和258.67μmol/L。通过观察这两个肽分子的结构特点,可以发现它们的N-端第二位均为脯氨酸(Pro),且两端均有疏水性氨基酸。Nongonierma等[25]研究报道,肽氨基酸序列中含有脯氨酸可以极大地促进DPP-IV抑制活性,Nong等[26]也指出,N-端第二个位置为Pro或Ala是DPPIV抑制肽的明显特征。并且,两端的疏水性氨基酸也可以促进酶抑制活性的提高,本研究与以往的报道相符。
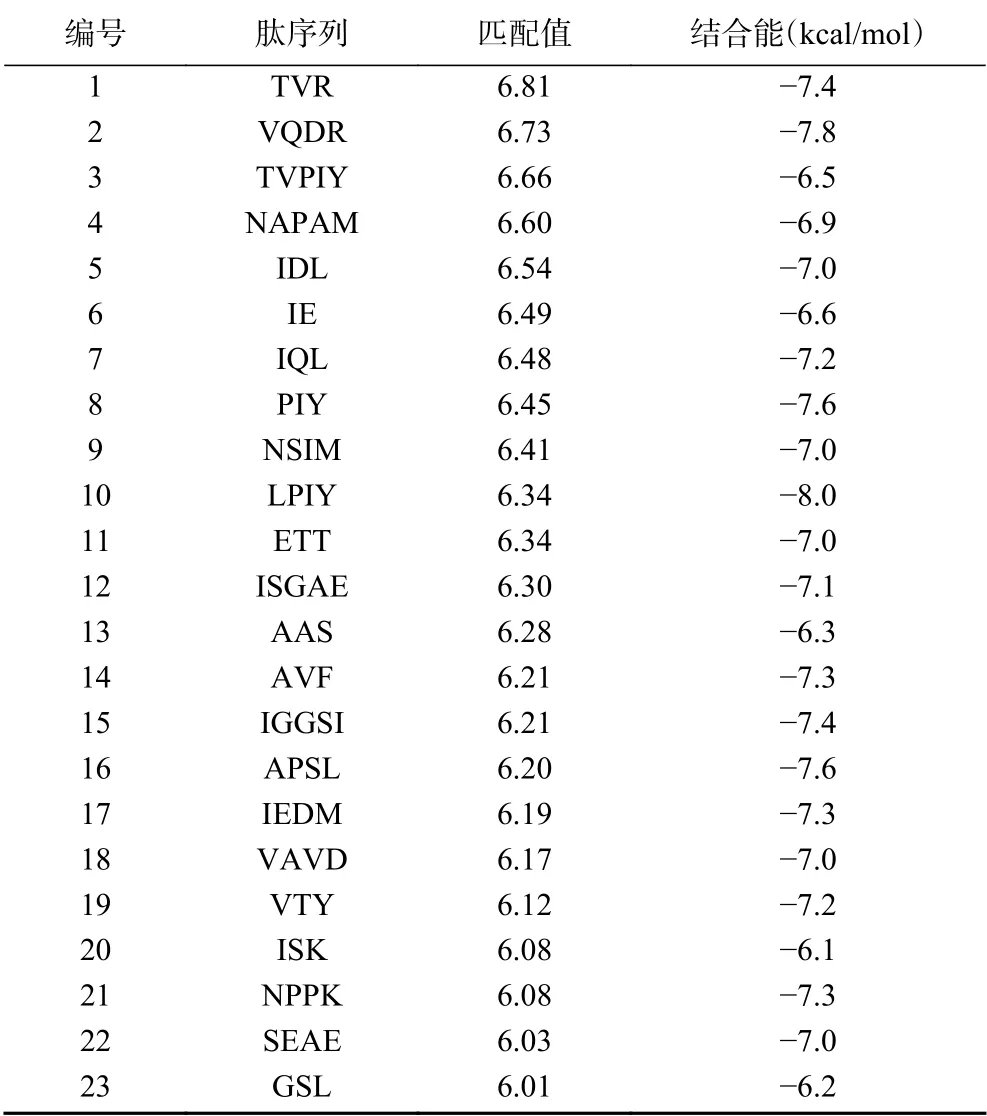
表3 23个预测的DPP-IV抑制肽及分子对接结合能Table 3 23 predicted DPP-IV inhibitory peptides and molecular docking binding energy
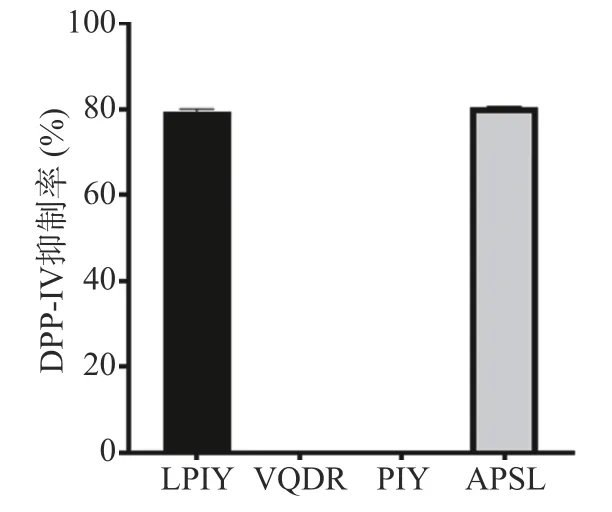
图4 合成肽的DPP-IV抑制率Fig.4 DPP-IV inhibition rate of synthetic peptides
2.4 分子作用机理
在多肽分子对接前,首先将原配体重新对接后到晶体结构中,其RMSD值为1.2Å,表明对接算法程序适用于本次对接。图5展示了两个高活性的四肽LPIY及APSL与DPP-IV之间的相互作用图,从图5A可以看出,两个肽均很好地嵌合在DPP-IV的活性口袋中。DPP-IV一共包含有三个活性口袋,即S1、S2及S3,S1口袋包括氨基酸残基Ser630、Asn710和His740,S2口袋由Arg125、Glu205和Glu206组成,S3口袋由Tyr547、Arg358和Phe357组成[27−28]。从图5B可以看出,肽LPIY与DPP-IV中的Asn710形成了两个氢键,与Glu206,Arg669各形成了一个氢键,其中Asn710为S1中的残基,Glu206为S2中的氨基酸残基。其中的脯氨酸(Pro)与Tyr547形成了Pi-Alkyl作用,Tyr547位于S3活性口袋中。图5C表示四肽APSL与氨基酸残基Glu205形成了两个氢键,与Glu206、His740、Asn710、Arg125和Tyr631各形成了一个氢键,其中His740和Asn710属于S1口袋,Glu205、Glu206和Arg125属于S2口袋,中间的脯氨酸与Phe357形成了Pi-Alkyl作用,Phe357也是S3活性口袋中的氨基酸残基。可见,两个肽均与DPP-IV活性口袋中的氨基酸残基形成了相互作用,并且,它们N-端第二位的脯氨酸均与S3口袋中的氨基酸残基形成了Pi-Alkyl作用,这些作用对于肽-酶结合的稳定性起到了极为关键的作用。另外,肽与DPP-IV之间还有范德华作用,Pi-Sigma作用等。Xu等[29]发现他们鉴定的所有的肽均与S1,S2或S3口袋残基有着相互作用,如PAGPF(Asn740和Ser630)、KTMPGP(Tyr547和Arg358)、IPQVS(Asn740,Arg125和Glu206)、ELHQEEPL(Arg125,Glu206和Arg358),且这些肽均含有一个或多个脯氨酸,这说明脯氨酸及其与活性口袋残基之间的相互作用可能是肽具有DPP-IV抑制作用的重要原因之一。
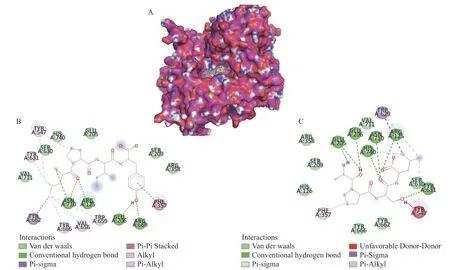
图5 活性肽与DPP-IV的对接Fig.5 Molecular docking between the peptidesand DPP-IV
3 结论
本研究构建了用于DPP-IV抑制肽筛选的3DQSAR药效团模型,其中Hypo1经评估后为最优药效团模型,其Δcost为67.036,相关度为0.943,RMS为1.029,含有的药效团特征为两个氢键受体,一个氢键给体,一个疏水基团。采用在线网站PeptideCutter对珍珠贝肉蛋白进行虚拟酶解,产生的192个氨基酸数小于或等于5的小分子肽组成肽库,采用Hypo1以及分子对接对肽库进行筛选,得到四个理论上具有高潜力的DPP-IV抑制活性肽(LPIY,VQDR,PIY和APSL)。活性验证后发现VQDR和PIY没有活性,而LPIY和APSL具有较高的DPP-IV抑制活性,其IC50值分别为521.19和258.67μmol/L。经文献调研后发现肽序列中含有脯氨酸并且脯氨酸在N-端第二位时其DPP-IV抑制活性明显,本研究筛选的两个高活性肽符合这一特征。这一结果也表明,以后的研究工作中,虚拟筛选时若结合构效关系研究将进一步提高筛选的成功率。两个肽与DPPIV的结合模式表明脯氨酸与活性口袋中氨基酸残基形成的相互作用对于维持肽-酶稳定性起到了关键作用,下一步的研究将集中在体内活性抑制机理中。
——以高中化学“氢键”的教学为例

