菊花不同提取物代谢组学分析及其抗氧化活性功效物质成分筛选
严 淘,杨敏敏 ,施 琳,3,4, ,高若曦,刘天启,张 妍,卫钰成,张华峰,3
(1.陕西师范大学食品工程与营养科学学院,陕西西安 710119;2.陕西师范大学,西北濒危药材资源开发国家工程实验室,陕西西安 710119;3.陕西师范大学,中俄食品与健康科学国际联合研究中心,陕西西安 710119;4.陕西师范大学,西安市特色水果贮藏与保鲜重点实验室,陕西西安 710119)
菊花(Dendranthema morifolium(Ramat.)Tzvelev)为菊属(Dendranthema (DC.)Des Moul.)的干燥花,在我国被广泛种植,是药食兼优食品的典型代表。杭白菊(Chrysanthemum morifoliumcv.Hangju)被誉为八大名菊之一,作为中药被收录于《中国药典》(2010年版),也在2002年被卫生部收录进第一批药食同源食品名录。杭白菊中主要含有酚类、黄酮类、萜类、有机酸类等多种成分,具有抗氧化、抗衰老、增加机体免疫力等生理活性作用[1]。现有研究表明,菊花中所含的多酚、黄酮类化合物是它发挥抗氧化功效的重要物质。雷康藤等[2]发现6种不同产地菊花均具有一定的抗氧化活性,且它们的黄酮化合物种类及含量存在一定差异;杨璐齐等[3]测定了6种不同种类菊花的抗氧化活性,发现其中黄金菊的抗氧化活性最强,总酚含量也最高。然而,目前对不同方法提取的菊花抗氧化活性研究报道较少,且现有研究大都认为菊花的抗氧化活性主要归功于其总酚和黄酮类化合物,忽略了菊花本身是一种富含多种活性物质、多种成分共存互作的复杂体系,以偏概全地将一种或数种成分来代表、预测包含成百上千种化学成分的复杂系统,研究缺乏整体性。
高通量代谢组学以组群指标分析为基础,以高灵敏度检测和高维数据处理为手段,以信息建模与系统整合为目标,从宏观角度研究机体变化,可实现对植物化学物质监控或者评价[4],具有评价菊花等药食同源植物的营养价值和个性化用药的潜力[5]。代谢组学研究技术主要包括核磁共振(NMR)、液相色谱-质谱联用(LC-MS)、气相色谱-质谱联用(GC-MS)等[6−8]。其中LC-MS以其灵敏、快速、高效、检测范围广泛等特点,在植物源活性成分的分析检测、植物品种和产地区分、不同产地药材的品质差异分析等方面得到广泛应用[4,9−11]。多元统计分析是一种综合分析方法,它能够在多个对象和多个指标互相关联的情况下分析它们的统计规律,是进行复杂体系中的成分分析和差异代谢物筛选等研究的主要手段[12−14]。Zou等[15]通过代谢组学技术分析了不同颜色药用菊花代谢水平的差异,发现代谢通量的改变导致黄菊总黄酮含量的增加;韩正洲等[16]分析了栽培型与野生型野菊花药材的主要差异代谢物,筛选出香叶木素-7-O-芸香苷等区分栽培型和野生型野菊花的特征性成分。
因此,本研究采用植物非靶向LC-MS代谢组学检测不同方法提取的富硒杭白菊中多元、多维化学物质成分,首次运用基于双重复交叉验证的无偏递归式的变量选择统计方法(偏最小二乘和随机森林模型)探索菊花抗氧化功效物质组分,评价菊花中营养物质的提取工艺,打破传统以偏概全地用一种或数种含量最多、最显著的成分来代表、预测包含成百上千种化学成分的复杂系统营养功效的局限,以期为富硒杭白菊靶向功能性物质提取工艺优化提供新的思路和理论基础。
1 材料与方法
1.1 材料与仪器
富硒杭白菊 安康聚源实业有限公司提供,选择大小均一、无机械损伤的菊花头状花序,用去离子水清洗后烘干,研磨后密封保存[17];没食子酸 纯度≥99%,成都市科龙化工试剂厂;福林酚试剂、ABTS、DPPH分析纯,美国Sigma公司;芦丁纯度98%,成都曼斯特生物科技有限公司;过硫酸钾 分析纯,天津市天利化学试剂有限公司;抗坏血酸(VC) 纯度≥99%,天津市天利化学试剂有限公司。
Multiskan Go全波长酶标仪 美国热电公司;AB Triple TOF 5600/6600质谱仪AB SCIEX公司;Agilent 1290 Infinity LC超高压液相色谱仪Agilent公司;低温高速离心机 Eppendorf5430R公司;色谱柱ACQUITY UPLC BEH Amide(1.7μm,2.1 mm×100 mm)、ACQUITY UPLC HSS T3(1.8 μm,2.1 mm×100 mm) 美国waters公司。
1.2 实验方法
1.2.1 提取物制备 参考文献[18]中的方法制备菊花不同工艺提取物。
1.2.1.1 水煎提取物Boiling water extract(BWE)的制备 精密称取菊花样本50 g,用400 mL超纯水浸泡30 min。电炉煎煮,沸腾后保持微沸1 h;放冷后用纱布过滤,滤渣中再加入300 mL水,煎煮30 min,重复此步骤3次;将3次水煎液合并,抽滤,于旋转蒸发仪50℃恒温加热浓缩,直至稠膏状。
胖子也出声安慰:“错不在你,谁知道随手开个箱子,世界就乱套了呢。”说完转头继续看向老道,“这么说,这些法器还挺邪乎啊。”
1.2.1.2 热回流水提物(Reflux water extract,RWE)的制备 精密称取菊花样本25 g,转移至250 mL圆底烧瓶中,用200 mL超纯水浸泡20 min。置于电热套上65℃加热回流提取60 min,放冷后过滤,滤渣再加入200 mL水,重复提取3次。将3次提取的滤液合并,抽滤,于旋转蒸发仪50℃浓缩至稠膏状。
1.2.1.3 超声波辅助水提物(Ultrasonic assisted water extract,UWE)的制备 精密称取菊花样本25 g,置于300 mL密封玻璃瓶中,加入200 mL 75%乙醇溶液,摇匀后浸泡20 min。设置超声波清洗机参数为40 k Hz,90 W,45℃,提取30 min,重复3次。将3次提取的滤液合并,抽滤,于旋转蒸发仪50℃浓缩至稠膏状。
1.2.1.4 超声波辅助醇提物(Ultrasonic assisted ethanol extract,UEE)的制备 精密称取菊花样本25 g,置于300 mL密封玻璃瓶中,加入200 mL超纯水,摇匀后浸泡20 min。设置超声波清洗机参数为40 kHz,90 W,45℃,提取30 min,重复3次。将3次提取的滤液合并,抽滤,于旋转蒸发仪50℃浓缩至稠膏状。
1.2.1.5 超声波辅助醇提取水煎剩余物(Ultrasonic assisted ethanol extract-Waste boiling water extract,UEE-Waste)的制备 收集1.2.1.2水煎法提取后的滤渣(Waste-BWE),晒干后置于烘箱60℃烘干15 h。精密称取滤渣25 g,置于300 mL密封玻璃瓶中,加入200 mL无水乙醇溶液,摇匀后浸泡20 min。设置超声波清洗机参数为40 kHz,90 W,45℃,提取30 min,重复3次。将3次提取的滤液合并,抽滤,于旋转蒸发仪50℃浓缩至稠膏状。
1.2.2 代谢组学实验方法 本研究采用超高效液相串联四极杆飞行时间质谱(UHPLC-Q-TOFMS)技术,结合数据依赖采集方式对样本进行分析,获得一级质谱和二级质谱数据,采用XCMS[19]对数据进行峰提取和代谢物鉴定。
1.2.2.1 样本预处理 水提浸膏组样本(BWE、RWE、UWE、UEE、UEE-Waste)精密称量60 mg,分别加入200μL水进行匀浆;Waste-BWE样本在液氮中研磨后精密称量60 mg,加入1 mL甲醇乙腈水溶液(2:2:1,v/v)。将上述处理后样本涡旋60 s,低温超声30 min,重复2次,−20℃放置1 h沉淀蛋白,过滤管过滤后在3000 r/min和4℃条件下离心20 min,取上清冷冻干燥,−80℃保存样本。
1.2.2.2 色谱-质谱分析 样品采用超高效液相色谱系统HILIC色谱柱进行分离;柱温25℃;流速为:0.3 mL/min;流动相组成为A:水+25 mmol/L乙酸铵+25 mmol/L氨水,B:乙腈;梯度洗脱程序如下:0~0.5 min,95%B;0.5~7 min,B从95%线性变化至65%;7~8 min,B从65%线性变化至40%;8~9 min,B维持在40%;9~9.1 min,B从40%线性变化至95%;9.1~12 min,B维持在95%;整个分析过程中样品置于4℃自动进样器中。为避免仪器检测信号波动而造成的影响,采用随机顺序进行样本的连续分析,并在检测队列中插入质控样品监测和评价系统的稳定性及实验数据的可靠性。
样本检测完毕后,采用质谱仪对代谢物进行鉴定,采集样品的一级、二级谱图。ESI源条件如下:离子源气体1(Gas1):40,离子源气体2(Gas2):80,气帘气(CUR):30,源温度:650℃,电压浮动(ISVF)±5000 V(正负两种模式);二级质谱采用信息依赖获取(IDA)获得,并且采用高灵敏度模式,去簇电压(DP):±60 V(正负两种模式),碰撞能量:35±15 eV,IDA设置如下:排除4 Da之内的同位素,每个周期监测候选离子数:10。数据采集是按质量范围进行分段:50~300、290~600、590~900、890~1200,从而扩大二级谱图的采集率,每个方法每段采集四个重复。所采集获得的数据,分别使用自建MetDDA和Lip DDA方法进行代谢物的结构鉴定。
1.2.3 总酚和总黄酮含量测定
1.2.3.1 总酚含量测定 参照国标GB/T 8313-2018[20]测定总酚含量。没食子酸标准品溶液浓度在1.760~7.040μg/mL范围内线性关系良好,回归方程为:y=0.0584x+0.0617,R2=0.9976。
1.2.3.2 总黄酮含量测定 参照深圳市标准化指导性技术文件SZDB/Z 349-2019[21]测定总黄酮含量。准确称取0.02 g的芦丁标准品,用60%乙醇溶液溶解并定容于100 mL容量瓶中,摇匀后作为芦丁标准溶液。用移液枪准确吸取0、0.25、0.50、1.00、2.00、3.00、4.00、6.00 mL芦丁标准溶液于8个25 mL具塞比色管中,用60%乙醇溶液补充至6.0 mL,加1 mL亚硝酸钠溶液,摇匀,放置6 min,加入1.5 mL硝酸铝溶液,摇匀,放置6 min,加入4 mL氢氧化钠溶液,用60%乙醇溶液定容至刻度,摇匀,放置15 min。在波长510 nm处测定吸光度,以吸光度值对应含量绘制标准曲线。芦丁标准品溶液浓度在2.000~48.000μg/mL范围内线性关系良好,回归方程为:y=0.0058x+0.0446,R2=0.9976。
1.2.4 抗氧化活性实验方法
1.2.4.1 菊花不同提取物对DPPH自由基的清除能力 参照李璐等[22]的实验步骤测定DPPH自由基清除能力。用无水乙醇配制0.04 mg/mL的DPPH溶液。配制不同浓度梯度的样品溶液。实验设样品组和对照组。样品组:1 mL样品液(精密称取菊花不同提取物浸膏,分别用蒸馏水配制成0.02、0.04、0.06、0.08、0.10、0.12、0.14、0.16、0.18、0.20 mg/mL不同浓度梯度的溶液)+2 mL DPPH无水乙醇溶液;第一对照组:1 mL蒸馏水+2 mL DPPH无水乙醇溶液;第二对照组:1 mL样品液+2 mL无水乙醇;混匀后避光反应30 min,立即在517 nm波长下测定吸光度。VC作为阳性对照品,测定方法同上。自由基清除率的计算公式为:
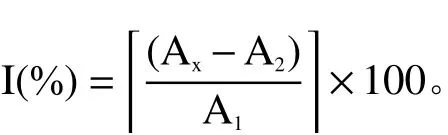
式中,I为不同提取物对自由基的清除率,%;A1为第一对照组吸光度;A2为第二对照组吸光度;AX为样品组吸光度。以样品浓度为横坐标x,自由基清除率为纵坐标y,进行拟合后得到拟合方程,根据方程计算出相对半效剂量(EC50)。
1.2.4.2 菊花不同提取物对ABTS+自由基的清除能力 参照李璐等[22]的实验步骤测定ABTS+自由基清除能力。将等体积的7.4 mmol/L的ABTS溶液和2.6 mmol/L的过硫酸钾溶液均匀混合,避光反应12 h后稀释得到ABTS溶液。实验设样品组和对照组。样品组:1 mL样品液(精密称取菊花不同提取物浸膏,分别加蒸馏水配成0.02、0.04、0.06、0.08、0.10、0.12、0.14、0.16、0.18、0.20 mg/mL梯度溶液)+4 mL ABTS溶液;第一对照组:1 mL蒸馏水+4 mL ABTS溶液;第二对照组:1 mL样品液+4 mL无水乙醇;混匀后避光反应6 min,立即在734 nm波长下测定吸光度。VC作为阳性对照品,测定方法同上。自由基清除率计算公式同1.2.4.1。以样品浓度为横坐标x,自由基清除率为纵坐标y,进行拟合后得到拟合方程,根据方程计算出相对半效剂量(EC50)。
1.3 数据处理
如图1所示,对不同提取方式菊花的组间单个化合物进行差异倍数分析,并采用ANOVA单因素分析对其代谢组学测定结果进行显著性检验,最终结果以Bonferroni校正后的P值为准。MUVR(Multivariate methods with Unbiased Variable selection in R)算法是由Shi等[23]为计算及预测变量和相应变量之间关系而开发的一种新型算法,主要通过在重复的双重交叉验证(repeated double cross-validation,rd CV)过程中执行递归变量消除来实现最小最优变量选择。采用MUVR算法对不同提取方式菊花的代谢物组建立偏最小二乘(PLS)模型和随机森林(RF)模型进行变量选择分析,找出最能够表征不同提取方式区别的差异代谢物,在展示差异的同时从上千化合物中筛选出最优预测差异的代谢物组成,并结合体外抗氧化活性的测定结果筛选出最优表征抗氧化活性差异的代谢物。以上分析采用R(V 3.6.1)软件进行,运用R包“mix Omics”[24]、“MUVR”[23]和“ggplot2”[25]。
图1 统计分析流程图Fig.1 Statistical analysis flowchart
2 结果与分析
2.1 菊花不同方法提取物代谢轮廓差异
采用基于LC-MS技术的代谢组学方法对样本进行了代谢轮廓变化分析,得到的典型总离子流色谱图(Total Ions Chromatograph,TIC)图谱(图2)。其中正离子模式共下可检出418种代谢物,负离子模式下可检出358种代谢物。其中包括1,3-二咖啡酰基奎宁酸、氯原酸等醇类或多元醇,甜菜碱、精氨酸等氨基酸多肽类化合物,抗坏血酸6-棕榈酸酯、乙酰肉毒碱等脂肪酸脂类化合物,葡萄糖、甘露糖等糖类化合物,三羟黄酮、芹菜素-7-葡糖苷等黄酮苷类化合物等。结果表明,在两种模式下不同方式提取的菊花代谢物组成均有很大差异。现有研究表明,菊花众多代谢物中存在不同的功效物质组分,但对于不同提取方式菊花代谢物差异的比较鲜有研究。李孟等[26]从怀菊花和怀菊茎叶共鉴定出69种成分,并发现其主要功能成分为亚麻酸、棕榈酸、亚油酸等。郑璐璐等[27]采用小鼠血管通透性实验和小鼠耳肿胀实验验证了野菊花的抗炎药效组分为绿原酸、木犀草素-7-O-β-D-葡萄糖苷、芹菜素7-O-β-D-葡萄糖苷和蒙花苷。

图2 正离子模式和负离子模式下不同提取方式菊花样品TIC图Fig.2 TIC of Chrysanthemum samples with different extraction methods in positive and negative ion mode
2.2 三种水提物代谢物组和抗氧化活性差异
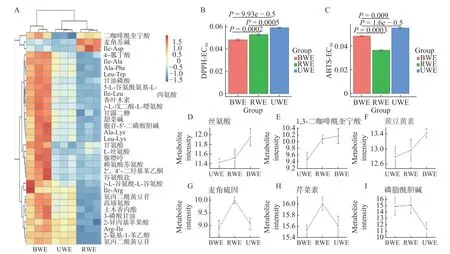
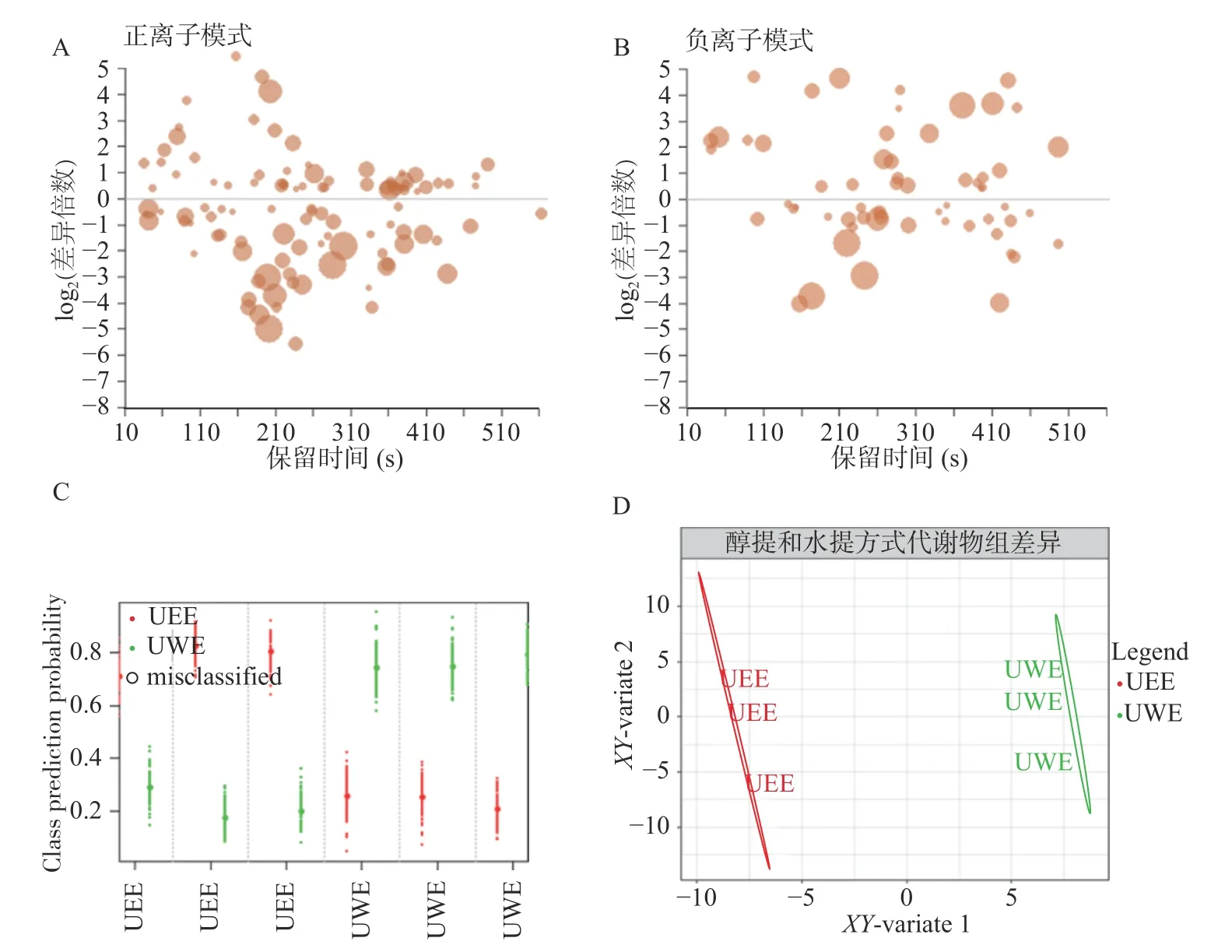
分别在正离子模式和负离子模式下对BWE、RWE和UWE三组不同方式水提菊花样品代谢物进行差异倍数分析(图3A、图3B)。分别计算RWE组、UWE组代谢物与BWE组代谢物的差异倍数并进行显著性检验,取差异倍数的log2对数值以缩小差异倍数数值间的差距。结果表明,UWE组与BWE组间代谢物差异相较于RWE组与BWE组之间差异显著(Bonferroni-P<0.05)且部分代谢物差异倍数更大,说明超声波辅助水提与普通水煎水提的差别更大,而热回流水提与普通水煎水提更为接近。差异代谢物能够作为区分三种水提方式的关键信息(图3C、图3D)。基于MUVR-PLS模型优化结合ANOVA多重假设检验分析筛选得到33个显著区别三种不同方式水提菊花的差异代谢物(Bonferroni-P<0.05,图4A)。差异代谢物相对含量在不同组间分布的聚类热图所示(图4A),30个代谢物在BWE组中含量高于其他两组,而在RWE组中含量最低;麦角硫因和天冬氨酸在RWE组中含量最高,在BWE组中含量最低。
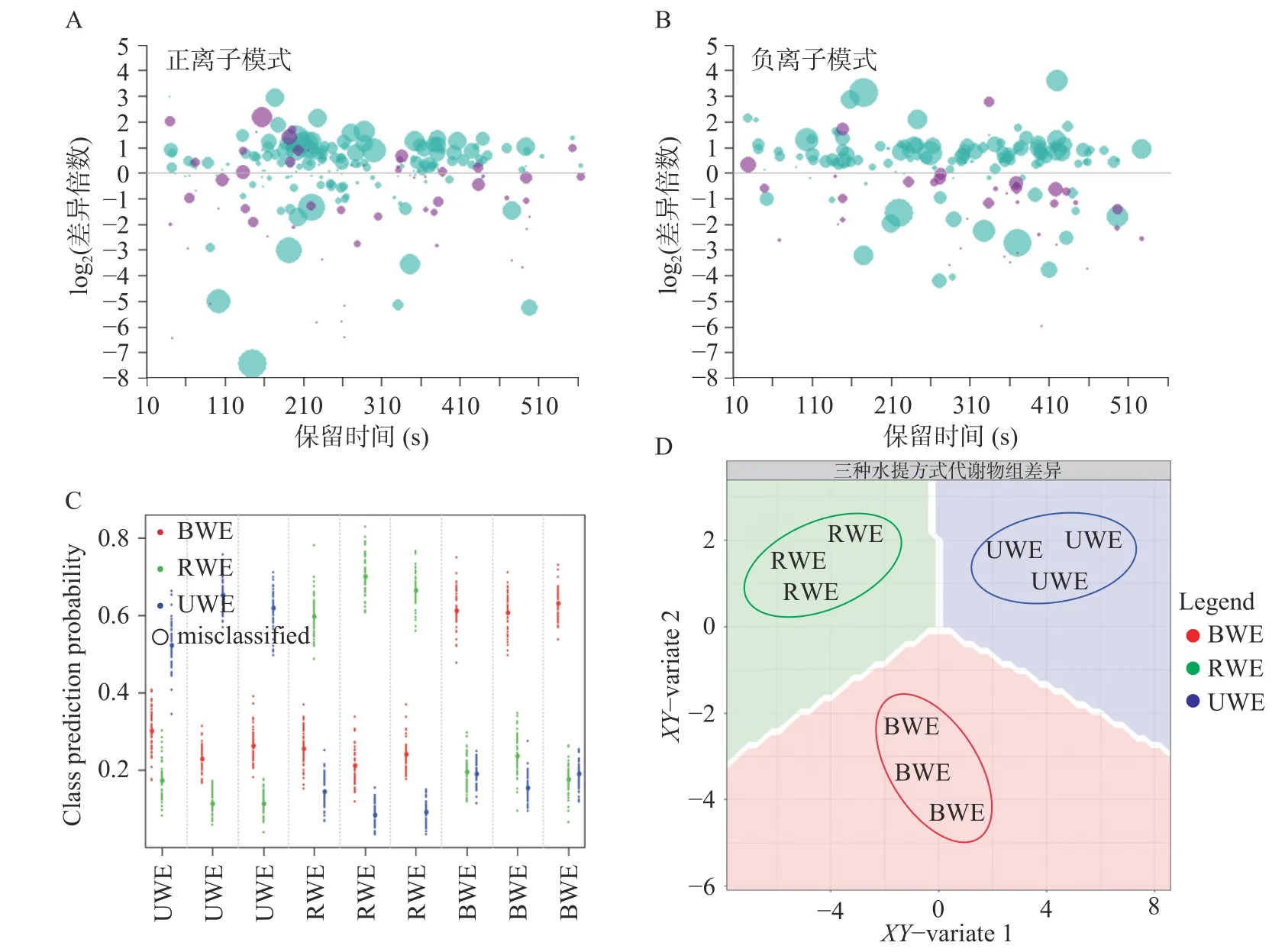
图3 三种菊花水提物的差异倍数分析和多元统计分析Fig.3 Fold change and multivariatestatistical analysis of Chrysanthemum water extracts
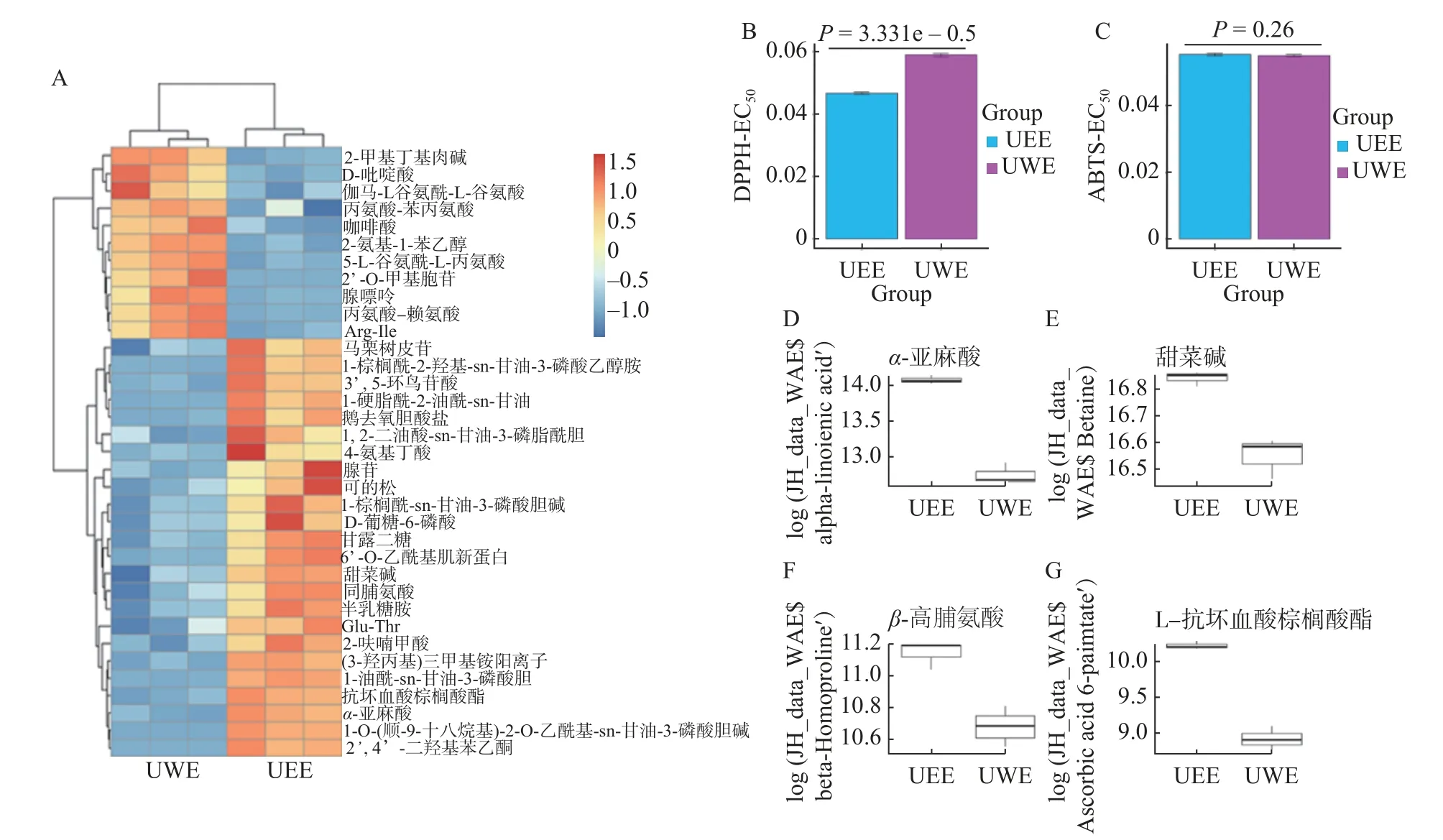
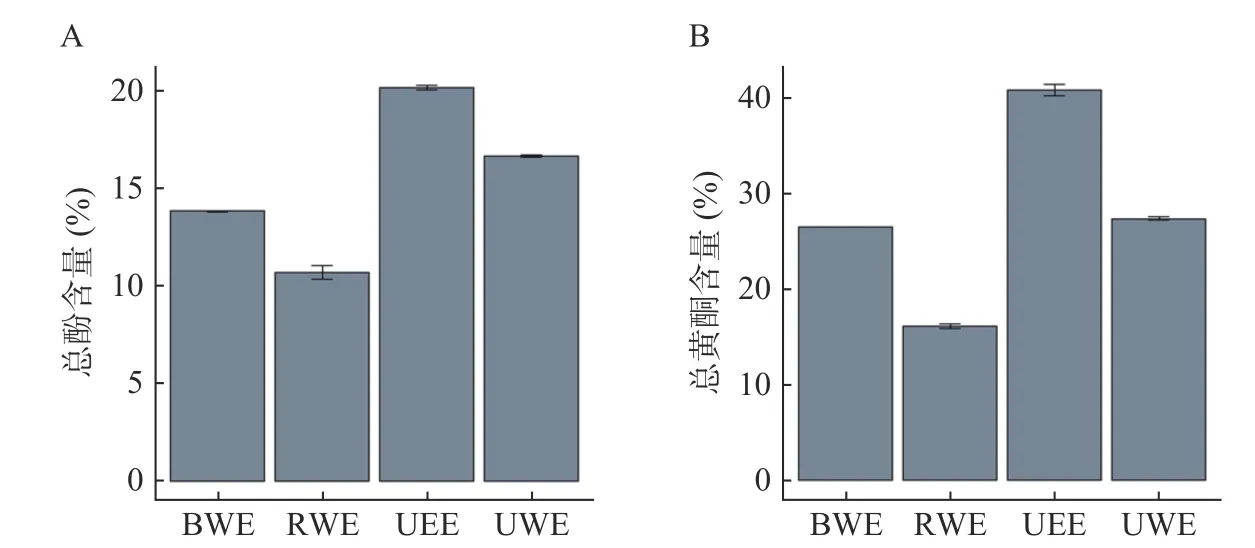
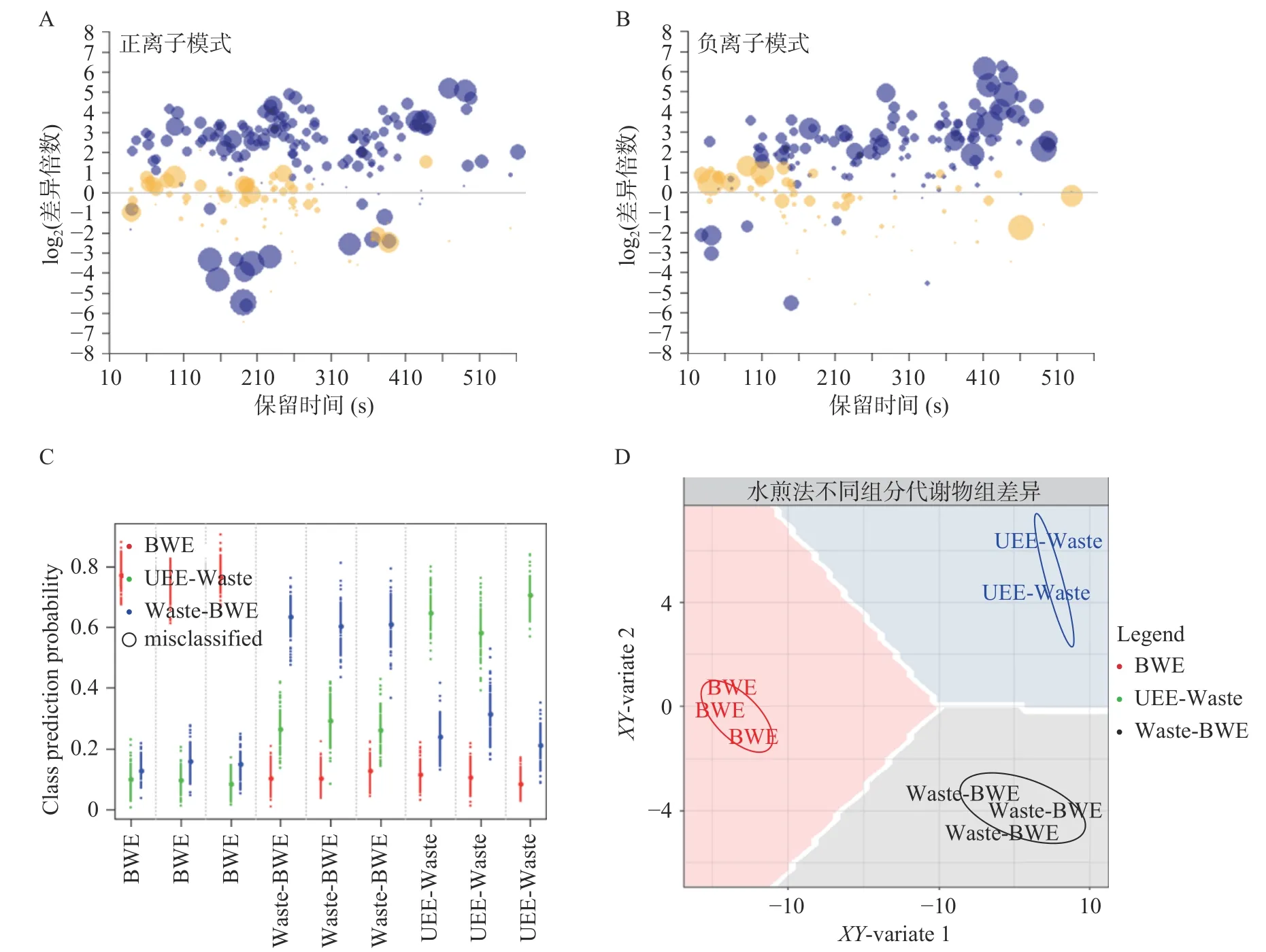
三组不同方式水提菊花提取物对DPPH和ABTS+自由基清除率EC50差异显著(P<0.05,图4B、图4C,表1,表2)。从对DPPH自由基清除的结果来看,EC50大小为VC 表1 菊花不同提取物对DPPH自由基清除活性及其量效关系数学模型Table 1 DPPH radical-scavenging activity and mathematical model of dose-effect relationship of different Chrysanthemum extracts 表2 菊花不同提取物对ABTS+自由基清除活性及其量效关系数学模型Table 2 ABTS+· radical-scavenging activity and mathematical model of dose-effect relationship of different Chrysanthemum extracts 用MUVR-RF模型筛选能够最优表征三组水提组对ABTS+自由基清除效果的差异代谢物(图4G、图4H、图4I)。结合单因素分析和多元统计分析的结果,筛选出三个具有抗氧化活性的物质麦角硫因、芹菜素和磷脂酰胆碱,并发现它们在BWE、RWE和UWE中的含量,与其对ABTS+自由基清除效果呈显著正相关(P<0.05)。前期研究发现,麦角硫因作为一种神经保护剂,通过其强大的抗氧化活性来保护HT 22海马神经元免受H2O2诱导的神经毒性[31];芹菜素在自由基清除系统中具有较强的抗氧化能力,并在细胞和分子水平上保护HPBL免受辐射所致的氧化损伤[32];磷脂酰胆碱和磷脂酰乙醇胺影响脱脂花生油和块状花生油氧化的稳定性,它们能通过减少过氧化和碳中心自由基的生成来减缓块状花生油的氧化[33]。 图4 菊花水提组代谢物和抗氧化活性分析Fig.4 Analysisof metabolites and antioxidant activity of Chrysanthemum water extracts 为了对富硒杭白菊中代谢物的全面检识,进一步分析水提与醇提样本代谢物组,并对照探究两种提取方式对抗氧化活性的潜在影响。对UWE和UEE两组超声提取的菊花样品的代谢物进行差异倍数分析(图5A、图5B)发现UWE组和UEE组的代谢物差异显,差异代谢物能够将它们完全区分开(图5C、图5D)。 图5 菊花超声提取组的差异倍数分析和多元统计分析Fig.5 Fold changeand multivariate statistical analysisof Chrysanthemum ultrasonic assisted extracts 基于MUVR-PLS模型优化结合ANOVA多重假设检验分析筛选得到35个显著区别两组超声提取的菊花的差异代谢物(Bonferroni-P<0.05,图6A)。35个代谢物中多数在UEE组中含量显著(P<0.05)高于UWE组;而咖啡酸和腺嘌呤等少数则在UWE组中含量显著(P<0.05)高于UEE组。 两组超声提取菊花样品的DPPH自由基清除率EC50差异显著(P<0.05),而ABTS+自由基清除率无显著差异(图6B、图6C)。从DPPH自由基清除的结果来看,EC50大小为UEE 图6 菊花超声提取组代谢物和抗氧化活性分析Fig.6 Analysisof metabolitesand antioxidant activity of Chrysanthemum ultrasonic assisted extracts 从上述结果来看,探索性的发现代谢物α-亚麻酸、甜菜碱、β-高脯氨酸和L-抗坏血酸棕榈酸酯或是区分UWE和UEE组菊花提取物的抗氧化活性功效物质组的成分。 分别采用Folin-Ciocalteu和NaNO2-Al(NO3)3-NaOH分光光度法,测定不同提取物总酚和总黄酮含量。结果表明,BWE、RWE、UEE、UWE组中总酚含量分别为13.858%、10.708%、16.644%、20.160%(图7A),总黄酮含量分别为26.401%、15.984%、27.299%、40.769%(图7B)。 图7 不同菊花提取物总酚总黄酮含量Fig.7 Content of total phenols and flavonoids in different Chrysanthemum extracts 总酚和总黄酮能够抑制体内自由基的产生,减少组织损伤程度,并且通过抑制免疫细胞释放炎症因子和细胞因子达到缓解炎症的作用,具有很好的抗炎和抗氧化、免疫调节、肝保护、抗衰老、抗肿瘤、抗疟原虫和防治心脑血管疾病等多种药理功能[39−42]。然而,本研究发现杭白菊提取物总酚、总黄酮含量并不能很好的反应其体外抗氧化能力。这一结果表明探索特定表征抗氧化活性的物质的必要性。抗氧化活性的产生并不是所有的酚类和黄酮类化合物都发挥作用,而是某种或数种特定的成分共存互作达到的效果。Gong等[43]对杭白菊酚类化合物进行分析后检测到14种酚类化合物,发现“胎菊”比“多菊”具有更高的咖啡酰奎宁酸含量和更强的抗氧化活性,且二者显著相关。这与本实验的发现相一致。 在两种模式下对BWE、Waste-BWE和UEEWaste三组不同水煎过程菊花样品代谢物进行差异倍数分析(图8A、图8B)。BWE组与Waste-BWE组间代谢物差异巨大,检验结果显著,说明通过水煎法能够充分提取菊花样品中的代谢物,造成水提物与滤渣间的差异;而UEE-Waste组与Waste-BWE组的代谢物也有一定差异,检验结果比较显著,说明将水煎法提取物滤渣再用超声波辅助乙醇提取,能提取出部分水煎法无法提取的代谢物。通过MUVE-PLS模型发现差异代谢物能够作为区分BWE、Waste-BWE和UEE-Waste组的关键信息(图8C、图8D)。 图8 菊花水煎提取过程的差异倍数分析和多元统计分析Fig.8 Fold changeand multivariate statistical analysisof the processof Chrysanthemum water extraction 基于MUVR-PLS模型优化结合ANOVA多重假设检验分析筛选得到50个显著区别三组不同水煎提取过程菊花样品的差异代谢物(Bonferroni-P<0.05,图9)。大部分代谢物在BWE组中含量显著高于另外两组;然而有9种化合物在UEE-Waste组中含量显著高于其他两组,说明超声波辅助醇提可以从水煎的残渣中有效富集这些物质。在这些代谢物中,包括了前面提到的黄豆黄素和α-亚麻酸,都被报道有很好的抗氧化活性。 图9 水煎提取过程菊花样品的差异代谢物热图Fig.9 Differential metabolites heat map of the process of Chrysanthemum water extraction 本研究采用高通量植物液相质谱代谢组学技术及多元统计分析,对不同提取方法(BWE、RWE、UWE和UEE)杭白菊提取物代谢物组化学成分差异进行研究,筛选出最优表征其抗氧化活性的代谢物。建立MUVR-PLS模型对差异代谢物进行筛选,得到区别BWE、RWE和UWE三种不同方式水提菊花提取物的70个差异代谢物,其中33个经过ANOVA多重假设检验分析Bonferroni校正后差异显著;得到区别UWE和UEE两组超声菊花提取物的126个差异代谢物,其中35个差异显著;得到BWE、Waste-BWE和UEE-Waste三组不同水煎过程菊花样品的140个差异代谢物,其中50个差异显著。分别以芦丁和没食子酸为对照品,测定不同方式菊花提取物总黄酮和总酚的含量。结果表明,总黄酮含量和总酚含量均为UEE>UWE>BWE>RWE,而且总黄酮含量明显高于总酚含量。通过测定ABTS和DPPH自由基清除率来评价不同提取物的抗氧化活性。从DPPH自由基清除的结果来看,水提组抗氧化活性大小为UWE

2.3 超声水提和超声醇提代谢物组和抗氧化活性差异
2.4 不同菊花提取物总酚总黄酮含量分析
2.5 菊花水煎提取过程成分变化

3 结论

