东农冬麦1号TabZIP2基因的克隆及低温和ABA作用下的表达调控
关 荧,刘 楠,苍 晶,魏铁锁,吴晶晶,齐 越,郭富烨,李沅珊
(1.东北农业大学 生命科学学院,植物生理与分子生物学实验室,黑龙江 哈尔滨 150000;2.北京卓诚惠生生物科技股份有限公司,北京 100000)
小麦是我国主要的粮食作物,东农冬麦1号是首例能够在黑龙江地区安全过冬的冬小麦品种,目前其体内很多相关抗寒基因已被研究。
转录因子(Transcription factor,TF)是已知响应各种环境和发育线索来调节基因表达的最重要的调节剂之一。人们对它们在减轻各种生物和非生物胁迫以及发育反应中的作用进行了深入研究。其中碱性亮氨酸拉链(bZIP)转录因子代表最大和最多样化的家族之一,并在真核生物中独特存在。它参与真核生物的各种代谢途径和应激反应。bZIP家族的明显特征是存在一个基本的DNA结合结构域,该结构域也负责核定位,与参与二聚化的亮氨酸拉链结构域相邻。
植物bZIP蛋白通过与带有ACGT核心顺式元件的DNA序列结合,例如ABRE、G-box(CACGTG)、C-box(GACGTC)、A-box(TACGTA)、AAGCT(T box)和GCN4基序即TGA(G/C)TCA,从而调节下游基因的表达,参与多种非生物胁迫[1-6]。 bZIP蛋白在激素反应、光信号传导和光形态发生,种子发芽、成熟、花诱导和花发育中也发挥着重要作用[7-10]。bZIP转录因子在缓解各种生物和非生物胁迫以及发育反应方面的作用已经得到了很好的研究。如过表达TabZIP60的拟南芥植株对干旱、高盐和低温的抗性增强[11];OsbZIP73与OsbZIP71相互作用并增强耐寒性[12]。在碳酸氢盐碱性胁迫下,苜蓿中过表达GsbZIP67促进了植物的生长[13]。番茄的SlbZIP38在不同器官中有差异表达,并且在干旱、盐胁迫和脱落酸(ABA)的作用下表达下调[14]。谷子SibZIP8转录因子在逆境胁迫中表达量显著上调[15]。前期东北农业大学植物分子与生理实验室研究过TabZIP1在冬小麦内抗寒性的研究,但是TabZIP2对强抗寒冬小麦抗寒性的影响则少有报道。
本研究首先对冬小麦中的TabZIP2基因进行克隆,然后运用生物信息学手段对其进行分析,并且通过qRT-PCR技术对冬小麦TabZIP2基因在寒胁迫下ABA调控的逆境响应进行相对表达量分析,可为深入探究TabZIP2调控冬小麦的抗寒机制奠定基础,也可为揭示ABA调控信号的响应机制提供理论依据。
1 材料和方法
1.1 试验材料
试验材料为2017年9月在东北农业大学试验田种植的强抗寒品种东农冬麦1号以及弱抗寒品种济麦22,在三叶期喷施ABA,并于5,0,-10,-25 ℃(连续10 d最低温度平均值),分别取样分蘖节和叶片,并放于-80 ℃的冰箱进行冷冻冻存[16]。
1.2 试验方法
1.2.1 RNA的提取及cDNA的合成 在提取冬小麦分蘖节和叶片的RNA时都是采用试剂盒进行提取。
1.2.2TabZIP的克隆 从东农冬麦1号中PCR扩增出TaZIP2的CDS序列(GenBank登录号为KT224373.1),PCR引物为Forward primer:5′-ATGGCATCGTCGCGGG-3′;Reverse primer:5′-CTACCATTCCATCGATTGGTC-3′。PCR程序如下:94 ℃ 5 min;94 ℃ 30 s;56 ℃退火30 s;72 ℃ 30 s;72 ℃ 10 min;4 ℃ ∞。利用胶回收试剂盒(购自康为世纪)进行目的条带回收,并将其连接到pClone007 Vector载体(购自擎科生物)。之后将其转化到大肠杆菌感受态DH5,并且筛选阳性克隆送至哈尔滨擎科生物公司进行测序。
1.2.3 生物信息学的分析 在对蛋白基本理化性质进行生物信息学的分析时主要是使用PASy-ProtParamtool软件进行[17];通过使用SOPMA程序对蛋白质的二级结构进行预测;然后再使用ProtScale对蛋白质的疏水区和亲水区进行在线程序预测;利用2.0版本的ClustalX和8.0版本的DNAMAN软件对多序列比对进行分析[18];搜索时利用NCBI中的BlastP、构建蛋白系统进化树时使用MEGA 6.0软件[19];蛋白亚细胞定位的预测使用TargetP 1.1 Server,使用Ghlorop 1.1 Server对蛋白转运肽进行预测。
1.2.4 表达模式分析 实时荧光定量PCR反应系统为Mx-3000p Real-Time PCR system。根据已得到的TabZIP2基因为模板设计引物。TabZIP2转录因子Forward primer:5′-AATGGTAGAAGTATCCGCAAGC-3′;Reverse primer:5′-GAACTAGAGTCCTTCCGCCTAA-3′。以TaActin(GenBank登录号352987)基因为内参,Forward primer:5′-CCTTAGTACCTTCCAACAGATGT-3′;Reverse primer:5′-CCAGACAACTCGCAACTTAGA-3′。利用ChamQ Universal SYBR qPCR Master Mix(Vazyme)对基因进行RT-qPCR,PCR反应条件为95 ℃ 30 s;95 ℃ 5 s,退火56 ℃ 30 s,72 ℃ 1 min,共40个循环;72 ℃ 1 min;4 ℃ ∞。利用公式2-ΔΔCt计算相对表达量。每个基因的表达分析均进行3次生物学重复,最后的数据用SPSS进行差异显著性分析。
2 结果与分析
2.1 TabZIP2转录因子的克隆结果
分别以-10,-25 ℃的东农冬麦1号分蘖节的cDNA为模板,进行PCR扩增,并且进行琼脂糖凝胶电泳,Marker为2 000 bp,电泳图中2个处理各呈现出1条759 bp的特异性条带(图1),在获得目的基因之后对其进行胶回收,并使其连接到pClone007 Vector载体上,然后对形成的重组质粒进行大肠杆菌DH5α转化并挑选单菌落,接着将单菌落放到LB液体培养基中进行培养,摇菌进行测序。利用DNAMAN软件获取序列并与已知序列比对,比对结果为2个序列基本一致,说明阳性重组体获取成功。

M.DNA分子量标准DL2000;1.-10 ℃时TabZIP2的PCR产物;2.-25 ℃时TabZIP2的PCR产物。M.DNA Marker DL2000;1.PCR product of TabZIP2 at -10 ℃ ;2.PCR product of TabZIP2 at -25 ℃.
2.2 TabZIP转录因子的生物信息学分析
2.2.1 理化性质 利用PASy-ProtParamtool对TabZIP转录因子表达蛋白进行理化性质的预测,结果显示:TabZIP2基因包含759 bp的完整开放阅读框,其编码的蛋白由252个氨基酸组成,分子式为C1118H1826N362O371S10,相对分子质量为26.595 6 ku,理论等电点(PI)为5.5,不稳定性系数(Instability index)为29.36(<40,蛋白稳定),脂肪族系数(Aliphatic index)为61.43,由此可以得出TabZIP2为弱酸性稳定性蛋白质。
2.2.2 TabZIP2蛋白二级结构预测 利用SOPMA对TabZIP蛋白进行二级结构预测(图2),结果显示TabZIP蛋白的α-螺旋(H)为130个,β-转角(T)为6个,延伸片段(E)为14个,无规则卷曲(C)为102个;分别占总蛋白的51.59%,2.38%,5.56%,40.48%,其中α-螺旋(H)和无规则卷曲(C)占大部分。
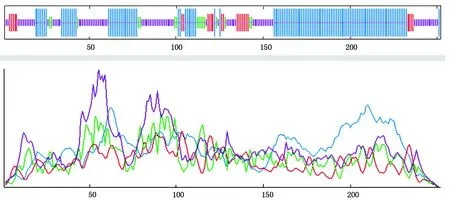
图2 TabZIP2蛋白二级结构的预测Fig.2 The second structure prediction of TabZIP2 protein
2.2.3 TabZIP2蛋白亲水性和疏水性分析 在对TabZIP2蛋白亲水性和疏水性进行分析时,需要使用ProtScale在线程序来进行预测和分析。一般情况下,TabZIP2蛋白亲水性比较强时氨基酸的分值就会较低,TabZIP2蛋白疏水性比较强时氨基酸的分值就会较高。当多肽链达到218和219位时,氨基酸分值是最低的为-3.656,这时蛋白的亲水性是最强的;当多肽链为103位时,氨基酸分值是最高的为1.533,这时蛋白的疏水性是最强的。由此可见,其疏水性氨基酸少于亲水性氨基酸,因此,都是亲水性蛋白质(图3)。

图3 TabZIP2蛋白的亲水性/疏水性预测分析Fig.3 Predictive analysis of hydrophilicity/hydrophobicity of TabZIP2 protein
2.2.4 TabZIP2蛋白的多序列比对结果 将TabZIP2与大麦(HordeumvulgareL.)、水稻(Oryzasativa)、黍(Panicumhallii)、高粱(Sorghumbicolor)的bZIP2蛋白开展多序列比对。其多序列比对结果表明,在TabZIP2蛋白中拥有一个碱性结构域和一个亮氨酸拉链区域,其碱性结构域是与DNA结合的,亮氨酸拉链区域具有二聚化作用(图4)。
2.2.5 系统进化树 用MEGA 6.0软件对小麦与二穗短柄草(Brachypodiumdistachyon)、水稻、黍、高粱、玉米(Zeamays)、华东葡萄(Vitispseudoreticulata)、海枣(Phoenixdactylifera)、刺苞菜蓟(Cynaracardunculus)的bZIP碱基序列的系统发育进行分析。分析结果表明:二穗短柄草、水稻分为一组,TabZIP2的亲缘关系与其较近;高粱、玉米和黍等单子叶植物为一组,即这些单子叶植物的bZIP聚类关系密切相关;华东葡萄、刺苞菜蓟和海枣分为一组,TabZIP2的亲缘关系与其较远(图5)。

蓝色下划线部分表示N端是完整的碱性结构域和C端是亮氨酸拉链结构域。The blue underlined part indicates that the N-terminus is a complete basic domain and the C-terminus is a leucine zipper domain.

图5 9种植物的bZIP蛋白系统进化树Fig.5 Phylogenetic tree of bZIP proteins in 9 plants
2.2.6 TabZIP2蛋白亚细胞定位预测分析 在TargetP在线程序中输入TabZIP2蛋白序列,然后应用在线程序对TabZIP2蛋白亚细胞定位进行预测分析,其中52.6%的TabZIP2蛋白定位在细胞核中、36.9%的TabZIP2蛋白定位在细胞膜中、5.3%的TabZIP2蛋白定位在细胞质中、9%的TabZIP2蛋白定位在其他部位,表明该蛋白亚细胞的定位是在细胞核中。使用Chlorop在线程序预测蛋白TabZIP2信号肽,结果为具有叶绿体转运肽。
2.3 寒胁迫下东农冬麦1号与济麦22号TabZIP2在不同组织中的表达分析
定量结果显示(图6),东农冬麦1号分蘖节中TabZIP2的表达量在0 ℃时表达量降低,在-10 ℃时表达量上升并达到峰值,-25 ℃表达量又再次降低,但是高于5,0 ℃;与分蘖节相比,叶片中TabZIP2的表达量在0,-10 ℃时都显著高于分蘖节,当温度在-10 ℃时达到最高水平,可见与分蘖节相比,叶片要比其提前应答低温胁迫。济麦22分蘖节中TabZIP2的表达量先降低后恢复到5 ℃时的表达水平;叶片中TabZIP2表达量随着温度的降低呈先升高后降低趋势,与东农冬麦1号相同的是,在0,-10 ℃时叶片中TabZIP2的表达量也都显著高于分蘖节,并且同样在-10 ℃表达量最高。从总体来看,0 ℃以后,东农冬麦1号分蘖节和叶片的TabZIP2表达量都较济麦22的分蘖节和叶片表达量高。
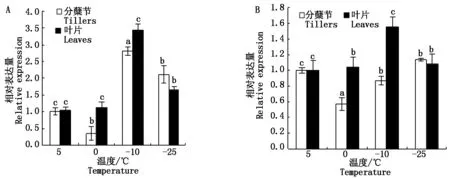
不同小写字母分别表示同一温度下分蘖节与叶片差异在0.05水平上显著。Different lower case letters indicate significant differences between the branching and the leaf at 0.05 at the same temperature.
2.4 ABA对不同温度下东农冬麦1号分蘖节和叶片TabZIP2表达的影响
TabZIP2表达量在经过ABA处理后与对照组相比在分蘖节中表现为5 ℃下调、0 ℃上调,但差异不显著(P>0.05);-10 ℃上调表达,且差异显著(P<0.05)。叶片中经ABA处理后TabZIP2表达量变化趋势与分蘖节相似,但表达量变化倍数小于分蘖节(图7)。
3 讨论与结论
对于真核生物来讲,转录调控无论在生物的生长发育中,还是在信号传导上,又或是逆境的响应上都发挥了至关重要的作用。bZIP转录因子参与了植物的一系列发育过程和胁迫反应。前人研究表明,很多bZIP转录因子在从幼苗到植株的各种组织中都有表达。bZIPs的这种组织特异性表达证实了之前在小麦的研究中,如TabZIP1在冬小麦中随着温度的降低分蘖节中该基因的表达量大于叶片[20];TaABP1受到ABA、高盐、低温和干旱的强烈诱导,其在茎和叶中的表达均强于小麦的根[21]。本试验表明,TabZIP2在分蘖节和叶片中均有表达,且不同温度下表达量存在差异。总体表现为在-10 ℃时TabZIP2在东农冬麦1号和济麦22的分蘖节和叶片中表达量随着温度的降低逐渐升高;但-25 ℃时分蘖节的表达量高于叶片。可见,叶片要比分蘖节提前应答低温。同时分蘖节和叶片都是在-10 ℃时TabZIP2的表达量处于峰值的状态,而这一观点与前期本实验室验证的冬小麦东农冬麦1号开启抗寒机制的关键温度点就是-10 ℃的结论相一致[22]。而0 ℃以后,东农冬麦1号分蘖节和叶片的TabZIP2表达量都较济麦22的分蘖节和叶片表达量高。因此得出结论,TabZIP2的组织特异性表达在不同的小麦品种中表现出不同的表达谱,因此,初步判定TabZIP2的表达量变化情况能够作为小麦抗寒性强弱的判断指标。

不同小写字母表示ABA处理与对照差异在0.05水平上显著。Different lowercase letters indicate ABA treatment and CK at 0.05 level.
本研究对喷施外源ABA条件下东农冬麦1号分蘖节以及叶片的TabZIP2表达量与对照组进行了比较分析,揭示了它们在低温胁迫条件下的差异表达。结果表明,寒胁迫下ABA处理能诱导TabZIP2基因的上调表达。这种反应可能是由于其启动子区存在脱落酸反应元件。研究表明,一组重要的顺式反应元件在其1 kb上游区域中被识别,主要包括脱落酸、生长素、乙烯和赤霉素的反应元件[23]。但在5,0 ℃时喷施ABA的分蘖节和叶片中TabZIP2的表达量没有明显变化,这可能是5,0 ℃时ABA处理过的东农冬麦1号幼苗中的TabZIP2还未对寒冷做出应答。0 ℃以下,随着温度的降低,寒胁迫和外源ABA共同作用,促进了TabZIP2上调表达。许多研究表明,脱落酸(ABA)参与调控植物的非生物胁迫。如小麦中TabZIP14-B在根、茎、叶和幼穗中表达,并通过外源ABA、盐、低温和聚乙二醇(PEG)胁迫处理上调[24]。AtbZIP1可以通过与ABRE元件结合调节植物对ABA处理的敏感性和下游ABA响应基因的表达,从而参与植物的ABA信号传导通路[25]。
本研究首先克隆了东农冬麦1号中TabZIP2基因,之后以生物信息学手段为辅助,通过qRT-PCR技术对TabZIP2在寒胁迫下ABA调控的逆境响应进行分析,结果表明:东农冬麦1号分蘖节和叶片中的TabZIP2表达量高于济麦22;ABA能够正向调节TabZIP2的表达,初步判断从而提高冬小麦的抗寒性。本研究初步探究了TabZIP2在东农冬麦1号抗寒方面发挥的功能,也为低温下ABA信号调控机制提供了信息支持。

