生物有机肥替代化肥对小麦根际土壤环境的影响
王俊红,王星琳,2,王 康 ,任振兴 ,王梦亮
(1.山西大学 应用化学研究所,山西 太原 030006;2.山西大学 生物技术研究所,山西 太原 030006)
20世纪80年代至今,我国粮食产量增加73%,同时化肥用量增加476%,农业生产所用氮肥利用率仅为30%左右[1]。传统农业对化肥的过度依赖,破坏了土壤养分平衡与微生物群落的稳定[2],严重威胁着资源与环境安全,不利于农业可持续发展。生物有机肥是肥菌兼具的新一代微生物肥料,凭借其绿色安全、节约资源的优势成为我国农业绿色、可持续发展的突破口[3]。有研究表明[4-5],生物有机肥替代部分化肥,有利于改善土壤养分循环、增加土壤酶活性、提高作物产量与品质。刘雷等[6]研究发现,增施生物有机肥显著提高了根际土壤酶的活性,改善了土壤肥力水平。此外,生物有机肥中含有的大量促生菌,在促进根系生长,增强作物抗病、抗逆性方面发挥不可替代的作用[7-8]。Chen等[9]研究发现,生物有机肥使土壤微生物多样性与丰富度升高,土壤养分循环与有机质的代谢更加旺盛,显示出更高的生产力以及更强的抗病、抗逆性[10]。陆海飞等[11]研究发现,配施生物有机肥后,土壤细菌群落多样性与丰富度指数显著增加。因此,通过生物有机肥调控土壤微生物群落结构与活动,在保证产量的基础上,减少化肥的施用,对于解决过量施肥带来的环境污染问题、实现“绿色农业”具有重要的意义[12]。
小麦是我国重要的粮食作物,保障其产量持续稳定地增加,关乎国家的粮食安全。将生物有机肥应用于麦田土壤,利用其可改善土壤养分循环、调节根际微生物区系、提高产量与品质,探索生物有机肥替代部分化肥的科学比例与用量,对于促进我国农业经济发展具有重要意义。目前,关于生物有机肥替代部分化肥对小麦产量构成、生育期内酶活影响的报道较多,但是通过高通量测序技术,研究生物有机肥对小麦根际微生物群落结构调控机制尚不多见。
本试验以大田小麦为研究对象,探索生物有机肥替代部分化肥对小麦根际土壤养分、酶活、土壤细菌群落结构的影响,并通过冗余分析研究上述环境因子与细菌群落结构的相关性,旨在为改良传统施肥模式,促进化肥的减量增效,推进生物有机肥规模化应用提供理论支持。
1 材料和方法
1.1 试验地概况
试验地点位于山西省临汾市洪洞县秦壁村(36°13′40.03″N,111°42′1.85″E),平均海拔为530 m,属温带季风气候,年平均温度12.3 ℃,年平均降水量493.3 mm,土壤类型为褐土。
1.2 试验材料
供试小麦品种为莘麦818,由山东莘州种业有限公司育种;供试化肥为复合肥料(N∶P2O5∶K2O=25∶14∶6);供试生物有机肥的有机质含量≥45%,功能菌种为枯草芽孢杆菌(Bacillussubtilis)(有效活菌数≥1.0×109cfu/g),由太原山大新科技发展有限公司生产。
1.3 试验方法
1.3.1 试验设计 试验于2019年10月9日至2020年6月10日进行,采用随机区组设计,共设4个处理,每个处理3次重复。小区面积50.0 m2(25.0 m×2.0 m)。试验设计方案见表1。
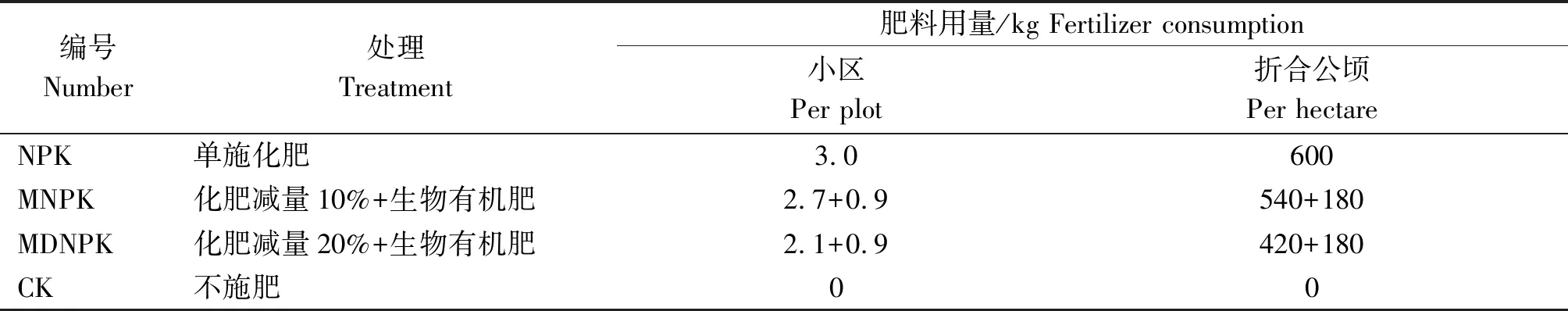
表1 试验设计方案Tab.1 Design of experimental treatment
1.3.2 样品采集与处理 2020年4月18日,在小麦的拔节期采集土壤样品。采用五点取样法,去除表层浮土后,收集0~20 cm小麦根际部位土样,混合均匀,其中一部分土样自然风干后过0.2 mm筛,用于后续土壤养分含量的测定;另一部分土壤样品在4 ℃环境下保存,用于土壤酶活的测定和土壤DNA的提取。
1.3.3 土壤细菌 总DNA提取与PCR扩增使用PowerSoil DNA Isolation Kit(MoBio)试剂盒提取土壤总DNA;采用1.2%琼脂糖凝胶电泳检测提取DNA的大小与完整性,采用Nanodrop 2000检测提取DNA的纯度。
采用通用引物338F对细菌16S rRNA的V3~V4区进行特异性扩增,在338F的3′端添加特异的Barcode序列区分样品。PCR反应体系为25 μL;反应条件为:98 ℃预变性 2 min;98 ℃变性15 s,55 ℃复性30 s,72 ℃延伸30 s,共25个循环;72 ℃延伸5 min,反应结束,产物混匀后通过2.0%的琼脂糖凝胶电泳检测,并将产物进行纯化,回收目标片段,按照各样本测序的需用量,将各产物等摩尔数混合。文库的构建与高通量测序委托上海派森诺生物科技股份有限公司完成,测序平台为Illumina MiSeq平台。
1.4 测定项目及方法
1.4.1 土壤养分含量 土壤有机质(SOM)含量测定采用低温外热重铬酸钾比色法;全氮(TN)含量测定采用凯氏定氮法;速效磷(AP)含量测定采用钼锑抗比色法;速效钾(AK)含量测定采用火焰分光光度计法[13]。
1.4.2 土壤酶活测定 土壤脲酶(Solid-Urease,S-UE)活性测定采用苯酚-次氯酸钠比色法;蔗糖酶(Solid-Sucrase,S-SC)活性测定采用3,5-二硝基水杨酸比色法;中性磷酸酶(Soild-neutral-phosphatase,S-NP)活性测定采用磷酸苯二钠比色法。所用土壤脲酶、蔗糖酶和中性磷酸酶试剂盒均购于南京建成生物工程研究所。
1.4.3 小麦产量的测定 于6月10日在小麦收获期测定小麦产量。各处理随机选取3个1 m2的样点,对小麦株高、穗粒数、千粒质量和产量进行统计。
1.5 数据处理与统计分析
测序结果首先运用Qiimev1.8.0软件识别疑问序列,调用USEARCH检查并剔除嵌合体序列,获得Effective Tags;随后采用序列比对软件UCLUSTv5.2.236对得到的Effective Tags按照97%的相似度进行OTU聚类[14],并选取其中出现频率最高的序列作为代表序列,最终通过数据库分析确定各OTU对应的分类水平[15]。
数据处理与统计分析采用Microsoft Excel 2010 和SPSS 23.0 软件进行,采用Canoco for Windows 5.0软件对土壤养分、酶活和细菌群落结构的相关性进行冗余分析(Redundancy analysis,RDA)。
2 结果与分析
2.1 不同处理对根际土壤养分含量的影响
土壤养分含量反映土壤的肥力水平,直接影响作物的生长状况。由表2可知,CK处理SOM、AP和AK养分含量均为最低;与NPK处理相比,生物有机肥替代部分化肥(MNPK、MDNPK)提高了根际土壤有机质、总氮、速效磷、速效钾含量,其中,化肥减量10%+生物有机肥(MNPK)处理有机质、总氮、速效磷、速效钾含量均最高,较NPK处理分别增加17.4%,12.4%,16.2%,19.2%。

表2 不同处理对小麦根际土壤养分含量的影响Tab.2 Effects of different treatments on the nutrient content of wheat rhizosphere soil
2.2 不同处理对根际土壤酶活的影响
脲酶是促进土壤氮素循环的关键酶,可以增加土壤中铵态氮的含量,促进植物根系对氮素的吸收利用[16]。蔗糖酶又称转化酶,参与土壤碳素循环过程,与土壤中有机质含量和根际微生物丰富度、多样性密切相关[17]。磷酸酶是一种水解性酶,能促进土壤脱磷,提高土壤中有效磷的含量。由表3可知,CK处理的土壤脲酶、蔗糖酶和中性磷酸酶的活性均为最低;与NPK相比,生物有机肥替代部分化肥(MNPK、MDNPK)处理提高了土壤脲酶、蔗糖酶和中性磷酸酶的活性,其中,MNPK处理S-UE与S-SC活性较NPK处理分别显著升高19.0%和9.7%(P<0.05);MNPK和MDNPK处理,S-NP活性较NPK处理分别显著升高18.3%,21.2%(P<0.05),但MNPK和MDNPK处理间差异不显著。结果表明,MNPK处理显著增加了土壤中S-UE、S-SC、S-NP的活性,与土壤养分含量结果变化一致。
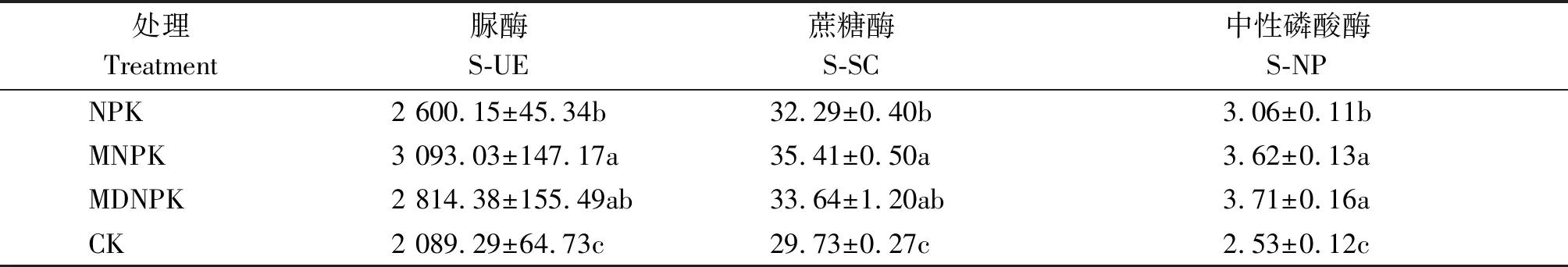
表3 不同处理对小麦根际土壤酶活影响Tab.3 Effects of different treatments on soil enzyme activities in wheat rhizosphere mg/g
2.3 测序结果分析
16S rRNA高通量测序得到的初始序列经质量筛查后,共得到642 180条有效序列,基于97%的相似性进行归并与划分,一共得到12 452个OTU,分别属于29门93纲190目293科528属。通过对不同处理细菌群落OTU变化的Venn图分析,结果发现(图1),CK、NPK、MNPK、MDNPK这4个处理分别得到5 990,5 942,6 034,5 690个OTU;4个处理共有的OTU数有2 073个;特有的OTU数分别为1 640,2 089,1 577,1 460个,其中,NPK处理中特有的OTU数占总OTU数的51.3%,说明仅施化肥会使小麦根际土壤细菌群落OTU数发生显著变化。
Chao1指数和ACE指数用于评价群落丰富度,其中,Chao1指数用于估计群落样本中的OTU数,能更好地评价低丰度物种的分布状况,ACE指数用来估计群落样本中的OTU数,体现了某一OTU在样本中出现的概率;Shannon指数和Simpson指数用于评价群落多样性与均匀度。由表4可知,NPK处理Chao1指数、ACE指数、Shannon指数、Simpson指数均为最低,其中,NPK处理的Chao1指数和ACE指数显著低于MNPK与MDNPK处理。说明只施化肥显著降低了土壤细菌群落丰富度,生物有机肥替代部分化肥有助于恢复土壤细菌群落多样性与丰富度。
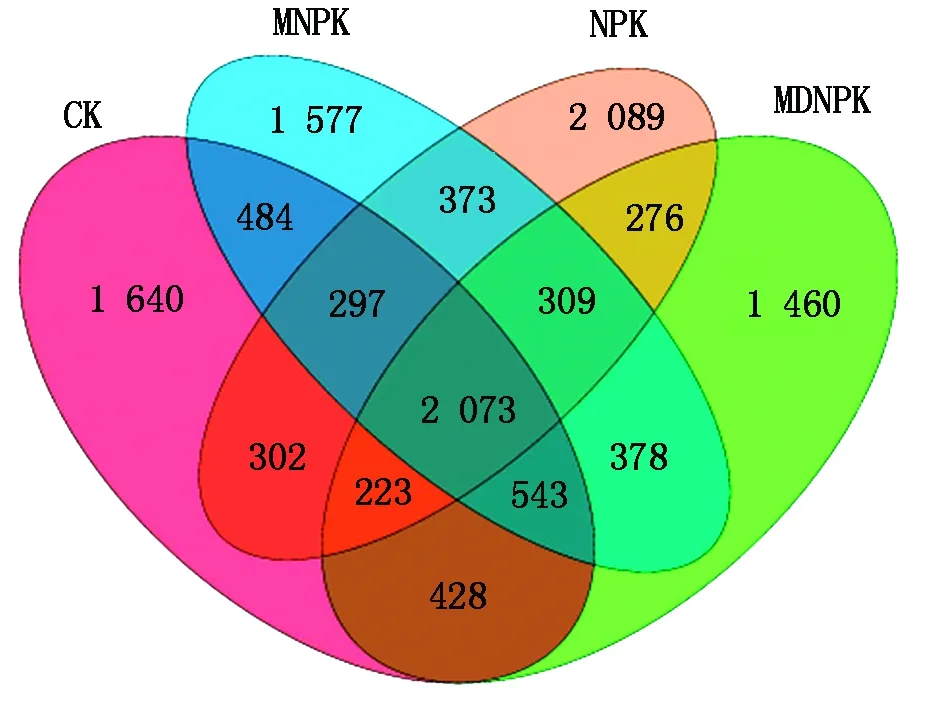
图1 不同处理土壤细菌群落OTU Venn图Fig.1 Venn diagram of soil bacterial community OTUs in soil samples from different treatments
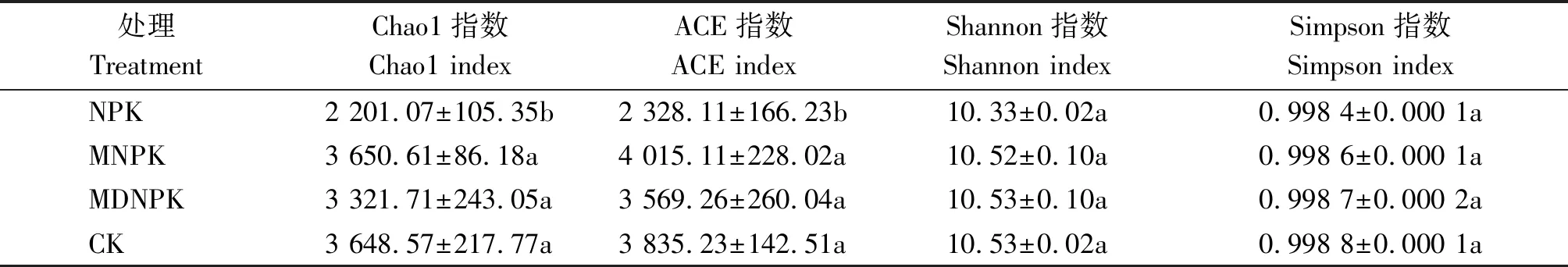
表4 不同处理土壤细菌多样性指数统计Tab.4 Diversity indices statistical results of soil bacterial communities in different treatments
2.4 不同分类水平上的物种注释及分析
2.4.1 基于细菌门水平上群落结构变化 各处理门水平上细菌群落结构如图2所示,在相对丰度前10的门中,变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatimonadetes)为优势菌门,在CK、NPK、MNPK、MDNPK这4个处理中,变形菌门的丰度最高,占29.7%~36.0%;放线菌门占15.4%~17.8%;酸杆菌门占14.6%~19.0%,绿弯菌门占11.4%~12.3%;芽单胞菌门占6.7%~10.9%。在CK、NPK、MNPK、MDNPK这4个处理中,5个优势菌门的丰度分别为86.0%,86.9%,87.2%,85.1%,无显著差异。拟杆菌门(Bacteroidetes)、浮霉菌门(Planctomycetes)、己科河菌门(Rokubacteria)、髌骨细菌门(Patescibacteria)、疣微菌门(Verrucomicrobia)、硝化螺旋菌门(Nitrospirae)等其他菌门丰度较低,为劣势菌门。与NPK处理相比,MNPK与MDNPK处理的变形菌门丰度显著升高(P<0.05),MNPK处理的芽单胞菌门丰度显著升高(P<0.05),其余菌门丰度并无显著变化。结果表明,生物有机肥替代部分化肥使变性菌门、芽单胞菌门这些功能菌门丰度升高,且能够平衡根际土壤中优势菌门的丰度。
2.4.2 基于细菌属水平上群落结构变化 由图3可知,不同处理间细菌群落组成及分布相似,选取丰度前20菌属进行分析,相对丰度>1%的一共有11个菌属。与CK处理相比,MNPK处理丰度升高的有鞘氨醇单胞菌属(Sphingomonas)、水沉积物杆菌属(Ilumatobacter)、溶杆菌属(Lysobacter)、藤黄色单胞菌属(Luteimonas)、野野村菌属(Nonomuraea)、Iamia、马赛菌属(Massilia)等7个菌属;赭黄嗜盐囊菌属(Haliangium)、MND1、RB41、Subgroup_10这4个菌属丰度降低,其中,Subgroup_10丰度显著降低(P<0.05)。与CK处理相比,MDNPK处理丰度升高的有鞘氨醇单胞菌属、水沉积物杆菌属、溶杆菌属、马赛菌属、藤黄色单胞菌属这5个菌属,其中,鞘氨醇单胞菌属丰度显著升高(P<0.05);MND1、野野村氏菌zamia、RB41、Iamia、Subgroup_10、赭黄嗜盐囊菌属这6个菌属丰度降低,其中,赭黄嗜盐囊菌属丰度显著降低(P<0.05)。结果表明,生物有机肥部分替代化肥使小麦根际土壤中鞘氨醇单胞菌属、水沉积物杆菌属、溶杆菌属、马赛菌属丰度升高,赭黄嗜盐囊菌属、Subgroup_10丰度降低,但不会影响优势菌属的种类。
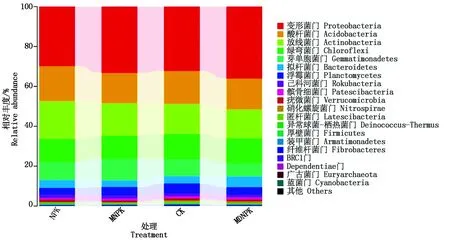
图2 不同处理对细菌门水平相对丰度的影响Fig.2 Effects of different treatments on the relative abundance of the bacterial phyla
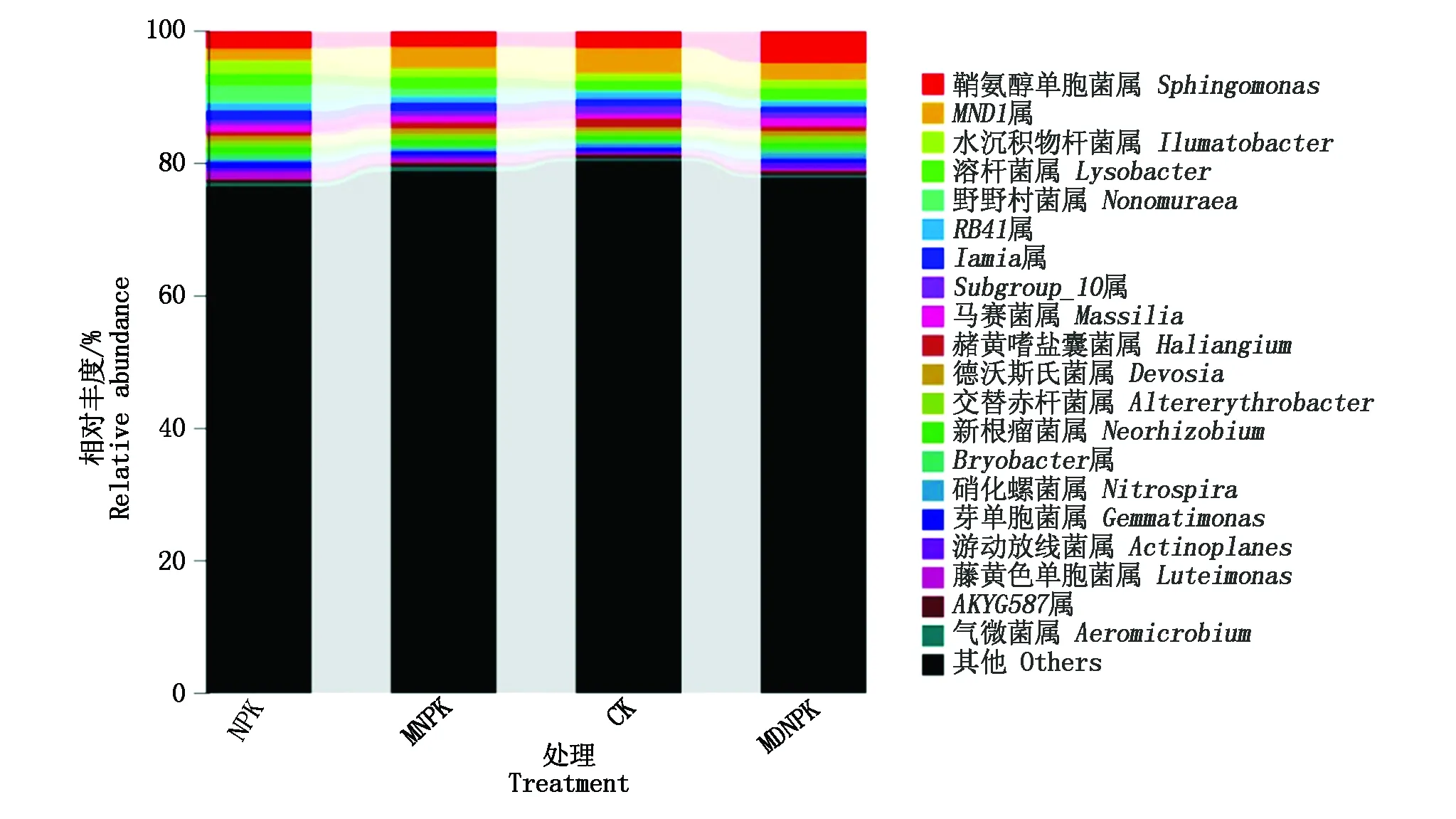
图3 不同处理对细菌属水平相对丰度的影响Fig.3 Effects of different treatments on the relative abundance of the bacterial genera
2.5 土壤细菌群落结构与环境因子的关系
有研究表明,不同的环境因子会影响土壤细菌的群落结构[18-19]。本研究采用冗余分析研究土壤养分含量、酶活对属水平上细菌群落结构的影响,由图4可知,土壤养分与酶活一共解释了77.9%的细菌群落结构变化,第1轴与第2轴分别解释了响应变量的51.8%和16.1%。进一步分析发现,S-NP(P=0.034)和S-SC(P=0.016)是影响细菌群落结构的主要因子;S-NP、S-SC、TN与鞘氨醇单胞菌属、溶杆菌属、交替红色杆菌属、硝化螺旋菌属的丰度正相关,与RB41丰度负相关;S-UE、SOM、AP、AK与水沉积物杆菌属、野野村菌属、Iamia、马赛菌属、德沃斯氏菌属、新根瘤菌属、Bryobacter丰度正相关,与MND1、Subgroup_10、赭黄嗜盐囊菌属丰度负相关。
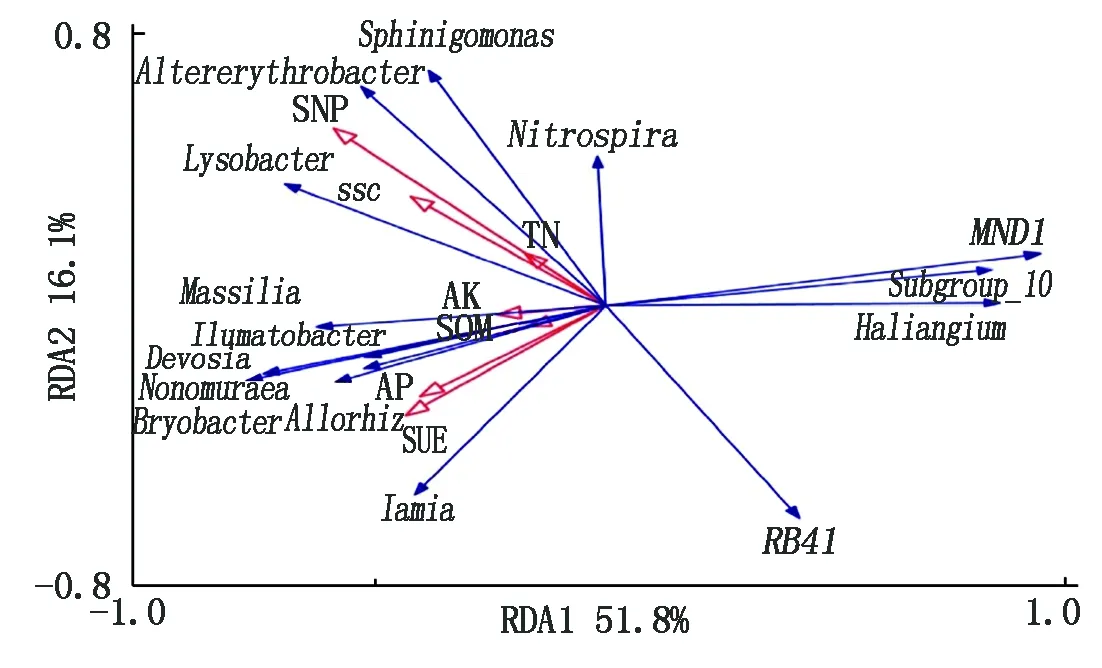
图4 属水平上细菌相对丰度与土壤养分含量、酶活的冗余分析(RDA)Fig.4 Redundancy analysis (RDA)among the relative abundance of the bacterial genera,soil nutrient content and enzyme activities
2.6 不同处理对小麦产量的影响
由表5可知,与单施化肥处理(NPK)相比,生物有机肥替代部分化肥处理对小麦株高、穗粒数和千粒质量等农艺性状均没有显著影响,与NPK处理相比,MNPK与MDNPK处理小麦产量显著提高9.3%,4.4%(P<0.05)。与单施化肥相比,生物有机肥替代部分化肥处理可以保证小麦产量。
3 结论与讨论
3.1 生物有机肥替代部分化肥对根际土壤养分与酶活的影响
植物根际是植物根系、土壤、微生物相互作用的一个微区域。土壤酶活性反映土壤微生物的活性,能更迅速反映不同施肥处理对土壤养分水平的影响[20],在土壤有机质分解与其他养分循环过程中发挥着重要作用[21-22]。土壤养分含量与土壤酶活共同反映土壤的肥力与功能水平,直接影响作物的生长状况,是评价土壤健康水平的重要指标。
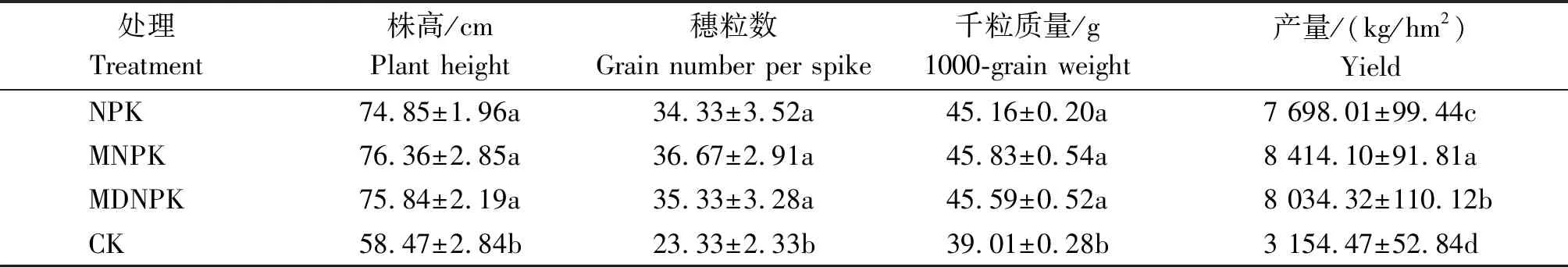
表5 不同处理对小麦农艺性状及产量的影响Tab.5 Effects of different treatments on agronomic trait and yield of wheat
本研究结果表明,与NPK处理相比,MNPK与MDNPK处理后,小麦根际土壤养分SOM、TN、AP、AK含量与土壤酶S-UE、S-SC、S-NP活性均有增加的趋势,且MNPK处理效果最佳,说明化肥与生物有机肥合理组合,能够显著提高土壤养分含量与酶活水平。生物有机肥中含有大量有机质与丰富养分,能改善根际微环境,促进土壤养分的循环与积累,使土壤养分更加均衡,根系能更充分利用土壤养分,有助于土壤酶活性升高[23]。因此,生物有机肥替代部分化肥提高了土壤养分SOM、TN、AP、AK的含量以及土壤S-UE、S-SC、S-N活性,这与文献报道[24-25]的结果相一致。
3.2 生物有机肥替代部分化肥对根际土壤细菌群落的影响
生物有机肥中含有大量促生菌,根际促生菌是土壤微环境的重要组成部分,参与到有机质的分解、养分的转化等一系列土壤生物代谢过程,能降低过量施肥造成的生态退化,帮助修复土壤微生态,抑制土壤传播疾病。本试验对小麦根际土壤细菌群落进行高通量测序发现,生物有机肥替代部分化肥后土壤中变形菌门丰度明显升高,放线菌门丰度降低。变形菌门是一类具有固氮作用的功能微生物,其丰度升高,有利于土壤中氮素的积累和转化利用[26-27],放线菌门适宜生活于有机质含量较低的环境中,肥料中有机质的输入导致放线菌门丰度降低;相反酸杆菌门、拟杆菌门适宜于生活在养分含量高的环境中,故二者丰度呈现增加的趋势[28-29]。根际土壤中富集了鞘氨醇单胞菌属、溶杆菌属、硝化螺菌属、马赛菌属等一些具有促生和生防作用的功能菌属,其中,硝化螺菌属是一类硝化细菌,将土壤中的亚硝酸盐氧化为硝酸盐,供植物吸收利用;马赛菌属会定殖在植物根上[30],产生IAA和嗜铁素,从而促进植物生长[31-32]。
RDA分析显示,S-SC与S-NP活性是引起细菌群落结构变化的主要因素。生物有机肥替代部分化肥后,S-SC与S-NP活性与鞘氨醇单胞菌属、溶杆菌属、交替赤杆菌属、硝化螺菌属正相关,AK含量与水沉积物杆菌属、马赛菌属、新根瘤菌属呈正相关,这与Cheng等[33]的研究结果基本一致。结果表明,生物有机肥替代部分化肥能提高土壤养分有效性和酶活性,增强作物根际效应,定向富集具有生物防治与促生作用的功能微生物菌群,最终促进作物产量的提高。
目前,过量施肥导致化肥利用率过低,土壤养分结构与菌群多样性失衡等问题急需解决,通过调整传统“大水大肥”的施肥模式,探索适宜的生物有机肥替代化肥比例,可为解决该问题提供新的思路。本研究发现,生物有机肥替代10%化肥与常规施肥相比,小麦产量显著增加,但考虑到细菌群落组成与功能之间的复杂关系,短期施肥可能不足以使细菌群落结构发生稳定的差异,需要进行长期定位试验。后续关于小麦在不同土壤环境下,生物有机肥替代化肥最适比例仍有待进一步研究。

