哥斯达黎加链霉菌A-m1的促生作用及解析
史 娟,李永丽,常 乐 ,郑炜凡,周 洲,曲良建
(1.河南科技大学 园艺与植物保护学院,河南 洛阳 471023;2.信阳农林学院 农学院,河南 信阳 464000;3.中国林业科学研究院 森林生态环境与森林保护研究所,国家林业和草原局森林保护重点实验室,北京 100091)
链霉菌 (Streptomyces)可产生多种对植物病原菌有拮抗作用的次生代谢产物,很多链霉菌已经被开发用于植物病害生物防治[1-11]。内生链霉菌可分布于植物的根、茎、叶、果实及种子中,具有很高的应用价值。河南科技大学园艺与植物保护学院林业生物技术实验室前期从新疆野苹果枝干中分离得到一株内生具生防作用的链霉菌菌株 A-m1,其发酵滤液抑菌谱较广、抑菌活性高,具有防治部分作物真菌性病害的应用潜力[12];同时还发现,菌株A-m1发酵液抑菌活性与其色素产生具有同步现象,后经基因组测序比对,最终鉴定该菌株属于哥斯达黎加链霉菌(Streptomycescostaricanus)。
研究发现,一些哥斯达黎加链霉菌菌株对植物生长具有促进作用,如菌株RP92从污染的土壤中分离得到,能显著促进雀稗草 (Tagetespatula)的生长,并且有效减轻由于化学污染对植物产生的毒害作用[13];菌株HR391从土壤中分离得到,对香蕉枯萎病病原菌尖孢镰刀菌 (Fusariumoxysporum)和立枯丝核菌 (Rhizoctoniasolani)有防治效果,并能产生一些促进植物生长的激素[14];从土壤中分离得到的菌株CR-43不仅对土壤中的线虫具有致死性,同时还能够减少辣椒 (Capsicumannuum)和番茄 (Lycopersiconesculentum)植株根际脱落[15]。菌株A-m1具有作为优良生防菌剂开发应用的潜力,其对植物是否具有促生作用,对其进一步开发产品及扩大其应用范围具有重要意义。因此,以番茄幼苗为研究对象,首先明确菌株A-m1具有的促生作用,然后对菌株A-m1进行基因组分析,再明确其促生作用的遗传基础,并生化验证促生作用相关产物的表达情况,为该菌株的进一步开发利用奠定基础。
1 材料和方法
1.1 试验材料
哥斯达黎加链霉菌菌株A-m1,由本实验室从新疆野苹果枝干中分离并保存[12]。固态发酵基质成分是大米∶高粱∶米糠∶稻壳=2∶2∶3∶3(m/m),初始水料比为1.7∶1.0(V/m)。供试番茄品种为中蔬4号。
1.2 试验方法
1.2.1 菌株A-m1的培养 按照菌株A-m1优化的发酵条件[12],液体摇瓶发酵4 d获得新鲜发酵液。在200 mL玻璃瓶中添加固体发酵基质20 g,接种新鲜发酵液2 mL,于28 ℃培养10 d,孢子含量为108个/g。
1.2.2 菌株A-m1固体发酵产物对番茄幼苗促生作用分析 向2 kg泥炭土育苗基质中分别添加1.2.1中培养的菌株A-m1固体发酵物 20,40,60,80 g,4个处理分别记作组1、组2、组3、组4;空白对照添加20 g无菌的固体发酵基质,记作CK。所有基质加水至适宜播种含水量,充分混匀,装袋保湿孵育2 d后装育苗穴盘。
挑选发育良好的番茄种子放入40 ℃温水中浸泡,待种子吸水膨胀后摆放在铺有无菌滤纸片的培养基中,加水保湿,于28 ℃放置48 h。待种子发芽长至根长1~2 cm,挑选生长一致的小苗播种穴盘内(1株/穴),每个处理16株,重复3次。覆土深度1 cm,适时浇水保持基质湿润,置于室外正常培养。培养16 d时测量叶片长度、地上部株高、植株根长、SPAD、整株鲜质量、整株干质量、根干质量以及茎秆直径。其中,叶长、株高和根长利用刻度尺测量,SPAD值含量使用叶绿素仪TYS-4N(北京,中科维禾科技公司)测量植株第一片真叶的叶绿素,番茄幼苗去除根部土壤后电子天平称量,茎秆直径用游标卡尺测量番茄幼苗紧挨地表的茎秆处的直径。采用Excel 2010和SPSS 24.0软件进行数据处理及统计分析。
1.2.3 菌株A-m1全基因组测序 将纯化的菌株A-m1送往北京百迈克公司通过三代Nanopore测序仪进行全基因组测序。通过与Nr数据库进行Blast比对,找到在Nr数据库中最相似的序列,完成测序基因组基因的注释[16]。
1.2.4 菌株A-m1产IAA分析 IAA检测培养基和Salkowski′s显色剂配制均参照文献[17]中的方法。将无菌色氨酸溶液加入IAA检测培养基中,使色氨酸的质量浓度达到0.5 mg/mL,再将培养好的菌株A-m1发酵液按7%的接种量接种于IAA检测培养基中,置于28 ℃、180 r/min 摇床中培养,每隔24 h取一次样,连续取6次,将发酵液置于4 ℃、10 000 r/min离心5 min,取上清液与等量的Salkowski′s显色剂混合均匀,暗反应20 min,若溶液显粉红色,则说明菌株A-m1能产生IAA,以IAA检测培养基为对照,测定OD530值。IAA标准曲线制作:配制1 g/L的IAA母液,将其稀释为0,0.5,1.0,1.5,2.0,2.5,3.0 mg/L等不同质量浓度,分别与Salkowski′s显色剂暗反应20 min,以无菌水为对照,测定OD530值,以质量浓度为横坐标,OD530值为纵坐标,绘制标准曲线。通过IAA的标准曲线计算发酵液中IAA的质量浓度。
1.2.5 菌株A-m1产铁载体分析 采用铬天青(Chromatography CAS)检测法测定菌株A-m1产铁载体活性,将滤纸片用塑料镊子放在CAS检测培养基上,每个滤纸片上滴2 μL发酵液,28 ℃培养5~7 d,观察滤纸片周围是否有黄色透明晕圈,并测定晕圈的直径,计算晕圈直径与滤纸片直径的比值,用于表示菌株产铁载体的活性大小。
2 结果与分析
2.1 菌株A-m1对番茄幼苗的促生作用
番茄苗生长16 d,各组第一片真叶长度(图1-A)、株高(图1-B)、整株鲜质量(图1-C)、整株干质量(图1-D)、根干质量(图1-E)和茎秆直径(图1-F)这6项指标统计结果都是一致的,4个处理组均显著大于CK,且组4显著大于组1、组2和组3。其中,CK叶长为2.61 cm,组1、组2、组3和组4与CK相比分别提高了20.6%,16.5%,17.2%,107.1%。CK株高为3.36 cm,4个处理组与CK相比分别提高了17.9%,18.4%,27.2%,70.7%。CK 整株鲜质量为0.18 g,干质量为16.3 mg,根干质量为2.93 mg,4个处理组整株鲜质量与CK相比分别提高了63.9%,38.9%,62.9%,439.9%,整株干质量分别提高了83.2%,105.3%,87.1%,427.4%,根干质量分别提高了104.8%,111.1%,150.8%,473.4%。CK茎秆直径为1.51 mm,4个处理组与CK相比分别提高了12.3%,9.2%,15.4%,78.7%。说明菌株A-m1对番茄幼苗叶片、株高、生物量和茎秆直径有显著的生长促进作用,促生作用与菌体含量有关,有利于培养番茄壮苗。
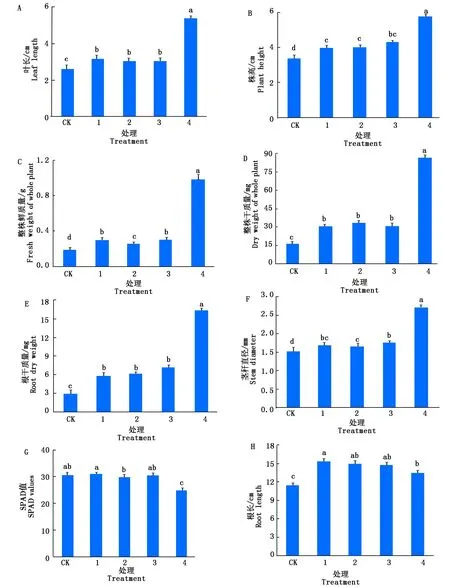
图中小写字母表示差异显著(P<0.05)。图3同。The difference of small letters is significant(P<0.05). The same as Fig.3.
番茄苗生长16 d时,SPAD值统计见图1-G。组1、组2和组3的番茄叶片SPAD值分别为31.04,29.84,30.44,CK番茄叶片SPAD值为30.69,组1、组2、组3与CK不存在显著差异,组4番茄叶片SPAD值仅为24.79,显著低于CK和另外3个试验组。以上结果产生的原因可能是,菌株A-m1导致番茄生长加速,而穴盘内基质较少,氮素等元素短时间供应不足,引起番茄叶片的SPAD值含量暂时减少。
番茄苗生长16 d时,根长统计见图1-H。CK、组1、组2、组3、组4中根长分别为11.35,15.28,14.93,14.65,13.38 cm,统计表明,4个试验组植株根长均显著大于CK,组1与组4差异显著,组2、组3与组4间不存在显著差异。根长最大是菌体含量不太高的组1,菌体最高的组4其根长在4个试验组中最小,同时发现其须根数量较多。
2.2 菌株A-m1全基因组分析
菌株A-m1经测序组装,基因组全长为8 532 264 bp,包含一个线性染色体。全基因组在GenBank中的登录号为CP066774。基因组GC含量为71.81%,预测编码7 477个基因,平均长度1 014 bp,编码序列占整个基因组序列的88.90%。
基因注释分类统计结果显示,菌株A-m1编码有促进植物生长的相关基因,这些基因所分布的位置见图2。A-m1能够编码吲哚乙酸(IAA)(GE 001036)、细胞分裂素(GE 001249、GE 001606)等植物激素。也可以编码一些直接或间接促进植物生长的酶,如ACC脱氨酶(GE 001358、GE 003235)、植酸酶(GE 006609、GE 003625、GE 000591)可以直接作用于植物,促进植物的生长;铁载体(GE 001092、GE 002359、GE 002360、GE 003211、GE 003212、GE 005853、GE 006636)可以与土壤中不易被植物利用的Fe3+结合形成复合物,增强植物对铁离子的吸收,促进植物的生长;磷酸酶(GE 000014、GE 000030、GE 000039、GE 000117、GE 000598、GE 000605)、固氮酶(GE 005760、GE 006065、GE 006099)可以间接地促进植物的生长,磷酸酶可以溶解土壤中一些难溶的磷酸盐,增强植物对磷离子的吸收,而固氮酶可以将空气中的无机氮源转变为有机氮源,增强植物对氮素的吸收,促进植物的生长。
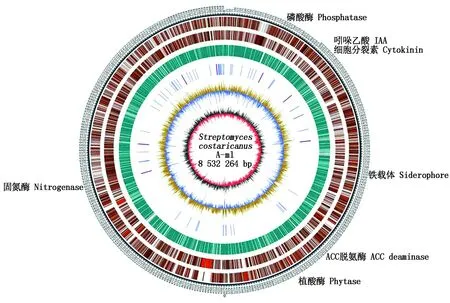
磷酸酶、吲哚乙酸、细胞分裂素、铁载体、ACC脱氨酶、植酸酶、固氮酶在基因组上分布的位置标注在最外圈相对位置。最外面一圈为基因组大小的标示,每个刻度为5 kb;第2圈和第3圈分别为基因组正链和负链上的基因,不同颜色代表不同的COG功能分类;第4圈为重复序列;第5圈为tRNA和rRNA,蓝色为tRNA,紫色是rRNA;第6圈为GC含量,浅黄色部分表示该区域GC含量高于基因组的平均GC含量,峰值越高则与平均GC含量差异越大,蓝色部分则表示该区域GC含量低于基因组的平均GC含量;最内圈是GC-skew,深灰色代表G含量大于C的区域,红色代表C含量大于G的区域。
2.3 菌株A-m1产IAA动态
试验中制作了IAA的标准曲线,线性方程为:y=0.028 5x+0.002 4,R2=0.994 2。将菌株A-m1接种到IAA检测培养基中,离心取上清液与Salkowski′s显色剂暗反应20 min,结果显示粉红色(图3-A),说明菌株A-m1能产IAA。将菌株A-m1接种到IAA检测培养基中,连续6 d取样,随着培养时间的不同,产IAA的量发生了变化(图3-B)。菌株A-m1在培养第2天时,产IAA能力达到最高,为1.036 7 mg/L,与其他5 d差异显著(P<0.05);其余培养天数的IAA产量处于同一水平。
2.4 菌株A-m1产铁载体活性检测
菌株A-m1在CAS培养基上培养,菌落周围的蓝色逐渐变为橙黄色透明晕圈(图3-C),说明菌株可以产生具有螯合铁能力的铁载体,夺取CAS培养基中游离的铁离子,使菌落周围的蓝色变为橙黄色透明晕圈。5 d后,晕圈的直径与滤纸片的直径比值为1.4(图3-D)。

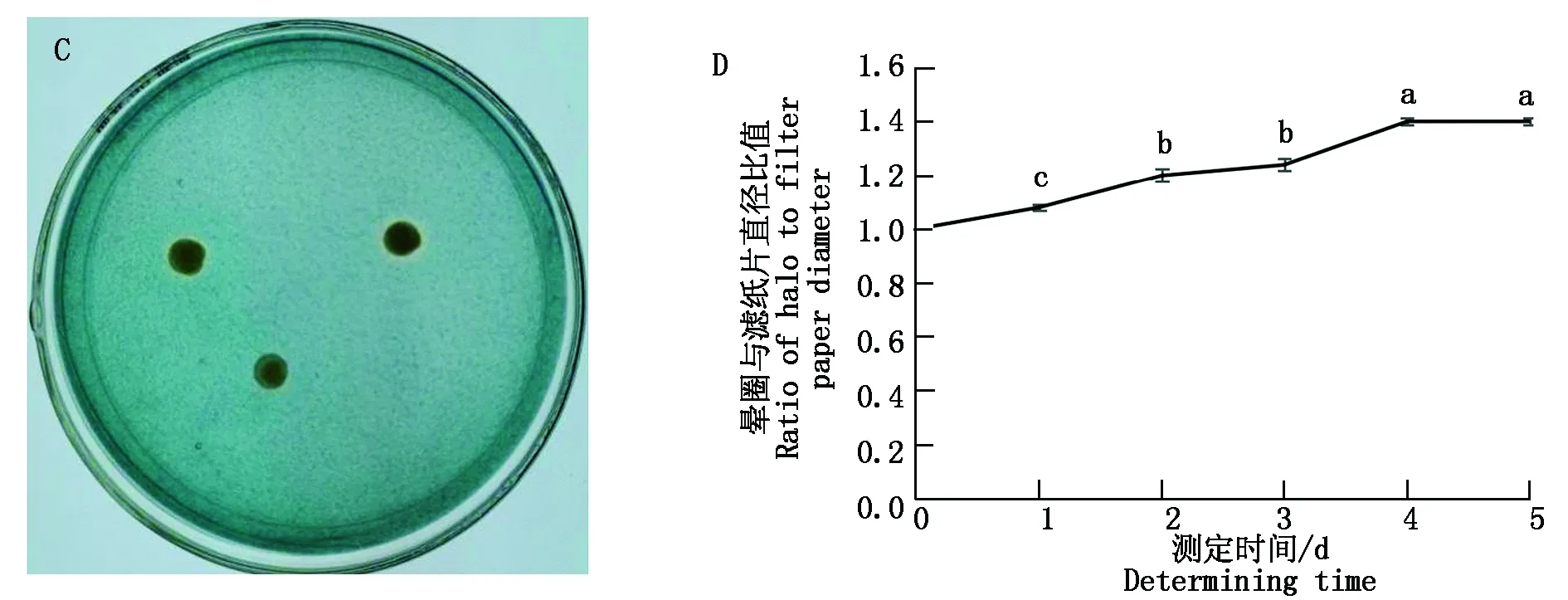
A.菌株A-m1发酵液与Salkowski′s的显色反应:1-3.处理组;4.对照组;B.菌株A-m1产IAA趋势图;C.菌株A-m1在CAS培养基上的生长状态;D.晕圈与滤纸片直径比值的变化图。A.Reaction of A-m1 fermentation broth with Salkowski′s chromogenic agent:1-3.Treatment group;4.Control group;B.Dynamic trend of IAA production by strain A-m1;C.Growth state of A-m1 strain on CAS culture medium;D.The change chart of diameter ratio of halo to filter paper.
3 结论与讨论
链霉菌是一类重要的植物微生物资源,不仅对植物病害具有较好的防治效果,还对植物生长具有较好的促进作用,已有研究表明链霉菌对一些植物具有促生效果,主要表现在提高种子的发芽率,增加植物株高、根长、鲜质量和干质量以及叶绿素含量,且链霉菌的促生效果与其使用浓度有关[18-24]。
研究报道,链霉菌菌株NEAU-D1、菌株D74对番茄幼苗株高、根长、鲜质量、干质量有促生作用[25-26]。本试验中,菌株A-m1对番茄幼苗同样表现出明显促生作用,但菌株A-m1对番茄幼苗株高、根长、鲜质量、干质量等指标表现出的促生作用更强。全基因组测序表明,菌株A-m1具有产生促生作用的一些基因,如生长素、细胞分裂素、铁载体、ACC脱氨酶、植酸酶、磷酸酶、固氮酶相关基因,这从遗传基础上解释了菌株A-m1促生作用产生的原因。
通过对菌株A-m1发酵液进行检测,发现菌株A-m1具有产IAA的能力。在4组不同浓度番茄苗促生试验中,组4的高菌体含量对番茄幼苗株高、叶片、鲜质量、干质量以及茎秆直径的促进作用最显著;同时也发现,组4的根长在处理组中最短,但其须根数量最丰富。李威等[27]用菌株XL-6不同浓度的发酵液处理茄苗试验中发现,发酵液高浓度没有低浓度的促生效果显著,这与本研究中的结果有部分相似。分析本试验中番茄苗促生原因可能是激素作用的结果,A-m1固体发酵基质中激素类物质对植物的生长造成影响,如IAA在植物的生长中存在阈值,植物的不同部位对其需求量不同,IAA对植物根部表现为低浓度促进生长,高浓度抑制生长。
铁载体可以与土壤中不易被植物利用的Fe3+结合形成复合物,增强植物对铁离子的吸收,促进植物的生长[28-30]。经生化分析,菌株A-m1产铁载体的能力得到验证,这与Kim等[14]对菌株HR391促生机理的研究结果相一致。菌株A-m1具有潜在的固氮和溶磷等促进植物生长作用,试验条件下这些潜在的相关基因表达情况如何还有待进一步的研究。
哥斯达黎加链霉菌是重要的一种微生物资源,其抑菌活性、杀虫活性、促进植物生长和降解纤维素的能力在国内外一些研究中有零星报道[31-34],且已报道的对象均来自土壤和海洋环境,但有关植物内生哥斯达黎加链霉菌促生作用及遗传基础研究尚未见报道。本研究中从新疆野苹果分离获得的内生菌株A-m1,前期通过细菌的形态特征、生理生化特征及16s rDNA序列分析初步鉴定为娄彻氏链霉菌,后经全基因组测序分析,修正为哥斯达黎加链霉菌。本试验以菌株A-m1为研究对象,通过测定番茄幼苗生理指标验证了菌株A-m1的促生作用,全基因组分析表明菌株A-m1的促生作用可通过产生生长素、细胞分裂素、铁载体、ACC脱氨酶、植酸酶、磷酸酶、固氮酶等方式实现,解析了其促生作用产生的遗传基础,为其在植物促生方面的功能开发利用奠定了基础。

