与瓜类褪绿黄化病毒P22蛋白互作的寄主因子的筛选
陈思宇,杨 雪,杨灵玲,燕照玲,韩晓玉,李庆伦,李洪连,陈琳琳,孙炳剑,施 艳
(1.河南农业大学 植物保护学院,河南 郑州 450002;2.河南省农业科学院 农业经济与信息研究所,河南 郑州 450002)
瓜类褪绿黄化病毒(Cucurbitchloroticyellowsvirus,CCYV)主要通过烟粉虱(Bemisiatabaci)以半持久性方式进行传播,侵染黄瓜、甜瓜等瓜类作物引起叶片褪绿和黄化,但是叶脉仍然保持绿色,严重时整株植物叶片变黄,已经成为制约瓜类作物产量和品质的重要病原[1-2]。日本最先报道该病害的发生[2]。我国于2011年首次报道了该病害的发生[3]。近年来该病害在我国迅速蔓延,目前在江苏、浙江、上海、台湾、新疆、湖南、山东、北京、海南、广西、河南、河北等地区都有发生[4-8]。
CCYV属于长线形病毒科(Closteroviridae)毛形病毒属(Crinivirus)。基因组由2条正单链RNA组成,RNA1长度为8 607 nt,编码4个阅读框,分别为甲基转移酶(MTR)和RNA解旋酶(Hel)、RNA依赖性RNA聚合酶(RdRp)、P1-6和P22;RNA2长度为8 041 nt,编码8个阅读框,分别为P4.9、Hsp70、P2-6、P59、P9、CP、CPm和P26[2]。
CCYV P22蛋白位于CCYV RNA1 3′末端,分子质量为22 ku。Chen等[9]研究证明了P22作为CCYV编码的沉默抑制子发挥作用。已有研究表明,CCYV P22蛋白与黄瓜SKP1LB1蛋白互作,并且确定了F-box like基序(-LKLLI-)是P22发挥沉默抑制子活性和致病性所必需的区域[9]。甘薯褪绿矮缩病毒(Sweetpotatochloroticstuntvirus,SPCSV)RNA1 3′端编码的P22蛋白能够抑制由双链RNA(dsRNA)诱导的RNA沉默,同时P22也可以抑制沉默信号的传导以及系统性沉默[10-11]。番茄褪绿病毒(Tomatochlorosisvirus,ToCV)RNA1编码的P22可以抑制由正义RNA和dsRNA引起的基因沉默,但是不能抑制沉默信号在细胞间扩散或长距离移动[12],突变P22蛋白中的锌指结构域,发现P22的dsRNA结合能力和沉默抑制子活性不受影响[13],用缺失P22的ToCV RNA1突变体和完整RNA2侵染本氏烟,依然能够成功侵染,却发现缺失P22会增加RNA1的积累量,但RNA2的积累量显著降低,表明P22能够维持ToCV RNA1和RNA2的平衡[14]。
P22作为病毒的沉默抑制子在病毒的致病过程中发挥重要作用,目前有关CCYV P22的研究较少。本研究通过免疫沉淀技术(Immunoprecipitation)筛选与P22互作的候选寄主蛋白,使用串联质谱技术对蛋白质多肽分子进行鉴定分析,通过生物信息学分析确定下一步研究的8个蛋白,分别构建酵母载体进行酵母共转化验证,以确定互作关系,为阐明P22蛋白在CCYV侵染过程中的作用机制奠定基础。
1 材料和方法
1.1 试验材料
1.1.1 供试植物 本氏烟(Nicotianabenthamiana)种植于河南农业大学土传病害课题组实验室温室中。
1.1.2 菌株与载体 大肠杆菌DH5α感受态细胞及农杆菌GV3101感受态细胞购于庄盟生物公司,酵母Y2H Gold菌株来自河南农业大学土传病害课题组实验室,均保存于-80 ℃冰箱。pGADT7-T、pGBKT7-53、pGBKT7-Lam、pGBKT7-P22及pGD3flagP22载体由本实验室保存。
1.1.3 试剂和仪器 Primerstar Max高保真酶、r-TaqDNA聚合酶、DNA Marker以及抗生素AbA为TaKaRa公司产品;限制性内切酶、T4DNA连接酶为NEB公司产品;M-MLV反转录酶为Promega公司产品;一步克隆试剂盒为诺唯赞公司产品;DMSO和高灵敏度化学发光检测试剂盒(eECL Western Blot Kit)为Sigma公司产品;X-α-Gal为北京启维益成科技有限公司产品;卡那霉素、氨苄霉素、利福平、PVDF膜等为北京索莱宝科技有限公司产品;SanPrep柱式质粒DNA小量抽提试剂盒为生工生物工程上海股份有限公司产品;其他试剂为进口和国产分析纯。
电泳仪购自北京六一仪器厂;控温摇床购自上海精宏有限公司;PCR仪为ABI以及Eppendorf产品;凝胶成像系统为美国Proteinsimple产品;高速离心机、超显微紫外分光光度计以及Nanodrop为Thermo产品。
1.2 试验方法
1.2.1 免疫沉淀技术筛选互作候选蛋白 将表达载体pGD3flagP22转化农杆菌感受态GV3101,挑取单菌落验证正确后摇菌。将含有表达载体pGD3flagP22的农杆菌菌液浸润本氏烟叶片下表皮,2 d后采集浸润叶片;加入提取缓冲液(10%甘油、25 mmol/L Tris(pH值7.5)、1 mmol/L乙二胺四乙酸(EDTA)、150 mmol/L NaCl、2%聚乙烯聚吡咯烷酮(PVPP)、10 mmol/L二硫苏糖醇(DTT)、1×蛋白酶抑制剂、0.1% 乙基苯基聚乙二醇(NP40)),从约2.0 g的本氏烟叶片中提取总蛋白质;振荡混匀后在水平摇床上80 r/min冰浴30 min,4 ℃离心取上清,加入20 μL的FLA-M2单克隆抗体亲和凝胶(Sigma-Aldrich)孵育2 h(加入前吸取部分上清液为后续的检测做对照);孵育结束后离心收集琼脂糖珠,用IP缓冲液(10%甘油、25 mmol/L Tris(pH值7.5)、1 mmol/L EDTA、150 mmol/L NaCl、0.1% NP40)洗涤至少3次,最后在30 μL IP缓冲液中重新悬浮。将IP样品在95 ℃下加热10 min,用anti-Flag抗体进行蛋白质印迹检测。
1.2.2 LC-MS/MS分析 将Western Blot检测后的剩余蛋白质样品送至上海中新新生命科技有限公司进行鉴定分析。
1.2.3 蛋白质数据分析 对质谱结果进行分析整理,利用在线Gene ontology(GO)数据库进行分析,分别从生物过程(Biological process,BP)、细胞组分(Cellular component,CC)、分子功能(Molecular function,MF)描述寄主蛋白的相关功能。
1.2.4 候选寄主蛋白的引物设计 根据质谱分析结果筛选出P22互作候选寄主蛋白后,基于NCBI已经发表的基因序列,通过DNAMAN软件设计扩增全长阅读框且携带EcoR Ⅰ和XhoⅠ一步克隆酶切位点的引物(表1),由上海生工生物工程技术服务有限公司合成。

表1 引物序列Tab.1 Primer sequences
1.2.5 互作寄主因子全长阅读框的扩增 选取生长健康本氏烟叶片为材料,用TRIzol法提取总RNA[15]。用超显微紫外分光光度计检测RNA的浓度与纯度,利用M-MLV反转录酶进行反转录合成第一链cDNA。使用Primerstar Max高保真酶扩增候选寄主蛋白全长阅读框序列,PCR反应体系为:94 ℃ 5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 2 min;72 ℃ 10 min。将所获得的PCR产物通过PCR纯化回收试剂盒回收纯化。
1.2.6 互作寄主因子结构域分析 用SMART在线分析(http://smart.embl-heidelberg.de)预测这8个候选寄主蛋白(SAMS1、SAMS2、PKA、GAPC1、GAPC2、GAPDH-A、ATG3、ATG7)的功能域。
1.2.7 酵母双杂交载体的构建 使用限制性内切酶EcoR Ⅰ和XhoⅠ双酶切载体pGADT7和PCR产物(SAMS1、SAMS2、PKA、GAPC1、GAPC2、GAPDH-A、ATG3、ATG7),纯化回收后将二者通过一步克隆法连接,转化DH5α大肠杆菌感受态,筛选并测序后得到正确的pGADT7表达载体。
1.2.8 酵母双杂交技术验证互作 将正确的pGADT7表达载体和pGBKT7-P22共转化酵母感受态Y2H Gold,以pGADT7-T+pGBKT7-53为阳性对照,pGADT7-T+pGBKT7-Kam、pGADT7+pGBKT7-P22以及pGADT7 +pGBKT7为阴性对照,研究重组pGADT7表达载体与pGBKT7-P22之间的相互作用关系,将含有对照及样品的酵母菌分别涂布于含有SD/-Trp/-Leu及SD/-Trp/-Leu/-His/-Ade/AbA/X-α-Gal培养基上。
2 结果与分析
2.1 免疫沉淀技术筛选互作候选寄主因子及GO功能分析
将通过anti-Flag磁珠富集的与P22互作的本氏烟总蛋白质进行质谱检测,共获得128个寄主蛋白。对质谱结果进行GO分析,发现筛选到的与P22蛋白相互作用的寄主蛋白分为39个功能组,分别属于生物过程、分子功能和细胞组分三大类别。在生物过程(BP)类别中光合作用(6个)、蛋白质折叠(5个)、葡萄糖代谢过程(5个)、碳代谢过程(5个)、S-腺苷甲硫氨酸生物合成过程(4个)为主要功能组;从分子功能(MF)角度来看,筛选到的寄主蛋白主要发挥ATP结合(32个)、金属离子结合(8个)、转移酶活性(6个)、锌离子的结合(5个)、蛋白激酶活性(5个)等功能;在细胞组分(CC)类别中生物膜(11个)、细胞质(7个)、光系统Ⅱ氧化复合体(5个)、叶绿体(4个)为主要功能组(图1)。
2.2 互作寄主因子的KEGG功能分析
由于P22蛋白作为CCYV编码的沉默抑制子发挥作用,结合质谱分析结果,根据富集肽段数目和蛋白质功能筛选出8个候选寄主蛋白(表2)。根据KEGG数据库的注释信息,对8个候选寄主蛋白参与的代谢途径进行注释。KEGG数据库分析表明,8个候选寄主蛋白可能参与或涉及的代谢通路主要包括次生代谢物的生物合成、微生物代谢、碳代谢、氨基酸的生物合成、糖降解/糖异生、光合生物中的碳固定、HIF-1信号通路、半胱氨酸和蛋氨酸的代谢等,大类可以归为寄主体内的碳水化合物代谢、能量代谢以及信号转移等3个代谢途径(表3)。其中与代谢通路相关的蛋白质共有6个,与次生代谢物的生物合成和氨基酸的生物合成相关的蛋白质有5个,与微生物代谢、碳代谢及光合生物中的碳固定相关的蛋白质有4个,与糖降解/糖异生和HIF-1信号通路相关的蛋白质有3个。
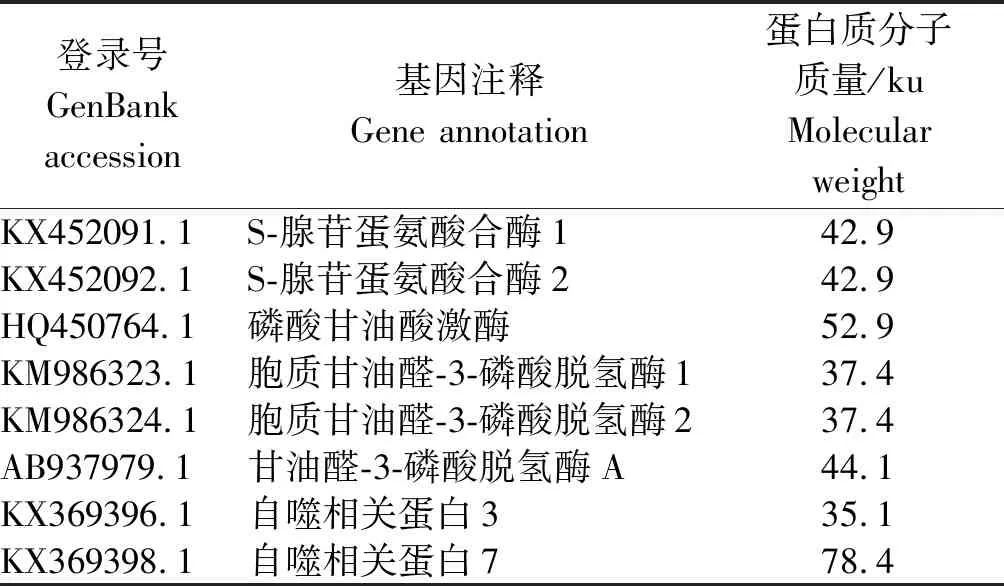
表2 与CCYV P22互作的本氏烟蛋白Tab.2 Proteins in Nicotiana benthamiana interacting with CCYV P22
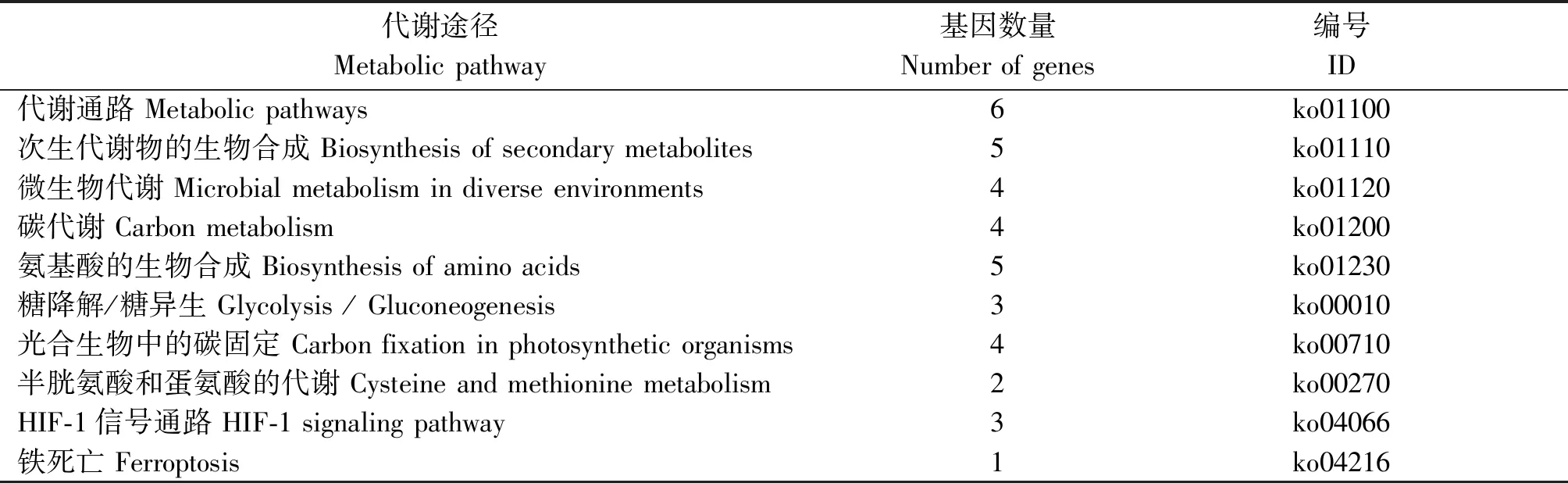
表3 互作蛋白代谢途径分析Tab.3 The metabolic pathways analysis of interacted host proteins
2.3 互作寄主因子全长阅读框的扩增及结构域分析
以本氏烟cDNA为模板,使用Primerstar Max高保真酶PCR扩增互作寄主因子的全长阅读框,得到8个特异性条带(图2),纯化回收DNA,将其分别构建到酵母载体pGADT7上,获得重组载体。用SMART在线分析(http://smart.embl-heidelberg.de)预测这8个候选寄主蛋白的功能域(图3)。SAMS蛋白由3个S-AdoMet_synt结构域组成,参与碳代谢途径(图3-A、B);PKA蛋白由PGK结构域组成(图3-C);GAPC1和GAPC2蛋白由一个位于N端的Gp_dh_N结构域和位于C端的Gp_dh_C结构域组成(图3-D、E);GAPDH-A蛋白由一个位于N端的Gp_dh_N结构域和位于C端的Gp_dh_C结构域组成,而且在N端还有一个低复杂区(图3-F);ATG3蛋白由位于N端的Autophagy_N结构域、位于中间的Autophagy_act_C结构域和位于C端的Autophagy_C结构域组成(图3-G);ATG7蛋白由位于N端的ATG7_N结构域和ThiF结构域,以及位于C端的低复杂区组成(图3-H)。
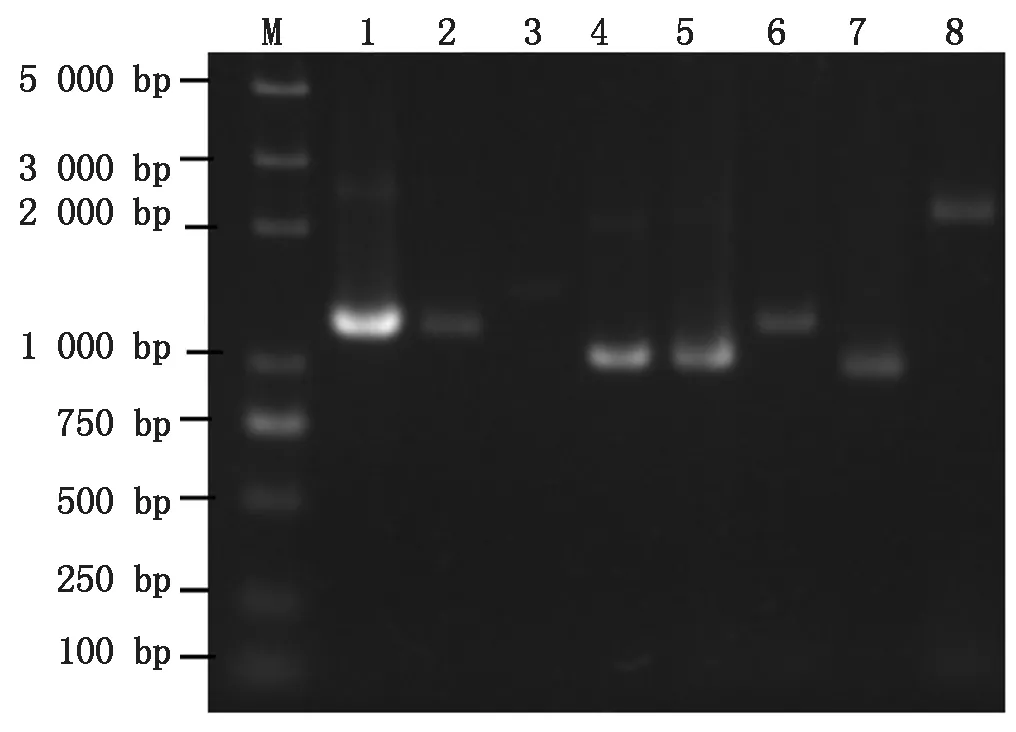
M.DNA Marker;1.SAMS1 PCR产物(1 173 bp);2.SAMS2 PCR产物(1 173 bp);3.PKA PCR产物(1 446 bp);4.GAPC1 PCR产物(1 023 bp);5.GAPC2 PCR产物(1 014 bp);6.GAPDH-A PCR产物(1 206 bp);7.ATG3 PCR产物(960 bp);8.ATG7 PCR产物(2 142 bp)。
2.4 酵母双杂交技术验证互作
将测序正确的pGADT7重组载体和pGBKT7-P22共转化酵母感受态Y2H Gold,结果表明,酵母菌在二缺培养基上均能生长,说明重组质粒成功转入酵母菌中,其中pGBKT7-P22/pGADT7-GAPDH-A及阳性对照能够在缺陷型培养基SD/-Trp/-Leu/-His/-Ade平板上生长,说明GAPDH-A蛋白与P22蛋白有相互作用。进一步将其在SD/-Trp/-Leu/-His/-Ade/AbA/X-α-Gal培养基培养并观察,发现阳性对照和组合pGADT7-GAPDH-A+pGBKT7-P22可以变蓝并生长,阴性对照和其他组合变红且不生长(图4),表明GAPDH-A和P22能够互作。
3 结论与讨论
CCYV是2010年正式报道命名的新病毒,该病毒引起的病害发生重,蔓延快,已经成为瓜类作物上的一种重要病害[16]。位于CCYV RNA1 3′末端的P22蛋白已被证实是CCYV的沉默抑制子[9],因此,筛选与P22蛋白互作的寄主因子对明确病毒的侵染机制有重要意义。
本研究通过免疫沉淀技术筛选出8个互作寄主因子,其中ATG7蛋白未能获得正确的pGADT7表达载体,故未进行后续的酵母双杂交验证。根据KEGG数据库分析表明,筛选到的寄主蛋白涉及10个具体的代谢途径分支,其中与代谢通路相关的蛋白质共有6个,与次生代谢物生物合成和氨基酸生物合成相关的蛋白质有5个,与微生物代谢、碳代谢及光生物中的碳固定相关的蛋白质有4个,与糖降解/糖异生和HIF-1信号通路相关的蛋白质有3个。说明互作的寄主蛋白参与到寄主植物的碳水化合物代谢、能量代谢以及信号转移等代谢途径中,从而影响寄主的生长发育。

A.SAMS1的功能域;B.SAMS2的功能域;C.PKA的功能域;D.GAPC1的功能域;E.GAPC2的功能域;F.GAPDH-A的功能域;G.ATG3的功能域;H.ATG7的功能域。数字单位为dal。

图4 酵母双杂交检测P22与寄主蛋白的相互作用Fig.4 Yeast two-hybrid detection of interaction between P22 and host proteins
通过酵母双杂交验证7个互作寄主因子,结果显示,GAPDH-A蛋白与P22蛋白互作。3-磷酸甘油醛脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)是碳代谢中的关键酶之一,催化3-磷酸甘油醛转化为含高能磷酸键的1,3-二磷酸甘油酸,进一步反应生成3-磷酸甘油酸和ATP。近年来的研究表明,GAPDH具有功能多样性,参与植物的生长发育、花粉管萌发、光合作用和自噬途径等[17-19],并且能够响应多种生物和非生物胁迫[20-24]。GAPDH也参与了病毒侵染植物过程,作为碳代谢中的重要酶,GAPDH促进了番茄丛矮病毒(Tomatobushystuntvirus,TBSV)的RNA非正常合成,导致TBSV基因组RNA积累量减少[25]。柑橘衰退病毒(Citrustristezavirus,CTV)利用GAPDH与病毒蛋白P23互作,促进病毒侵染[26]。同时,GAPDH还促进了黄瓜花叶病毒(Cucumbermosaicvirus,CMV)复制酶p1a和p2a的互作[20]。除此之外,木尔坦棉花曲叶病毒卫星(CottonleafcurlMultanbetasatellite,CLCuMuB)βC1可以通过破坏GAPDH与ATP3之间的互作而激活植物自噬[27]。
GAPDH-A蛋白是叶绿体定位GAPDH的一个亚基,主要位于植物和藻类的叶绿体中,参与卡尔文-本森循环[28-29]。GAPDH-A可以辅助红三叶草坏死花叶病毒(Redclovernecroticmosaicvirus,RCNMV)的运动蛋白MP正确定位于病毒运动复制复合体的膜上,从而完成病毒的侵染[30]。推测GAPDH-A蛋白可能通过与P22蛋白互作而促进CCYV侵染。同时P22蛋白与GAPDH-A蛋白互作可能影响其功能,从而影响植物的正常代谢过程,导致植物出现褪绿黄化症状。本研究为进一步阐明P22蛋白在CCYV侵染过程中发挥的作用机制奠定了基础,有助于解析CCYV的致病机制。

